Wasserzustände: Gas, Flüssigkeit und Feststoff
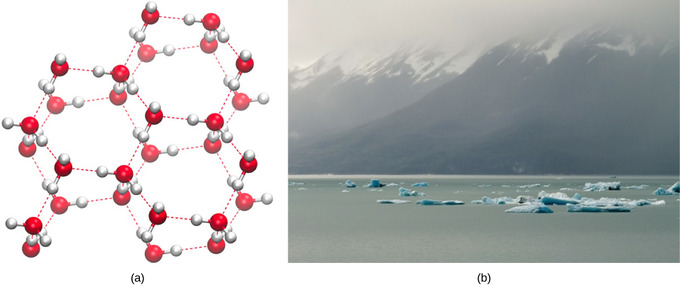
Die Bildung von Wasserstoffbrückenbindungen ist eine wichtige Eigenschaft von flüssigem Wasser, die für das Leben, wie wir es kennen, von entscheidender Bedeutung ist. Da Wassermoleküle Wasserstoffbrückenbindungen eingehen, nimmt Wasser im Vergleich zu anderen Flüssigkeiten einige einzigartige chemische Eigenschaften an. Da Lebewesen einen hohen Wassergehalt haben, ist das Verständnis dieser chemischen Eigenschaften der Schlüssel zum Verständnis des Lebens. In flüssigem Wasser werden ständig Wasserstoffbrücken gebildet und aufgebrochen, wenn die Wassermoleküle aneinander vorbeigleiten. Das Aufbrechen dieser Bindungen wird durch die Bewegung (kinetische Energie) der Wassermoleküle aufgrund der im System enthaltenen Wärme verursacht. Wenn die Wärme beim Kochen von Wasser erhöht wird, lösen sich die Wasserstoffbrücken aufgrund der höheren kinetischen Energie der Wassermoleküle vollständig auf und Wassermoleküle können als Gas (Dampf oder Wasserdampf) in die Luft entweichen. Wenn andererseits die Wassertemperatur gesenkt wird und Wasser gefriert, bilden die Wassermoleküle eine kristalline Struktur, die durch Wasserstoffbrückenbindung erhalten bleibt (es gibt nicht genügend Energie, um die Wasserstoffbrückenbindungen aufzubrechen). Dies macht Eis weniger dicht als flüssiges Wasser, ein Phänomen, das bei der Verfestigung anderer Flüssigkeiten nicht zu beobachten ist.
Phasen der Materie: Sehen Sie, was mit intermolekularen Bindungen während Phasenänderungen in dieser Interaktion geschieht.
Die geringere Dichte von Wasser in fester Form ist auf die Ausrichtung der Wasserstoffbrücken beim Gefrieren zurückzuführen: Die Wassermoleküle werden im Vergleich zu flüssigem Wasser weiter auseinander gedrückt. Bei den meisten anderen Flüssigkeiten umfasst die Verfestigung bei sinkender Temperatur die Verringerung der kinetischen Energie zwischen den Molekülen, wodurch diese noch dichter als in flüssiger Form gepackt werden können und der Feststoff eine größere Dichte als die Flüssigkeit erhält.
Die niedrige Die Dichte des Eises, eine Anomalie, führt dazu, dass es an der Oberfläche von flüssigem Wasser wie einem Eisberg oder den Eiswürfeln in einem Glas Wasser schwimmt. In Seen und Teichen bildet sich auf der Wasseroberfläche Eis, das eine isolierende Barriere bildet, die die Tiere und Pflanzen im Teich vor dem Einfrieren schützt. Ohne diese isolierende Eisschicht würden im Teich lebende Pflanzen und Tiere im festen Eisblock gefrieren und könnten nicht überleben. Die nachteilige Wirkung des Einfrierens auf lebende Organismen wird durch die Ausdehnung des Eises relativ zu flüssigem Wasser verursacht. Die Eiskristalle, die sich beim Einfrieren bilden, brechen die empfindlichen Membranen, die für die Funktion lebender Zellen wesentlich sind, und beschädigen sie irreversibel. Zellen können das Einfrieren nur überleben, wenn das Wasser in ihnen vorübergehend durch eine andere Flüssigkeit wie Glycerin ersetzt wird.