US Pharm. 2013; 38 (11) (Onkologie-Ergänzung): 3-6.
ZUSAMMENFASSUNG: Anämie ist eine häufige Komplikation bei stationären Krebspatienten. Es kann entweder durch den Tumor selbst oder durch das verwendete chemotherapeutische Regime verursacht werden. Der Schweregrad und die Prävalenz des Zustands variieren aufgrund einer Reihe von Faktoren. Die Behandlung zielt darauf ab, die Sauerstofftransportkapazität des Blutes zu erhöhen, Müdigkeit zu verringern und die allgemeine Lebensqualität des Patienten zu verbessern. Erythrozytose-stimulierende Mittel, Eisensupplementierung und Transfusionen roter Blutkörperchen wurden in verschiedenen Umgebungen empfohlen. Obwohl sich dies bei einigen Patienten als vorteilhaft erwiesen hat, muss die optimale Therapiemodalität noch ermittelt werden.
Anämie ist eine Hauptursache für Morbidität bei Krebspatienten, die mit schlechter körperlicher Leistung, Prognose und therapeutischem Ergebnis verbunden ist.1 Laut der World HealthOrganization ( WHO), Anämie ist definiert als ein Hämoglobin (Hb) -Spiegel von < 12 g / dl bei nicht schwangeren Frauen und < 13 g / dl bei Männern ≥ 15 Jahre.2
Epidemiologie
Anämie ist eine der häufigsten Manifestationen bei stationären Krebspatienten. Tatsächlich wurde gezeigt, dass 30% bis 90% der Allkrebspatienten anämisch sind, eine Zahl, die von der Art des Krebses und der Definition der verwendeten Anämie abhängt.3 Die Inzidenz und der Schweregrad der Anämie hängen von einer Reihe von Faktoren ab. die in TABELLE 1.4,5

Ätiologie h2 aufgeführt sind >
Die Hauptursache für Anämie bei Krebspatienten ist zweierlei: der Krebs selbst und die zur Behandlung des Krebses verwendete Therapie. Krebszellen, die das Knochenmark infiltrieren, können die Hämatopoese direkt unterdrücken und Anämie verursachen. Darüber hinaus setzen die Krebszellen Zytokine frei, die zur Eisenbindung führen können, wodurch die Produktion roter Blutkörperchen (RBCs) verringert wird. Tumore können zu chronischem Blutverlust an der Tumorstelle führen, was zu einer fortschreitenden Anämie durch Krebs und Organschäden führt.6
Dieses Problem wird durch Blutverluste, Ernährungsdefizite, Hämolyse, endokrine Störungen, Erbkrankheiten, Niereninsuffizienz oder das Vorhandensein von entzündlichen Zytokinen im Zusammenhang mit Krebs und chronischen Krankheiten.4,6 Krebspatienten neigen dazu, ihren Appetit zu verlieren, was zu Nährstoffmängeln führt. Bei Patienten mit gastrointestinalen (GI) Tumoren führt eine Malabsorption von Nährstoffen ebenfalls zu Mängeln. Die Hämolyse resultiert aus immunvermittelten Antikörpern, die die Gerinnungsfähigkeit beeinflussen. Infolgedessen ist Anämie eine häufige Komorbidität bei Patienten, bei denen kürzlich Krebs diagnostiziert wurde. Fast die Hälfte der mit gynäkologischem Krebs diagnostizierten Patienten und ein Drittel der mit Non-Hodgkin-Lymphom diagnostizierten Patienten haben zum Zeitpunkt der Diagnose eine Anämie.
Darüber hinaus ist die Myelosuppression eine der Nebenwirkungen der Chemotherapie und ein wesentlicher Faktor für die Anämie . Insbesondere die Strahlentherapie des Skeletts verursacht auch eine hämatologische Toxizität und damit eine Anämie.6
Symptome
Die häufigsten Symptome einer Anämie sind Müdigkeit, Dyspneaupon-Anstrengung, Herzklopfen, Depression, Herzinsuffizienz und kognitive Beeinträchtigung Funktion, Schwindel und Herzinsuffizienz.7,8
Diagnose
Das Ausmaß des Anämieproblems bei Krebspatienten wird durch suboptimale diagnostische Maßnahmen, das Fehlen einer Standarddefinition und die Tatsache, dass die Ursache häufig multifaktoriell ist.6,9 Es sollte eine detaillierte Anamnese erstellt werden, in der die Dauer und die Zeit bis zum Einsetzen der Symptome, das Vorhandensein komorbider Zustände, die Familienanamnese und die Vorgeschichte der Exposition gegenüber Antineoplastika und Bestrahlung aufgezeichnet werden. Eine aphysische Untersuchung zur Überprüfung auf Synkope, Atemnot, Kopfschmerzen, Schwindel, Brustschmerzen, Müdigkeit, abnormale Menstruation bei Frauen und Blässe sollte durchgeführt werden.6
Das National Cancer Comprehensive Network empfiehlt die Durchführung einer aCBC bei Patienten mit ein Hb < 11 g / dl oder eine Verringerung der Hb-Zahl von 2 g / dl. Dies ist nützlich, um festzustellen, ob Zytopenien vorliegen. Eine visuelle Überprüfung des peripheren Blutausstrichs zur Bestätigung von Größe, Form und Farbe der Erythrozyten wird ebenfalls empfohlen.6
Pathophysiologie
Anämie ist das Ergebnis einer Kombination von verminderten zirkulierenden Erythrozyten , reduziertes gepacktes Zellvolumen und reduzierte Hb-Spiegel.6Dies kann durch verschiedene pathophysiologische Mechanismen auftreten, einschließlich übermäßigem Blutverlust, erhöhter Zerstörung von Erythrozyten und verringerter Federythropoese. Erythropoetin (EPO), Vitamin B12, Folsäure und Eisen sind für die Erythropoese essentiell. Erythropoetin steuert die Reifung, Differenzierung und das Überleben von Erythroidzellen während dieses Prozesses.10 EPO wird hauptsächlich von den Nieren produziert und zum Knochenmark transportiert.11
Ein abnormaler Eisenstoffwechsel oder die Eisenretention in den Makrophagen verringert die Menge an Eisen, das für die Forerythropoese verfügbar ist.Der veränderte Eisenstoffwechsel wird hauptsächlich durch Hepcidin verursacht, ein Protein, das die Eisenaufnahme im Darm sowie die Eisenfreisetzung durch die Makrophagen verringert. Die Produktion von Hepcidin wird durch aus Tumoren freigesetzte Zytokine erhöht, wodurch die Menge an zirkulierendem Eisen verringert wird. Es wurde auch gezeigt, dass die Produktion von Zytokinen wie Interleukin (IL) -6 durch bestimmte chemotherapeutische Therapien erhöht wird.5 Wiederholte Zyklen der Chemotherapie können die Verringerung der Erythropoese kumulativ verschlechtern.7
Wenn die Sauerstoffzufuhr verringert wird, Die Gewebezellen des Körpers werden hypoxisch, was zu einer Reihe physiologischer Reaktionen führt, wenn der Körper versucht, die Sauerstoffversorgung des Gewebes zu erreichen oder aufrechtzuerhalten.
Es wird angenommen, dass die normale Verwendung von Patienten mit Eisenkrebs durch eine Wechselwirkung zwischen den Tumorzellen unterbrochen werden kann und das eigene Immunsystem des Wirts. Diese Wechselwirkung führt zur Hochregulation spezifischer entzündlicher Zytokine wie IL-1, Gammainterferon und Tumornekrosefaktor Alpha (TNF-α), die die Differenzierung von Erythroid-Vorläufern im Knochenmark verringern, die normale Eisenverwertung beeinträchtigen und die normale Hypoxie hemmen Drivenerythropoietin-Produktion. Nephrotoxische Chemotherapeutika können das Problem verschlimmern, indem sie eine Nierenfunktionsstörung verursachen.
Bei chronischer Anämie wurde gezeigt, dass Tumore Ananämie-induzierenden Faktor freisetzen, ein Molekül, das die Lebensdauer vonerythrozyten verkürzt. Dies verschlimmert die Anämie bis zu einem Punkt, an dem Erythropoese das schlechtere Überleben der Erythrozyten nicht kompensieren kann.12
Risikofaktoren für Anämie bei Krebs
Die folgenden Risikofaktoren wurden für Anämie bei Krebs identifiziert9:
- Myelosuppressive Chemotherapie oder Strahlentherapie
- Niedrige Hb-Spiegel (10-12 g / dl) zu Beginn der zytotoxischen Chemotherapie
- Verabreichung von Platin- Enthält Therapien, die auch den Bedarf an Transfusionsunterstützung erhöhen.
Behandlung
Abgesehen von einer allgemeinen Verbesserung der Lebensqualität des Patienten ist die Behandlung von Anämie für eine Reihe von Patienten von wesentlicher Bedeutung Anämie beeinträchtigt die Abgabe ausreichender Mengen an Sauerstoff an alle Zellen, einschließlich Tumorzellen.7 Da eine geringe Sauerstoffversorgung des Gewebes mit einer verringerten Empfindlichkeit von Tumoren gegenüber Strahlung und anderen Formen der Chemotherapie verbunden ist, ist die Wirksamkeit dieser Behandlungen bei Anämie verringert.13,14
Das Ziel der Therapie sollte darin bestehen, das Sauerstoff-Carryin zu erhöhen g Kapazität des Blutes und Behandlung der zugrunde liegenden Ursache. Grunderkrankungen wie Mangelernährung sind leichter zu behandeln als andere, wie okkulter Blutverlust. Für die Behandlung von Krebspatienten mit Anämie stehen verschiedene Optionen zur Verfügung. Dazu gehören 15:
- Geeignete ergänzende Therapie mit Folsäure und / oder Vitamin B12 zur Korrektur von Nährstoffmängeln
- Erythropoese-stimulierende Mittel (ESAs)
- Eisenergänzung
- Bluttransfusionen, die für Patienten mit akutem schwerem Blutverlust angezeigt sind. Für Patienten mit chronischer Anämie werden erythropoetische Mittel bevorzugt.
Erythropoese-stimulierende Mittel: ESAs, einschließlich rekombinantes menschliches Erythropoietin alfa (rHuEPO; Procrit, Epogen) und Darbepoetin alfa (Aranesp) traditionell für die Behandlung von Anämie bei Patienten mit chronischer Niereninsuffizienz entwickelt. Sie haben ähnliche Wirksamkeit und Einschränkungen gezeigt, wenn sie bei Krebspatienten mit Anämie unvergleichliche Dosen angewendet haben.5 ESAs sind für die Behandlung von Patienten indiziert, deren endogener EPO-Spiegel ungewöhnlich niedrig ist, da der ESA-Wirkmechanismus und die immunologischen und hämatologischen Wirkungen denen endogener EPO.9-Studien ähnlich sind rHuEPO-Untersuchungen haben gezeigt, dass es die Hblevels und die Lebensqualität der Patienten verbessert und den Transfusionsbedarf senkt.15,16 Es wurde vorgeschlagen, dass ESAs auch die kognitive Funktion von Patienten verbessern, die eine Chemotherapie erhalten.17
Eine systemische Überprüfung durchgeführt von der American Cancer Society. zeigte, dass ein optimaler klinischer Nutzen einer erythropoetischen Behandlung einer durch Chemotherapie induzierten Anämie durch frühzeitiges Eingreifen erreicht werden kann.18 Die Verwendung von ESAs bietet eindeutig einen Vorteil. Alle anderen Ursachen der Anämie sollten jedoch vor der Anwendung der ESA-Therapie untersucht und behoben werden.
Darbepoetin und rHuEPO sind beide zur Behandlung von Anämie bei Patienten mit nichtmyeloischen Malignitäten bei Whomanämie im Zusammenhang mit einer Chemotherapie angezeigt.5 Die American Society of Hämatology (ASH) und die American Society of Clinical Oncology (ASCO) empfehlen, die Behandlung zu beginnen, wenn die Hb-Spiegel unter 10 g / dl fallen, und die Dosierung zu reduzieren, wenn die Hblevels um mindestens 1 g / dl um 2 erhöht werden Wochen.19 Ziel der Therapie sollte es sein, das Hb auf die niedrigste Konzentration zu bringen, um eine Transfusion zu vermeiden. Wenn nach 6 bis 8 Wochen Behandlung kein minimaler Anstieg von 1 bis 2 g / dl Hb erreicht wird, sollte die ESA-Therapie abgebrochen werden.18 Obwohl es schwierig ist, das Ansprechen des Patienten auf diese Therapien anhand der aktuellen Daten vorherzusagen, wurde gezeigt, dass etwa 50% bis 60% der Patienten einen Anstieg des Hb um 2 g / dl zeigen, wenn sie mit rHuEPO.9 behandelt werden. Die ESA-Therapie sollte nach Abschluss der Therapie abgebrochen werden Der Chemotherapiekurs.20,21
Die empfohlene Dosierung für Darbepoetin alfa beträgt 2,25 mcg / kg als wöchentliche subkutane (SC) Injektion. Wenn die Hb-Spiegel nach 6 Wochen nicht um mindestens 1 g / dl ansteigen, sollte die Dosierung auf 4,5 mcg / kg erhöht werden. Wenn die Hb-Spiegel in einem Zeitraum von 2 Wochen um mehr als 1 g / dl ansteigen oder wenn Hb 12 g / dl überschreitet, sollte die Darbepoetin-Dosierung um 40% reduziert werden.20 Darbepoetin sollte gestoppt werden, wenn die Hb-Spiegel über 13 g / dl steigen. 9
Die empfohlene Dosierung von rHuEPO beträgt 40.000 U SC einmal wöchentlich oder 150 U / kg SC dreimal wöchentlich bei stationären Patienten, deren Hb-Spiegel unter 10 g / dl liegen. Die Dosierung von rHuEPO sollte um 25% reduziert werden, wenn der Hb-Spiegel > 1 g / dl in einem Zeitraum von 2 Wochen ansteigt oder einen Wert erreicht, der zur Vermeidung einer RBC-Transfusion erforderlich ist.21
ESAs sind in einer Durchstechflasche verpackt, die nicht geschüttelt werden sollte, da sie denaturieren.20,21 Der Inhalt der Durchstechflasche sollte nicht verdünnt oder gepoolt werden.
Die Risiken einer ESA-Therapie sollten ebenfalls bestehen berücksichtigt. Es wird angenommen, dass ESAs unerwünschte kardiovaskuläre Ereignisse erhöhen, das Risiko einer venösen Thromboembolie erhöhen, das Fortschreiten des Tumors insgesamt verkürzen und das Überleben bei anämischen Krebspatienten durch unterschiedliche Mechanismen verringern.22,23 Aus diesem Grund wird die Verwendung von ESAs bei Krebspatienten, die sich nicht unterziehen, nicht empfohlen Behandlung mit Chemotherapie oder Strahlentherapie.24 Alle ESAs werden mit einer Blackbox-Warnung zur Erhöhung des Risikos für Tod, Myokardinfarkt, Schlaganfall, venöse Thromboembolie, Thrombose des Gefäßzugangs sowie Tumorprogression und Rezidiv geliefert.20,21 Das ESA APPRISE OncologyProgram wurde von erstellt Die FDA berät Patienten, Pflegekräfte und Angehörige der Gesundheitsberufe über die sichere Anwendung von ESAs.25
Eisensupplementation: Eine Eisensupplementation, vorzugsweise parenteral, ist bei Patienten mit niedrigem Offerritinspiegel angezeigt ( 30 ng / ml), Transferrinsättigung (TSAT < 15%) und niedrig (< 26 pg / Zelle ) Retikulozyten-Hb-Gehalt t (CHr). Bei anämischen Krebspatienten wurden zwei Arten von Eisenmangel erkannt:
- Absoluter Eisenmangel (AID), der bei chronischen Blutungen auftritt, beispielsweise aufgrund von GI oder gynäkologischen Läsionen, Blutverlust durch Operation oder Ernährung Mängel und Anämie bei chronischen Erkrankungen (ACD). Es ist definiert als ein Serumferritinspiegel von < 30 mcg / l und eine verringerte TSAT von < 15% .1
- Funktioneller Eisenmangel (FID), der nach fortgesetzter Anwendung von Erythropoetin auftritt. Es ist die häufigste Ursache für ein unzureichendes Ansprechen auf die ESA-Therapie, insbesondere bei Patienten mit Nierenversagen. Daher benötigen die meisten Patienten unter ESA-Therapie möglicherweise eine Eisenergänzung.6
Eine Eisenergänzung wurde eingeführt, als die ESA-Therapie allein bei mit Chemotherapie behandelten Patienten schlechte Ansprechraten aufwies.1 Die Wirksamkeit einer Kombination von IV Die Eisen- und ESA-Therapie wurde getestet und die Rolle von Eisen bei funktionellem Eisenmangel festgestellt.1Während aktuelle Erkenntnisse die Verwendung einer IV-Eisensupplementation zur Verbesserung der Hämoglobinreaktionen bei anämischen Krebspatienten unterstützen, sind prospektive Studien zur langfristigen Wirksamkeit und Sicherheit von IV-Eisen erforderlich Darüber hinaus müssen optimale Dosierungsschemata festgelegt werden.5 Eisen kann oral oder als parenterale Formulierungen von Eisendextran, Ferricgluconat und Eisensaccharose mit niedrigem Molekulargewicht (LMW) verabreicht werden. Parenteral verabreichtes Eisen reagiert im Vergleich zu oralem Eisen überlegen.6 Letzteres wird daher bei Krebspatienten mit Anämie nur selten angewendet und wird in diesem Artikel nicht erörtert. Testdosen werden für Eisen-Dextran empfohlen. Patienten, die zuvor empfindlich auf Eisen-Dextran oder andere IV-Eisenpräparate reagiert haben, oder Patienten mit mehreren Arzneimittelallergien sollten ebenfalls eine Testdosis erhalten. Tabelle 2 zeigt das Dosierungsschema für die intravenöse Eisenergänzung.6
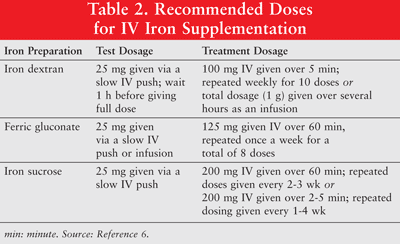
Parenterales Eisen ist mit Hypotonie, Übelkeit, Erbrechen und / oder Durchfall, Schmerzen, Bluthochdruck, Atemnot, Juckreiz, Kopfschmerzen und Schwindel verbunden. Darüber hinaus kann die Verabreichung unpraktisch und kostspielig sein.9 Da Eisen-Dextran mit hohem Molekulargewicht (HMW) mit einer höheren Häufigkeit von unerwünschten Ereignissen als LMW-Eisen-Dextran verbunden ist, wird letzteres insgesamt bevorzugt.6
Rot Blutzelltransfusion: Erythrozyten sind das bevorzugte Blutprodukt für Transfusionen zur Korrektur von Anämie bei akuter Anämie nach Blutung. Bestimmte Patienten benötigen möglicherweise eine Infusion, die Cytomegalievirus-negativ ist.Das Ziel der Verwendung einer RBC-Transfusion besteht darin, einen Mangel an Sauerstofftransportkapazität des Blutes zu behandeln oder zu verhindern, und eine Transfusion ist normalerweise nicht angezeigt, wenn der Hblevel des Patienten ≥ 10 g / dL.6
RBC-Transfusionsangebot beträgt der Vorteil eines schnellen Anstiegs der Hb- und Hämatokritwerte unmittelbar nach der Infusion. Es wird geschätzt, dass eine Transfusion von 300 ml (1 Einheit) reiner Erythrozyten zu einem durchschnittlichen Anstieg von 1 g / dl Hb oder 3% des Hämatokrits bei einem anderen erwachsenen normalen Erwachsenen führt, bei dem kein gleichzeitiger Blutverlust auftritt. Dies führt zu einer insgesamt raschen Verbesserung der Müdigkeit.6
Das Blut des Patienten muss auf ABO-Kompatibilität abgestimmt werden, bevor die Erythrozyten transfundiert werden können. Wenn der Patient wiederholte Infusionen benötigt, kann das Risiko von Nebenwirkungen durch die Verwendung von Leukozyten-reduzierendem Blut und die Prämedikation mit Anantihistamin oder Paracetamol minimiert werden.6 Die RBC-Transfusion ist nicht ohne Risiken, einschließlich des Potenzials für durch Transfusionen übertragene Infektionskrankheiten Wirkstoffe, Transfusionsreaktionen, Alloimmunisierung und Immunsuppression.9 Weitere Risiken einer Transfusion sind Herzinsuffizienz, erhöhte thrombotische Ereignisse und Eisenüberladung.6 Es ist jedoch zu beachten, dass Patienten, die während des Zeitraums, der nur einer Chemotherapie entspricht, RBC-Infusionen benötigen, dies höchstwahrscheinlich nicht tun Eisenüberladung erleben.6
Zukunftsperspektiven
Derzeit werden neuartige Strategien zur Behandlung von Anämie bei Krebspatienten verfolgt. Während es keinen Ersatz für menschliches Blut gibt, sind Forscher dabei, Produkte zu entwickeln, die die Sauerstofftransportkapazität von Erythrozyten aufweisen. In der Pipeline befinden sich Hb-basierte Sauerstoffträger und Perfluorkohlenwasserstoffe.5
Schlussfolgerung
Insgesamt muss noch der optimale Ansatz für Anämie als wichtiges Thema in der Onkologie festgelegt werden. Die mangelnde Konsistenz zwischen Gesundheitsdienstleistern, eine klare Definition der Anämie bei Krebs und diagnostische Kriterien tragen alle zu diesem Problem bei.
1. Steinmetz HT. Die Rolle von intravenösem Eisen bei der Behandlung von Anämie bei Krebspatienten. Ther Adv Hematol. 2012; 3: 177-191.
2. DeBenoist B., McLean E., Egli I. et al. Weltweite Prävalenz von Anämie 1993–2005: Globale Datenbank der WHO zu Anämie. Genf, Schweiz: Weltgesundheitsorganisation; 2008.
3. Knight K, Wade S, Balducci L. Prävalenz und Ergebnisse von Anämie bei Krebs: eine systematische Überprüfung der Literatur. Am J Med. 2004; 116 (Supplement 7A): 11S-26S.
4. Schwartz RN. Anämie bei Krebspatienten: Inzidenz, Ursachen, Auswirkungen, Management und Anwendung von Behandlungsrichtlinien und -protokollen. Am J Health Syst Pharm. 2007; 64 (3, Ergänzung 2): S5-S13; Quiz S28-S30.
5. Calabrich A, Katz A. Management von Anämie bei Krebspatienten. Future Oncol. 2011; 7: 507-517.
6. Rodgers GM, Becker P., Blinder M. et al. Krebs- und Chemotherapie-induzierte Anämie. J Natl Compr Canc Netw. 2012; 10: 628-653.
7. Groopman JE, Itri LM. Chemotherapie-induzierte Anämie bei Erwachsenen: Inzidenz und Behandlung. J Natl Cancer Inst. 1999; 91: 1616-1634.
8. Ludwig H, Strasser K. Symptomatik der Anämie. Semin Oncol. 2001; 28: 7-14.
9. Gillespie TW. Anämie bei Krebs. Krebskrankenpflege. 2003; 26: 119-128.
10. Koeller JM. Klinische Leitlinien zur Behandlung von krebsbedingter Anämie. Pharmakotherapie. 1998; 18: 156-169.
11. Cazzola M, Mercuriali F, Brugnara C. Verwendung von rekombinantem menschlichem Erythropoetin außerhalb der Urämie. Blut. 1997; 89: 424-867.
12. Nowrousian MR, Kasper C., Oberhoff C. et al. Pathophysiologie der krebsbedingten Anämie. In: Smith JF, Boogaerts MA, Ehmer B, Hrsg. Erythropoetin in der krebsunterstützenden Behandlung. New York, NY: Marcel Dekker; 1997: 13-34.
13. Vaupel P., Dunst J., Engert A. et al. Auswirkungen von rekombinantem humanem Erythropoetin (rHuEPO) auf die Tumorkontrolle bei Patienten mit krebsinduzierter Anämie. Onkologie. 2005; 28: 216-221.
14. Zhao KL, Liu G., Jiang GL, et al. Assoziation des Hämoglobinspiegels mit Morbidität und Mortalität von Patienten mit lokal fortgeschrittenem Ösophaguskarzinom, die sich einer Strahlentherapie unterziehen – eine Sekundäranalyse von drei aufeinanderfolgenden klinischen Phase-III-Studien. Clin Oncol (R Coll Radiol). 2006; 18: 621-627.
15. Glaspy JA. Die Entwicklung erythropoetischer Wirkstoffe in der Onkologie. Expertenmeinung Emerg Drugs. 2005; 10: 553-567.
16. Adamson JW, Spivak JL. Physiologische Grundlage für die pharmakologische Verwendung von rekombinantem menschlichem Erythropoetin in der Chirurgie und Krebsbehandlung. Chirurgie. 1994; 115: 7-15. 17. Ferrario E., Ferrari L., Bidoli P. et al. Behandlung von krebsbedingter Anämie mit Epoetin alfa: eine Übersicht. Cancer Treat Rev. 2004; 30: 563–575.
18. Lyman GH, Glaspy J. Gibt es klinische Vorteile bei frühzeitiger erythropoetischer Intervention bei chemotherapieinduzierter Anämie? Asystematische Überprüfung. Krebs. 2006; 106: 223 & ndash; 233.
19. Rizzo JD, Brouwers M., Hurley P. et al. AmericanSociety of Clinical Oncology / Aktualisierung der Richtlinien für klinische Praktiken der American Society of Hematology zur Anwendung von Epoetin und Darbepoetin bei erwachsenen Krebspatienten. J Clin Oncol. 2010; 28: 4996-5010.
20. Aranesp (Darbepoetin alfa) verschreibt Informationen.Thousand Oaks, CA: Amgen Inc; Mai 2012.
21. Verschreibungsinformationen für Procrit (Epoetin alfa). Horsham, PA: Janssen Products, LP; Juli 2012.
22. Beutel G, Ganser A. Risiken und Vorteile von Erythropoese-stimulierenden Mitteln bei der Krebsbehandlung. Semin Hematol. 2007; 44: 157-165.
23. Fenner MH, Ganser A. Erythropoetin bei krebsbedingter Anämie. Curr Opin Oncol. 2008; 20: 685-689.
24. Smith RE Jr., Aapro MS, Ludwig H. et al. Darbepoetinalfa zur Behandlung von Anämie bei Patienten mit aktivem Krebs, die keine Chemotherapie oder Strahlentherapie erhalten: Ergebnisse einer multizentrischen, randomisierten, doppelblinden, placebokontrollierten Phase-III-Studie. J Clin Oncol. 2008; 26: 1040–1050.
25. ESA APPRISE Onkologieprogramm. Amgen und Janssen Products, LP. www.esa-apprise.com. Zugriff am 13. Oktober 2013.