Dampfdrucksenkung
Wie im Kapitel über Flüssigkeiten und Feststoffe beschrieben, ist der Gleichgewichtsdampfdruck einer Flüssigkeit der Druck, den ihre Gase ausüben Phase, in der Verdampfung und Kondensation mit gleichen Raten auftreten:
\ text {liquid} \ rightleftharpoons \ text {gas}
Auflösen einer nichtflüchtigen Substanz in einer flüchtigen Flüssigkeit führt zu einer Absenkung des Dampfdrucks der Flüssigkeit. Dieses Phänomen kann durch Berücksichtigung der Auswirkung zugesetzter gelöster Moleküle auf die Verdampfungs- und Kondensationsprozesse der Flüssigkeit erklärt werden. Zum Verdampfen müssen Lösungsmittelmoleküle an der Oberfläche der Lösung vorhanden sein. Das Vorhandensein eines gelösten Stoffes verringert die Oberfläche, die Lösungsmittelmolekülen zur Verfügung steht, und verringert dadurch die Geschwindigkeit der Lösungsmittelverdampfung. Da die Kondensationsrate durch die Anwesenheit eines gelösten Stoffes nicht beeinflusst wird, ist das Nettoergebnis, dass das Verdampfungs-Kondensations-Gleichgewicht mit weniger Lösungsmittelmolekülen in der Dampfphase (d. H. Bei einem niedrigeren Dampfdruck) erreicht wird (1). Diese kinetische Interpretation ist zwar nützlich, berücksichtigt jedoch nicht einige wichtige Aspekte der kolligativen Natur der Dampfdrucksenkung. Eine genauere Erklärung betrifft die Eigenschaft der Entropie, die in einem späteren Textkapitel zur Thermodynamik diskutiert wird. Um die Absenkung des Dampfdrucks einer Flüssigkeit zu verstehen, ist zu beachten, dass die größere Entropie einer Lösung im Vergleich zu ihrem getrennten Lösungsmittel und gelösten Stoff dazu dient, die Lösungsmittelmoleküle wirksam zu stabilisieren und ihre Verdampfung zu behindern. Es ergibt sich ein niedrigerer Dampfdruck und ein entsprechend höherer Siedepunkt, wie im nächsten Abschnitt dieses Moduls beschrieben.
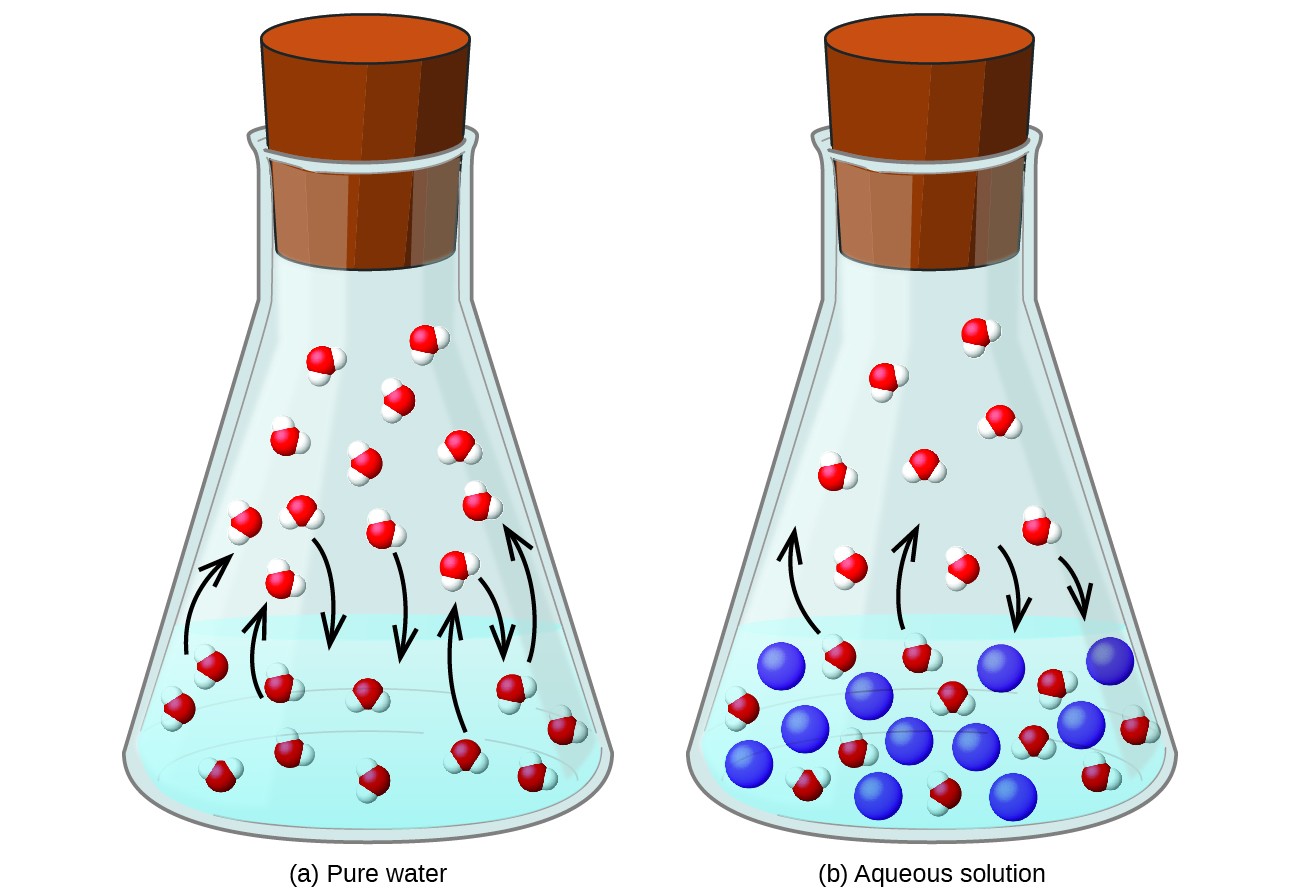
Abbildung 1. Das Vorhandensein nichtflüchtiger gelöster Stoffe senkt den Dampfdruck einer Lösung, indem es die Verdampfung von Lösungsmittelmolekülen behindert.
Die Beziehung zwischen den Dampfdrücken der Lösungskomponenten und den Konzentrationen von Diese Komponenten werden durch das Raoultsche Gesetz beschrieben: Der von einer Komponente einer idealen Lösung ausgeübte Partialdruck ist gleich dem Dampfdruck der reinen Komponente multipliziert mit ihrem Molenbruch in der Lösung.
{P} _ {\ text {A}} = {X} _ {\ text {A}} {P} _ {\ text {A}} ^ {\ star}
Unter Hinweis darauf, dass der Gesamtdruck eines Gasgemisches gleich der Summe der Partialdrücke für alle seine Komponenten ist (Daltons Partialdruckgesetz), beträgt der Gesamtdampfdruck, der von einer Lösung mit i Komponenten ausgeübt wird,
{ P} _ {\ text {solution}} = \ sum _ {i} {P} _ {i} = \ sum _ {i} {X} _ {i} {P} _ {i} ^ {\ star}
Eine nichtflüchtige Substanz ist eine Substanz, deren Dampfdruck vernachlässigbar ist (P ^ {\ star} ≈ 0), und daher ist der Dampfdruck über einer Lösung, die nur nichtflüchtige gelöste Stoffe enthält, nur auf das Lösungsmittel zurückzuführen:
{P} _ {\ text {solution}} = {X} _ {\ text {solvent}} {P} _ {\ text {solvent}} ^ {\ star}
Destillation von Lösungen
Die Destillation ist eine Technik zur Trennung der Bestandteile von Gemischen, die sowohl im Labor als auch in der Industrie weit verbreitet ist. Es wird verwendet, um Erdöl zu raffinieren, Fermentationsprodukte zu isolieren und Wasser zu reinigen. Diese Trenntechnik beinhaltet das kontrollierte Erhitzen eines Probengemisches, um eine oder mehrere interessierende Komponenten selektiv zu verdampfen, zu kondensieren und zu sammeln. Eine typische Vorrichtung für Destillationen im Labormaßstab ist in Abbildung 2 dargestellt.

Abbildung 2. Eine typische Vorrichtung Die Labordestillationseinheit ist in (a) einer Fotografie und (b) einer schematischen Darstellung der Komponenten gezeigt. (Kredit a: Änderung der Arbeit durch „Rifleman82“ / Wikimedia Commons; Kredit b: Änderung der Arbeit durch „Slashme“ / Wikipedia)
Ölraffinerien verwenden eine groß angelegte fraktionierte Destillation, um die zu trennen Bestandteile von Rohöl. Das Rohöl wird am Boden einer hohen Fraktionierkolonne auf hohe Temperaturen erhitzt, wobei viele der in der Kolonne aufsteigenden Komponenten verdampft werden. Wenn verdampfte Komponenten während ihres Aufstiegs ausreichend kühle Zonen erreichen, kondensieren sie und werden gesammelt. Die gesammelten Flüssigkeiten sind einfachere Gemische aus Kohlenwasserstoffen und anderen Erdölverbindungen, die für verschiedene Anwendungen von geeigneter Zusammensetzung sind (z. B. Dieselkraftstoff, Kerosin, Benzin), wie in 3 dargestellt.

Abbildung 3. Rohöl ist eine komplexe Mischung, die durch fraktionierte Destillation im großen Maßstab getrennt wird, um verschiedene einfachere Gemische zu isolieren.
Siedepunkterhöhung
Wie im Kapitel über Flüssigkeiten und Feststoffe beschrieben, ist der Siedepunkt einer Flüssigkeit die Temperatur, bei der ihr Dampfdruck gleich dem atmosphärischen Umgebungsdruck ist.Da der Dampfdruck einer Lösung aufgrund der Anwesenheit nichtflüchtiger gelöster Stoffe gesenkt wird, liegt es nahe, dass der Siedepunkt der Lösung anschließend erhöht wird. Im Vergleich zu reinem Lösungsmittel erfordert eine Lösung daher eine höhere Temperatur, um einen bestimmten Dampfdruck zu erreichen, einschließlich eines, der dem der umgebenden Atmosphäre entspricht. Der Anstieg des Siedepunkts, der beobachtet wird, wenn nichtflüchtiger gelöster Stoff in einem Lösungsmittel, ΔTb, gelöst wird, wird als Siedepunkterhöhung bezeichnet und ist direkt proportional zur molaren Konzentration der gelösten Spezies:
\ Delta {T} _ {\ text {b}} = {K} _ {\ text {b}} m
wobei Kb die Siedepunkt-Höhenkonstante oder die ebullioskopische Konstante ist und m die ist Molkonzentration (Molalität) aller gelösten Spezies.
Siedepunkterhöhungskonstanten sind charakteristische Eigenschaften, die von der Identität des Lösungsmittels abhängen. Die Werte von Kb für mehrere Lösungsmittel sind in Tabelle 1 aufgeführt.
Das Ausmaß, in dem der Dampfdruck eines Lösungsmittels gesenkt und der Siedepunkt erhöht wird, hängt von der Gesamtzahl der in einer bestimmten Menge vorhandenen gelösten Partikel ab des Lösungsmittels, nicht auf die Masse oder Größe oder chemische Identität der Partikel. Eine 1 m wässrige Lösung von Saccharose (342 g / mol) und eine 1 m wässrige Lösung von Ethylenglykol (62 g / mol) weisen den gleichen Siedepunkt auf, da jede Lösung ein Mol gelöste Partikel (Moleküle) pro Kilogramm Lösungsmittel enthält
Beispiel 6: Der Siedepunkt einer Jodlösung
Ermitteln Sie den Siedepunkt einer Lösung von 92,1 g Jod I2 in 800,0 g Chloroform CHCl3 unter der Annahme, dass das Jod nichtflüchtig ist und die Lösung ideal ist.
Überprüfen Sie Ihr Lernen
Was ist der Siedepunkt einer Lösung von 1,0 g Glycerin, C 3 H 5 (OH) 3, in 47,8 g Wasser? Nehmen Sie eine ideale Lösung an.
Gefrierpunkterniedrigung

Abbildung 4. Steinsalz ( NaCl), Calciumchlorid (CaCl 2) oder eine Mischung aus beiden werden zum Schmelzen von Eis verwendet. (Kredit: Modifikation der Arbeit von Eddie Welker)
Lösungen gefrieren bei niedrigeren Temperaturen als reine Flüssigkeiten. Dieses Phänomen wird bei „Enteisungsschemata“ ausgenutzt, bei denen Salz (Abbildung 4), Calciumchlorid oder Harnstoff zum Schmelzen von Eis auf Straßen und Gehwegen verwendet werden, und bei der Verwendung von Ethylenglykol als „Frostschutzmittel“ in Autokühlern. Meerwasser gefriert bei einer niedrigeren Temperatur als Süßwasser, so dass die arktischen und antarktischen Ozeane auch bei Temperaturen unter 0 ° C nicht gefroren bleiben (ebenso wie die Körperflüssigkeiten von Fischen und anderen kaltblütigen Meerestieren, die in diesen Ozeanen leben).
Die Abnahme des Gefrierpunkts einer verdünnten Lösung im Vergleich zu der des reinen Lösungsmittels ΔTf wird als Gefrierpunkterniedrigung bezeichnet und ist direkt proportional zur molaren Konzentration des gelösten Stoffes
\ Delta {T} _ {\ text {f}} = {K} _ {\ text {f}} m
wobei m die molare Konzentration des gelösten Stoffes in ist Das Lösungsmittel und Kf werden als Gefrierpunkterniedrigungskonstante (oder Kryokonstante) bezeichnet. Genau wie bei Siedepunkterhöhungskonstanten sind dies charakteristische Eigenschaften, deren Werte von der chemischen Identität des Lösungsmittels abhängen. Die Kf-Werte für mehrere Lösungsmittel sind in Tabelle 1 aufgeführt.
Kolligative Eigenschaften und Enteisung
Natriumchlorid und seine Gruppe-2-Analoga Calcium und Magnesiumchlorid werden häufig verwendet Enteisen Sie Straßen und Bürgersteige, da eine Lösung eines dieser Salze einen Gefrierpunkt unter 0 ° C hat, dem Gefrierpunkt von reinem Wasser. Die Metallsalze der Gruppe 2 werden häufig mit dem billigeren und leichter verfügbaren Natriumchlorid („Steinsalz“) zur Verwendung auf Straßen gemischt, da sie dazu neigen, etwas weniger ätzend als das NaCl zu sein, und eine größere Senkung des Gefrierpunkts bewirken Da sie dissoziieren und drei Partikel pro Formeleinheit ergeben, anstatt zwei Partikel wie Natriumchlorid.
Da diese ionischen Verbindungen dazu neigen, die Korrosion von Metall zu beschleunigen, wären sie keine gute Wahl Frostschutzmittel für den Kühler in Ihrem Auto oder zum Enteisen eines Flugzeugs vor dem Start.Für diese Anwendungen werden häufig kovalente Verbindungen wie Ethylen- oder Propylenglykol verwendet. Die in Kühlerflüssigkeit verwendeten Glykole senken nicht nur den Gefrierpunkt der Flüssigkeit, sondern erhöhen auch den Siedepunkt, wodurch die Flüssigkeit sowohl im Winter als auch im Sommer nützlich ist. Erhitzte Glykole werden häufig vor dem Start bei schlechtem Wetter im Winter auf die Oberfläche von Flugzeugen gesprüht, um bereits gebildetes Eis zu entfernen und die Bildung von mehr Eis zu verhindern, was besonders gefährlich wäre, wenn es sich auf den Steuerflächen des Flugzeugs bilden würde (Abbildung) 5).

Abbildung 5. Die Gefrierpunkterniedrigung wird ausgenutzt, um Eis von (a) Straßen zu entfernen und (b) die Steuerflächen von Flugzeugen.
Phasendiagramm für eine Lösung
Die kolligativen Effekte auf Dampfdruck, Siedepunkt und Gefrierpunkt Die im vorherigen Abschnitt beschriebenen werden bequem zusammengefasst, indem die Phasendiagramme für eine reine Flüssigkeit und eine von dieser Flüssigkeit abgeleitete Lösung verglichen werden. Phasendiagramme für Wasser und eine wässrige Lösung sind in Abbildung 6 dargestellt.
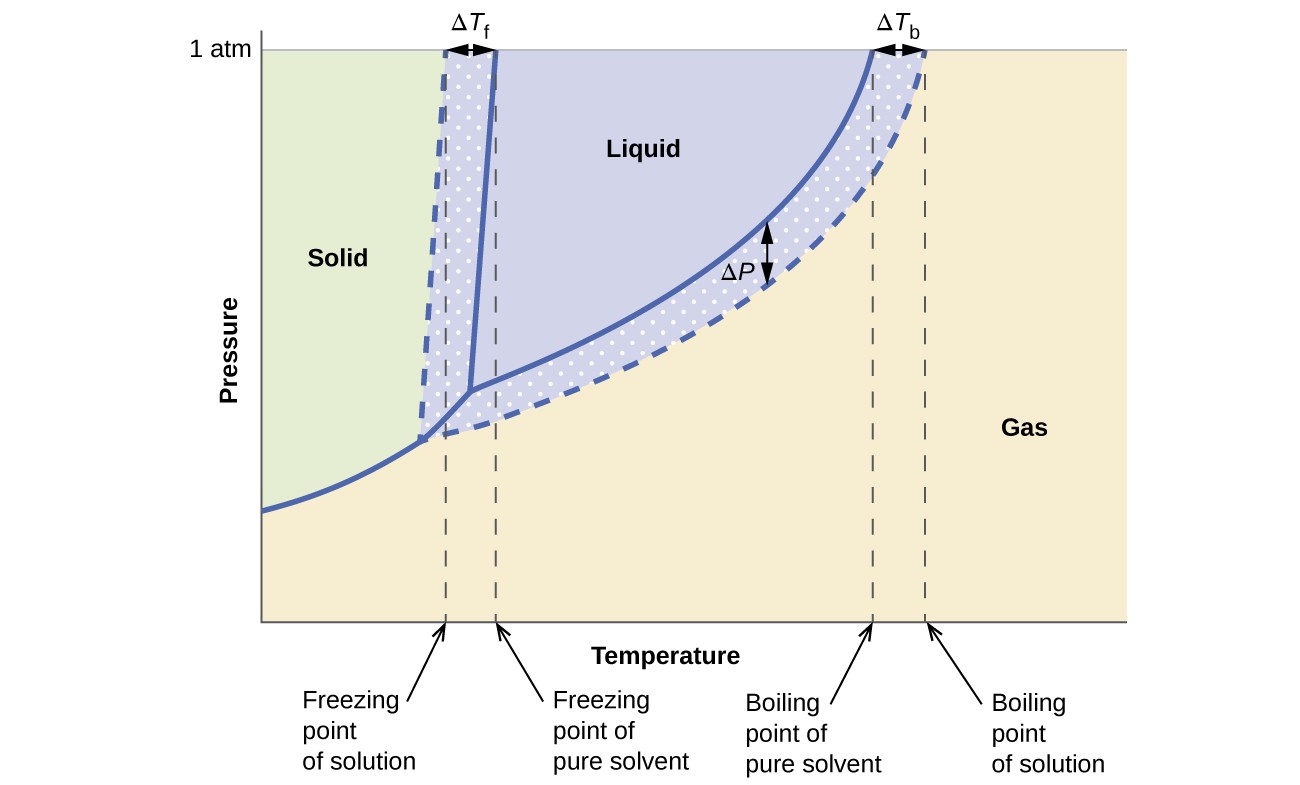
Abbildung 6. Diese Phase Diagramme zeigen Wasser (durchgezogene Kurven) und eine wässrige Lösung von Nichtelektrolyt (gestrichelte Kurven).
Die Flüssigkeits-Dampf-Kurve für die Lösung befindet sich unter der entsprechenden Kurve für das Lösungsmittel und zeigt den Dampf Drucksenkung ΔP, die sich aus der Auflösung des nichtflüchtigen gelösten Stoffes ergibt. Folglich wird bei jedem gegebenen Druck der Siedepunkt der Lösung bei einer höheren Temperatur als der für das reine Lösungsmittel beobachtet, was die Siedepunkterhöhung ΔTb widerspiegelt, die mit der Anwesenheit eines nichtflüchtigen gelösten Stoffes verbunden ist. Die Fest-Flüssig-Kurve für die Lösung ist links von der für das reine Lösungsmittel verschoben, was die Gefrierpunkterniedrigung ΔTb darstellt, die mit der Lösungsbildung einhergeht. Beachten Sie schließlich, dass die Festgaskurven für das Lösungsmittel und seine Lösung identisch sind. Dies ist bei vielen Lösungen der Fall, die flüssige Lösungsmittel und nichtflüchtige gelöste Stoffe umfassen. Genau wie bei der Verdampfung sind es beim Einfrieren einer Lösung dieser Art tatsächlich nur die Lösungsmittelmoleküle, die den Übergang von Flüssigkeit zu Feststoff durchlaufen und ein reines festes Lösungsmittel bilden, das gelöste Spezies ausschließt. Die festen und gasförmigen Phasen bestehen daher nur aus Lösungsmittel, so dass Übergänge zwischen diesen Phasen keinen kolligativen Effekten unterliegen.
Osmose und osmotischer Druck von Lösungen
Eine Reihe von natürlichen und synthetische Materialien zeigen eine selektive Permeation, was bedeutet, dass nur Moleküle oder Ionen einer bestimmten Größe, Form, Polarität, Ladung usw. in der Lage sind, das Material zu durchdringen (zu durchdringen). Biologische Zellmembranen bieten elegante Beispiele für selektive Permeation in der Natur, während Dialyseschläuche zur Entfernung von Stoffwechselabfällen aus dem Blut ein einfacheres technologisches Beispiel sind. Unabhängig davon, wie sie hergestellt werden können, werden diese Materialien im Allgemeinen als semipermeable Membranen bezeichnet. Betrachten Sie die in 7 dargestellte Vorrichtung, bei der Proben von reinem Lösungsmittel und einer Lösung durch eine Membran getrennt sind, die nur Lösungsmittel enthält Moleküle können durchdringen. Lösungsmittelmoleküle diffundieren in beide Richtungen über die Membran. Da die Lösungsmittelkonzentration im reinen Lösungsmittel höher ist als in der Lösung, diffundieren diese Moleküle schneller von der Lösungsmittelseite der Membran zur Lösungsseite als in umgekehrter Richtung. Das Ergebnis ist ein Nettotransfer von Lösungsmittelmolekülen vom reinen Lösungsmittel zur Lösung. Der diffusionsgetriebene Transfer von Lösungsmittelmolekülen durch eine semipermeable Membran ist ein als Osmose bekannter Prozess.
Abbildung 7. (a) Eine Lösung und ein reines Lösungsmittel werden anfänglich durch eine osmotische Membran getrennt. (b) Die Nettoübertragung von Lösungsmittelmolekülen auf die Lösung erfolgt so lange, bis ihr osmotischer Druck gleiche Übertragungsraten in beide Richtungen ergibt.
Wenn die Osmose in einer Vorrichtung wie der in 7 gezeigten durchgeführt wird nimmt das Volumen der Lösung zu, wenn sie durch Ansammlung von Lösungsmittel verdünnt wird. Dies führt zu einem Anstieg des Lösungsniveaus, wodurch der hydrostatische Druck (aufgrund des Gewichts der Lösungssäule im Rohr) erhöht wird und die Lösungsmittelmoleküle schneller auf die reine Lösungsmittelseite zurückgeführt werden. Wenn der Druck einen Wert erreicht, der eine umgekehrte Lösungsmittelübertragungsrate ergibt, die der Osmoserate entspricht, hört die Massenübertragung des Lösungsmittels auf. Dieser Druck wird als osmotischer Druck (Π) der Lösung bezeichnet. Der osmotische Druck einer verdünnten Lösung hängt mit ihrer Molarität M und der absoluten Temperatur T gemäß der Gleichung
\ Pi = MRT
zusammen
wobei R die universelle Gaskonstante ist.
Wenn eine Lösung in eine Vorrichtung wie die in 8 gezeigte gegeben wird, kehrt das Anlegen eines Drucks, der größer als der osmotische Druck der Lösung ist, die Osmose um und drückt Lösungsmittelmoleküle aus der Lösung in das reine Lösungsmittel. Diese Technik der Umkehrosmose wird zur Entsalzung von Meerwasser in großem Maßstab und in kleineren Maßstäben zur Herstellung von hochreinem Leitungswasser zum Trinken verwendet.
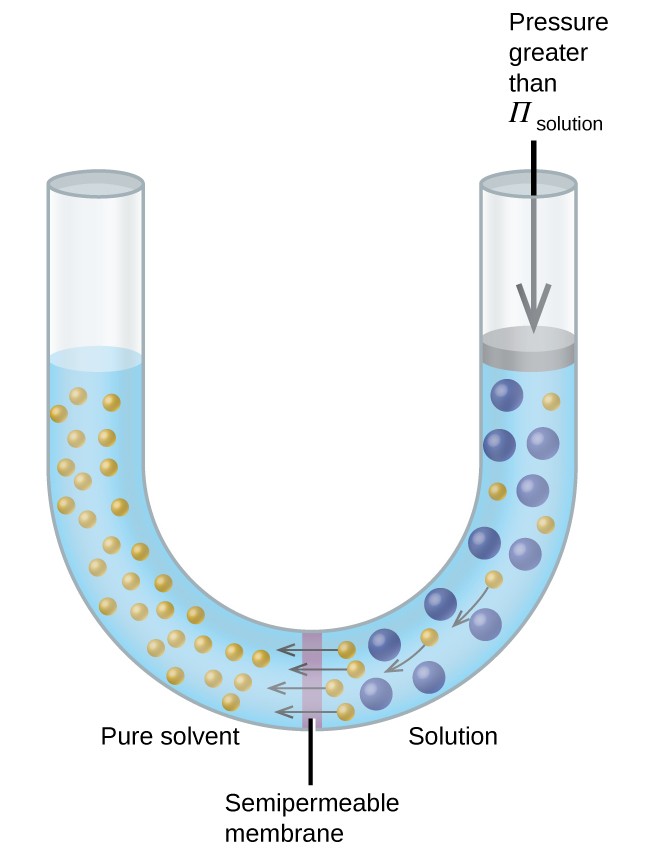
Abbildung 8. Durch Anwenden eines Drucks, der größer als der osmotische Druck einer Lösung ist, wird die Osmose umgekehrt. Lösungsmittelmoleküle aus der Lösung werden in das reine Lösungsmittel gedrückt.
Umkehrosmosewasserreinigung
Bei der Osmose dient die Diffusion dazu, Wasser durch a zu bewegen semipermeable Membran von einer weniger konzentrierten Lösung zu einer konzentrierteren Lösung. Osmotischer Druck ist die Menge an Druck, die auf die konzentrierte Lösung ausgeübt werden muss, damit die Osmose stoppt. Wenn ein höherer Druck ausgeübt wird, geht das Wasser von der konzentrierten Lösung zu einer weniger konzentrierten (reineren) Lösung über. Dies nennt man Umkehrosmose. Umkehrosmose (RO) wird zur Reinigung von Wasser in vielen Anwendungen eingesetzt, von Entsalzungsanlagen in Küstenstädten über Wasseraufbereitungsmaschinen in Lebensmittelgeschäften (Abbildung 9) bis hin zu kleineren Umkehrosmose-Haushaltsgeräten. Mit einer handbetriebenen Pumpe können kleine RO-Einheiten in Ländern der Dritten Welt, in Katastrophengebieten und in Rettungsbooten eingesetzt werden. Unsere Streitkräfte verfügen über eine Vielzahl von generatorbetriebenen RO-Einheiten, die in Fahrzeugen zu entfernten Orten transportiert werden können.

Abbildung 9. Umkehrosmoseanlagen zur Reinigung von Trinkwasser sind hier in (a) kleinen und (b) großen Maßstäben dargestellt. (Kredit a: Modifikation der Arbeit von Jerry Kirkhart; Kredit b: Modifikation der Arbeit von Willard J. Lathrop)
Beispiele für Osmose sind in vielen biologischen Systemen offensichtlich, weil Zellen vorhanden sind umgeben von semipermeablen Membranen. Karotten und Sellerie, die schlaff geworden sind, weil sie Wasser verloren haben, können durch Einlegen in Wasser wieder knusprig gemacht werden. Wasser gelangt durch Osmose in die Karotten- oder Selleriezellen. Eine Gurke in einer konzentrierten Salzlösung verliert durch Osmose Wasser und nimmt etwas Salz auf, um eine Gurke zu werden. Osmose kann auch tierische Zellen betreffen. Konzentrationen gelöster Stoffe sind besonders wichtig, wenn Lösungen in den Körper injiziert werden. Gelöste Stoffe in Körperzellflüssigkeiten und Blutserum verleihen diesen Lösungen einen osmotischen Druck von ungefähr 7,7 atm. In den Körper injizierte Lösungen müssen den gleichen osmotischen Druck wie Blutserum haben. Das heißt, sie sollten mit Blutserum isotonisch sein. Wenn eine weniger konzentrierte Lösung, eine hypotonische Lösung, in ausreichender Menge injiziert wird, um das Blutserum zu verdünnen, gelangt Wasser aus dem verdünnten Serum durch Osmose in die Blutzellen, wodurch sich die Zellen ausdehnen und aufbrechen. Dieser Vorgang wird als Hämolyse bezeichnet. Wenn eine konzentriertere Lösung, eine hypertonische Lösung, injiziert wird, verlieren die Zellen Wasser an die konzentriertere Lösung, schrumpfen und sterben möglicherweise in einem Prozess, der als Krenation bezeichnet wird. Diese Effekte sind in Abbildung 10 dargestellt.
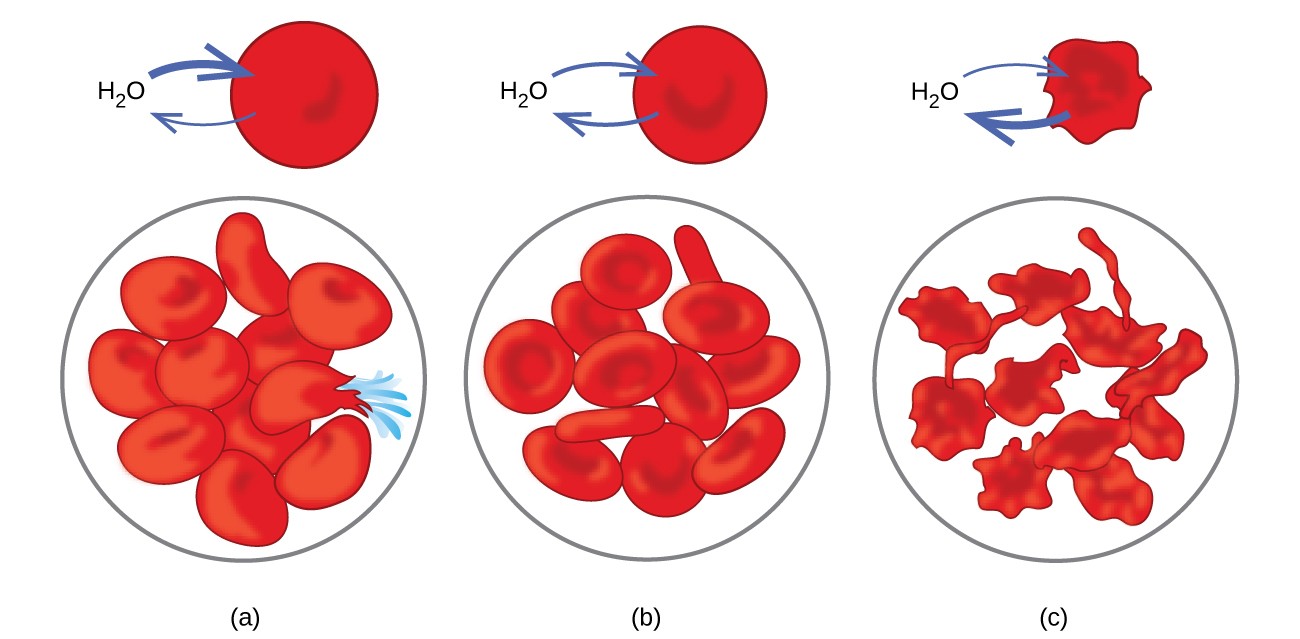
Abbildung 10. Membranen roter Blutkörperchen sind wasserdurchlässig und wird (a) in einer hypotonischen Lösung anschwellen und möglicherweise reißen; (b) Beibehaltung des normalen Volumens und der normalen Form in einer isotonischen Lösung; und (c) schrumpfen und möglicherweise in einer hypertonischen Lösung sterben. (Kredit a / b / c: Modifikationen der Arbeit von „LadyofHats“ / Wikimedia Commons)
Bestimmung der Molmassen
Osmotischer Druck und Änderungen des Gefrierpunkts, Kochen Punkt und Dampfdruck sind direkt proportional zur Konzentration des vorhandenen gelösten Stoffes. Folglich können wir eine Messung einer dieser Eigenschaften verwenden, um die Molmasse des gelösten Stoffs aus den Messungen zu bestimmen.
Kolligative Eigenschaften von Elektrolyten
Wie bereits in diesem Modul erwähnt, hängen die kolligativen Eigenschaften einer Lösung nur von der Anzahl und nicht von der Identität der gelösten gelösten Spezies ab. Die Konzentrationsterme in den Gleichungen für verschiedene kolligative Eigenschaften (Gefrierpunkterniedrigung) , Siedepunkterhöhung, osmotischer Druck) beziehen sich auf alle in der Lösung vorhandenen gelösten Spezies. Bei den bisher in diesem Kapitel betrachteten Lösungen handelt es sich bei den gelösten Stoffen um Nichtelektrolyte, die sich physikalisch ohne Dissoziation oder einen anderen begleitenden Prozess auflösen. Jedes Molekül Die sich auflösende Datei ergibt ein gelöstes gelöstes Molekül. Die Auflösung eines Elektroten ist jedoch nicht so einfach, wie die beiden folgenden allgemeinen Beispiele zeigen:
Unter Berücksichtigung des ersten dieser Beispiele und unter der Annahme einer vollständigen Dissoziation enthält eine 1,0 m wässrige Lösung von NaCl 2,0 Mol Ionen (1,0 Mol Na + und 1).0 mol Cl -) pro Kilogramm Wasser, und es wird erwartet, dass seine Gefrierpunkterniedrigung
Wenn diese Lösung tatsächlich hergestellt und ihre Gefrierpunkterniedrigung gemessen wird, wird jedoch ein Wert von 3,4 ° C erhalten. Ähnliche Abweichungen werden für andere ionische Verbindungen beobachtet, und die Unterschiede zwischen den gemessenen und erwarteten Werten der kolligativen Eigenschaften werden typischerweise mit zunehmenden Konzentrationen gelöster Stoffe signifikanter. Diese Beobachtungen legen nahe, dass die Ionen von Natriumchlorid (und anderen starken Elektrolyten) in Lösung nicht vollständig dissoziiert sind.
Um dies zu berücksichtigen und die Fehler zu vermeiden, die mit der Annahme einer vollständigen Dissoziation einhergehen, wird ein experimentell gemessener Parameter mit dem Namen in Die Ehre des mit dem Nobelpreis ausgezeichneten deutschen Chemikers Jacobus Henricus van’t Hoff wird verwendet. Der Van’t-Hoff-Faktor (i) ist definiert als das Verhältnis der gelösten Partikel in Lösung zur Anzahl der gelösten Formeleinheiten:
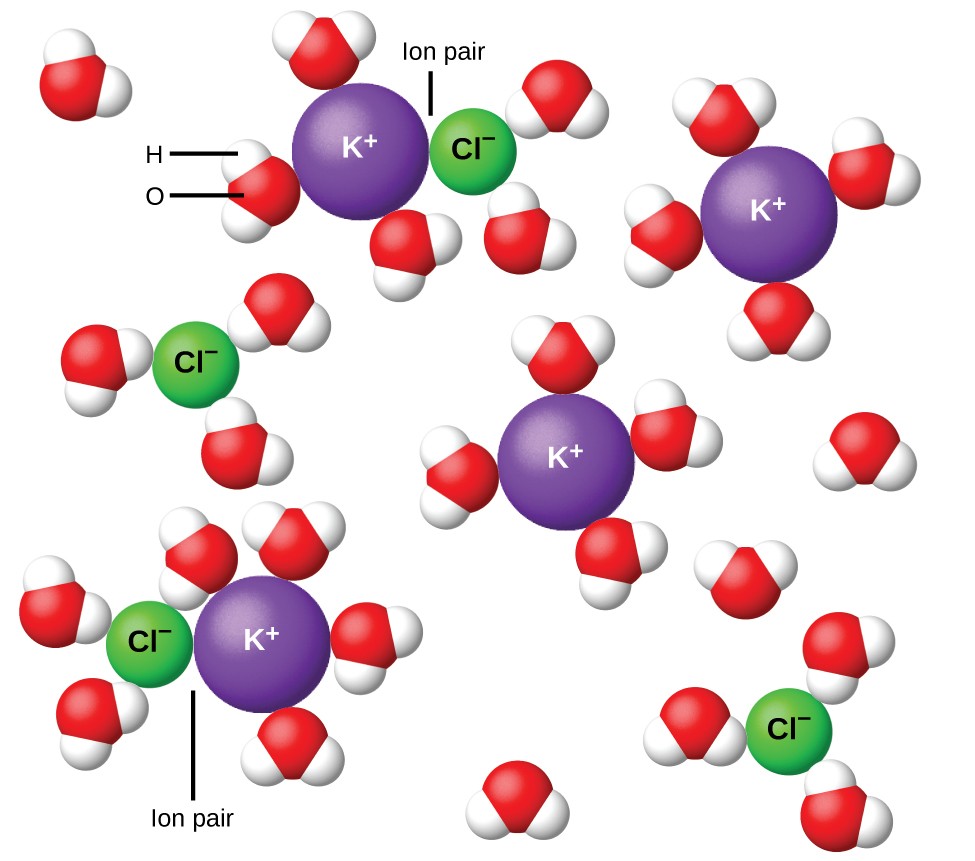
Abbildung 11. Ionen werden immer weiter getrennt, je verdünnter die Lösung ist. und die verbleibenden interionischen Anziehungskräfte werden geringer.
1923 schlugen die Chemiker Peter Debye und Erich Hückel eine Theorie vor, um die scheinbar unvollständige Ionisierung starker Elektrolyte zu erklären. Sie schlugen vor, dass die interionische Anziehung in einer wässrigen Lösung zwar durch Solvatisierung der Ionen und die isolierende Wirkung des polaren Lösungsmittels sehr stark verringert wird, jedoch nicht vollständig aufgehoben wird. Die Restattraktionen verhindern, dass sich die Ionen als völlig unabhängige Partikel verhalten (Abbildung 11). In einigen Fällen können sich ein positives und ein negatives Ion tatsächlich berühren, was eine solvatisierte Einheit ergibt, die als Ionenpaar bezeichnet wird. Somit ist die Aktivität oder die effektive Konzentration einer bestimmten Art von Ion geringer als die durch die tatsächliche Konzentration angegebene. Ionen werden immer weiter getrennt, je verdünnter die Lösung ist, und die verbleibenden interionischen Anziehungskräfte werden immer geringer. Somit sind in extrem verdünnten Lösungen die effektiven Konzentrationen der Ionen (ihre Aktivitäten) im wesentlichen gleich den tatsächlichen Konzentrationen. Es ist zu beachten, dass die Van’t-Hoff-Faktoren für die Elektrolyte in Tabelle 2 für 0,05 m-Lösungen gelten, bei denen der Wert von i für NaCl 1,9 beträgt, im Gegensatz zu einem idealen Wert von 2.
Beispiel 11: Der Gefrierpunkt einer Elektrolytlösung
Die Ionenkonzentration im Meerwasser entspricht in etwa der in einer Lösung mit 4,2 g NaCl, gelöst in 125 g Wasser. Nehmen Sie an, dass jedes der Ionen in der NaCl-Lösung den gleichen Einfluss auf den Gefrierpunkt von Wasser hat wie ein Nichtelektrolytmolekül, und bestimmen Sie die Gefriertemperatur der Lösung (die ungefähr der Gefriertemperatur von Meerwasser entspricht).
Überprüfen Sie Ihr Lernen
Nehmen Sie an, dass jedes der Ionen in Calciumchlorid, CaCl2, hat den gleichen Effekt auf den Gefrierpunkt von Wasser wie ein Nichtelektrolytmolekül. Berechnen Sie den Gefrierpunkt einer Lösung von 0,724 g CaCl2 in 175 g Wasser.
Probieren Sie es aus
- Fleisch kann als frisch (nicht gefroren) eingestuft werden, obwohl es bei -1 gelagert wird ° C. Warum sollte Fleisch bei dieser Temperatur nicht gefrieren?
- Eine organische Verbindung hat eine Zusammensetzung von 93,46 Gew .-% und 6,54 Massen-% H. Eine Lösung von 0,090 g dieser Verbindung in 1,10 g Kampfer schmilzt bei 158,4ºC. Der Schmelzpunkt von reinem Kampfer beträgt 178,4 ° C. Kf für Kampfer beträgt 37,7 ° C / m. Wie lautet die Summenformel des gelösten Stoffes? Zeigen Sie Ihre Berechnungen.
- Ein Salz ist als Alkalimetallfluorid bekannt. Eine schnelle ungefähre Bestimmung des Gefrierpunkts zeigt, dass 4 g des in 100 g Wasser gelösten Salzes eine Lösung ergeben, die bei etwa –1,4 ° C gefriert. Wie lautet die Formel des Salzes? Zeigen Sie Ihre Berechnungen.
Glossar
Aktivität: effektive Konzentration von Ionen in Lösung; es ist aufgrund ionischer Wechselwirkungen niedriger als die tatsächliche Konzentration.
Siedepunkterhöhung: Erhöhung des Siedepunkts einer Flüssigkeit durch Zugabe einer gelösten
Siedepunkterhöhungskonstante: die Proportionalitätskonstante in der Gleichung, die die Siedepunkterhöhung mit der Molalität des gelösten Stoffes in Beziehung setzt; auch bekannt als ebullioskopische Konstante
kolligative Eigenschaft: Eigenschaft einer Lösung, die nur von der Konzentration einer gelösten Spezies abhängt
Krenation: Prozess, bei dem biologische Zellen aufgrund von Wasserverlust schrumpfen durch Osmose
Gefrierpunkterniedrigung: Absenkung des Gefrierpunkts einer Flüssigkeit durch Zugabe einer gelösten
Gefrierpunkterniedrigungskonstante: (auch kryoskopische Konstante) Proportionalitätskonstante in der entsprechenden Gleichung Gefrierpunkterniedrigung bei gelöster Molalität
Hämolyse: Bruch roter Blutkörperchen aufgrund der Ansammlung von überschüssigem Wasser durch Osmose
hypertonisch: bei höherem osmotischen Druck
hypoton : von weniger osmotischem Druck
Ionenpaar: Solvatisiertes Anion / Kation-Paar, das durch mäßige elektrostatische Anziehung zusammengehalten wird
isotonisch: von gleicher osmotischer Druck
Molalität (m) : eine Konzentrationseinheit, definiert als das Verhältnis der Molzahl des gelösten Stoffes zur Masse des Lösungsmittels in Kilogramm Molenbruch (X): das Verhältnis der Molmenge einer Lösungskomponente zur Gesamtzahl der Mol aller Lösungskomponenten – Osmose: Diffusion von Lösungsmittelmolekülen durch eine semipermeable Membran – osmotischer Druck (Π) ): Gegendruck, der erforderlich ist, um die Massenübertragung von Lösungsmittelmolekülen durch eine semipermeable Membran zu verhindern. Raoultsches Gesetz: Der von einer Lösungskomponente ausgeübte Partialdruck ist gleich dem Produkt des Molenbruchs der Komponente in der Lösung und ihrem Gleichgewicht Dampfdruck in der semipermeablen Membran im reinen Zustand: Eine Membran, die selektiv den Durchgang bestimmter Ionen oder Moleküle ermöglicht. Van’t Hoff-Faktor (i): das Verhältnis der Molzahl von Partikeln in einer Lösung auf die Anzahl der Mol der in der Lösung gelösten Formeleinheiten
- Ein zum Vergleich gezeigter Nichtelektrolyt. ↵

