US Pharm. 2013; 38 (11) (Oncology suppl): 3-6.
ABSTRAKT: Anémie je častou komplikací u pacientů s rakovinou. Může to být způsobeno buď samotným nádorem, nebo použitým chemoterapeutickým režimem. Závažnost a prevalence stavu se liší v závislosti na řadě faktorů. Léčba je zaměřena na zvýšení kapacity krve přenášející kyslík, snížení únavy a zlepšení celkové kvality života pacienta. Činidla stimulující erytropoézu, suplementace železa a transfuze červených krvinek byly doporučeny v různých podmínkách. I když se u některých pacientů ukázalo, že jsou prospěšné, optimální terapeutická modalita ještě musí být stanovena.
Anémie je hlavní příčinou morbidity u pacientů s rakovinou, spojená se špatnou fyzickou výkonností, prognózou a terapeutickým výsledkem.1 Podle Světové zdravotní organizace ( WHO), anémie je definována jako hladina hemoglobinu (Hb) < 12 g / dL u netěhotných žen a < 13 g / dL u mužů ≥ 15 let.2
Epidemiologie
Anémie je jedním z nejčastějších projevů u pacientů s rakovinou. Ve skutečnosti se ukázalo, že 30% až 90% pacientů s rakovinou je anemických, což je údaj, který závisí na typu rakoviny a použité anémii.3 Výskyt a závažnost anémie závisí na řadě faktorů, které jsou uvedeny v TABULCE 1.4,5

Etiologie
Hlavní příčina anémie u pacientů s rakovinou je dvojí: rakovina samotná a léčba použitá k léčbě rakoviny. Rakovinné buňky, které infiltrují kostní dřeň, mohou přímo potlačit hematoopoézu a způsobit anémii. Kromě toho rakovinné buňky uvolňujícytokiny, které mohou vést k sekvestraci železa, což snižuje produkci červených krvinek (RBC). Nádory mohou mít za následek chronickou ztrátu krve z místa nádoru, což vede k progresivní anémii způsobené rakovinou a poškozením těla.6
Tento problém je spojen se ztrátami krve, nedostatkem výživy, hemolýzou, endokrinními poruchami, dědičnými chorobami, nedostatečností ledvin nebo přítomnost zánětlivých cytokinů spojených s rakovinou a chronickým onemocněním.4,6 Pacienti s rakovinou mají tendenci ztrácet chuť k jídlu, což vede k nutričním nedostatkům. U pacientů s gastrointestinálními (GI) nádory vede k poruchám malabsorpce živin. Hemolýza je výsledkem imunitně zprostředkovaných protilátek v koagulační schopnosti. Výsledkem je, že anémie je běžnou komorbiditou u pacientů s nedávno diagnostikovanou rakovinou. Téměř polovina pacientů s diagnostikovanou gynekologickou rakovinou a třetina pacientů s diagnostikovaným non-Hodgkinovým lymfomem má při diagnóze anémii.
Navíc je myelosuprese jedním z vedlejších účinků chemoterapie a významným faktorem přispívajícím k anémii. . Radiační léčba skeletu také způsobuje hematologickou toxicitu, a tudíž anémii.6
Příznaky
Nejběžnějšími příznaky anémie jsou únava, dušnost, palpitace, deprese, srdeční selhání, porucha kognitivních funkcí funkce, závratě a srdeční selhání.7,8
Diagnóza
Velikost problému anémie u pacientů s rakovinou je umocněna neoptimálními diagnostickými opatřeními, nedostatkem standardní definice a skutečnost, že příčina je často multifaktoriální.6,9 Měla by být provedena podrobná anamnéza zaznamenávající dobu trvání a dobu do nástupu příznaků, přítomnost komorbidních stavů, rodinnou anamnézu a historii expozice antineoplastickým lékům a záření. Mělo by být provedeno fyzikální vyšetření na kontrolu synkopy, zácpy dušnosti, bolesti hlavy, závratí, bolesti na hrudi, únavy, abnormální menstruace u žen a bledosti.6
Národní síť pro komplexní prevenci rakoviny doporučuje provádět aCBC u pacientů s Hb < 11 g / dL nebo snížení počtu Hb o 2 g / dL. To je užitečné při určování, zda jsou přítomny cytopenie. Doporučuje se také vizuální kontrola nátěru periferní krve k potvrzení velikosti, tvaru a barvy červených krvinek.6
Patofyziologie
Anémie je výsledkem kombinace sníženého množství cirkulujících erytrocytů , snížený objem nabitých buněk a snížené hladiny Hb.6 K tomu může dojít prostřednictvím různých patofyziologických mechanismů, včetně nadměrné ztráty krve, zvýšené destrukce červených krvinek a snížené erytropoézy.
Erytropoetin (EPO), vitamin B12, kyselina listová a železo je nezbytné pro erytropoézu. Erytropoetin reguluje během tohoto procesu tematuraci, diferenciaci a přežití erytroidních buněk.10 EPO je primárně produkováno ledvinami a transportováno do kostní dřeně.11
Abnormální metabolismus železa nebo retence železa v makrofágech snižuje množství železo, které je k dispozici forerythropoiesis.Změněný metabolismus železa je primárně způsoben hepcidinem, proteinem, který snižuje absorpci železa v střevech a také uvolňování železa makrofágy. Produkce hepcidinu je zvyšována cytokiny uvolněnými z nádorů, čímž se snižuje množství cirkulujícího železa. Ukázalo se také, že produkce cytokinů, jako je interleukin (IL) -6, je zvýšena určitými chemoterapeutickými režimy.5 Opakované cykly chemoterapie mohou kumulativně zhoršit snížení erytropoézy.7
Snižováním dodávky kyslíku buňky tkáně těla se stávají hypoxickými, což má za následek řadu fyziologických reakcí, když se tělo pokouší získat nebo udržovat okysličování tkání. a vlastní imunitní systém hostitele. Tato interakce vede k regulaci specifických zánětlivých cytokinů, jako je IL-1, gammainterferon a tumor nekrotizující faktor alfa (TNF-α), což snižuje diferenciaci erytroidních prekurzorů v kostní dřeni, narušuje normální využití železa a inhibuje normální hypoxii – produkce řízeného thropoetinu. Nefrotoxická chemoterapeutická činidla mohou zhoršit problém tím, že způsobí poškození ledvin.
U chronické anémie bylo prokázáno, že nádory uvolňují faktor vyvolávající ananémii, molekulu, která snižuje životnost erytrocytů. To zhoršuje anémii do bodu, kdy erytropoéza nemůže kompenzovat horší přežití červených krvinek.12
Rizikové faktory pro anémii u rakoviny
Byly identifikovány následující rizikové faktory pro anémii u rakoviny9:
- Myelosupresivní chemoterapie nebo radiační terapie
- Nízké hladiny Hb (10–12 g / dL) na počátku cytotoxické chemoterapie
- Podávání platiny obsahující režimy, což také zvyšuje potřebu transfuzní podpory.
Léčba
Kromě celkového zlepšení kvality života pacienta je léčba anémie nezbytná pro řadu z důvodů. Anemie narušuje dodávku dostatečného množství kyslíku do všech buněk, včetně nádorových buněk.7 Jelikož je nízké okysličení tkání spojené se sníženou citlivostí nádorů na záření a dalšími formami chemoterapie, je účinnost těchto léčení snížena u anémie.13,14
Cílem terapie by mělo být zvýšení obsahu kyslíku G kapacita krve a léčba základní příčiny. Podkladové podmínky, jako jsou výživové nedostatky, jsou snáze léčitelné než jiné, například okultní ztráta krve. K dispozici jsou různé možnosti léčby pacientů s rakovinou s anémií. Patří mezi ně 15:
- Vhodná doplňková léčba kyselinou listovou a / nebo vitaminem B12 ke korekci nutričních nedostatků
- Erytropoézu stimulující látky (ESA)
- suplementace železem
- Krevní transfuze, které jsou indikovány u pacientů s akutní těžkou ztrátou krve. U pacientů, jejichž anémie je chronická, se dává přednost erytropoetickým látkám.
Látky stimulující erytropoézu: ESA, včetně rekombinantního lidského erytropoetinu alfa (rHuEPO; Procrit, Epogen) a darbepoetinu alfa (Aranesp), byly tradičně vyvinut k léčbě anémie u pacientů s chronickým selháním ledvin. Ukázali podobnou účinnost a omezení při použití nesrovnatelných dávek u pacientů s rakovinou s anémií.5 ESA jsou indikovány pro léčbu pacientů, jejichž hladiny endogenního EPO jsou normálně nízké, protože způsob působení ESA a imunologické a matematické účinky jsou podobné jako u endogenního EPO. provedené na rHuEPO ukázaly, že zlepšuje Hblevels pacientů a kvalitu života a snižuje požadavky na transfuzi.15,16 Bylo navrženo, že ESA také zlepšují kognitivní funkce pacientů léčených chemoterapií.17
Systémový přehled provedené společností American Cancer Societys ukázaly, že optimálního klinického přínosu z erytropoetické léčby anémie vyvolané chemoterapií lze dosáhnout včasným zásahem.18 Existuje jednoznačně výhoda použití ESA; všechny ostatní příčiny anémie by však měly být před použitím ESAterapie vyšetřeny a napraveny.
Darbepoetin i rHuEPO jsou oba indikovány k léčbě anémie u pacientů s nemyeloidními malignitami ve whomanemii souvisí s chemoterapií.5 Americká společnost pro hematologii (ASH) a Americká společnost pro klinickou onkologii (ASCO) doporučují zahájit léčbu, když hladiny Hb klesnou pod 10 g / dL a dávka se sníží, pokud dojde k minimálnímu zvýšení o 1 g / dL v Hblevels o 2 Cílem léčby by mělo být upravit Hb na nejnižší koncentraci, aby nedocházelo k transfuzi. Pokud po 6 až 8 týdnech léčby není dosaženo minimálního zvýšení Hb o 1 až 2 g / dl Hb, měla by být léčba ESA ukončena.I když je podle současných údajů obtížné předpovědět odpověď pacienta na tyto terapie, ukázalo se, že přibližně 50% až 60% pacientů vykazuje zvýšení Hb o 2 g / dL při léčbě rHuEPO.9. Léčba ESA by měla být ukončena po ukončení léčby. chemoterapie.20,21
Doporučená dávka pro darbepoetin alfa je 2,25 mcg / kg jako týdenní subkutánní (SC) injekce. Pokud hladiny Hb po 6 týdnech nezvýší alespoň o 1 g / dl, měla by být dávka zvýšena na 4,5 μg / kg. Pokud hladina Hb vzroste během 2 týdnů o více než 1 g / dl nebo pokud Hb překročí 12 g / dl, měla by být dávka darbepoetinu snížena o 40% .20 Pokud je hladina Hb vyšší než 13 g / dl, je třeba podávání darbepoetinu ukončit. 9
Doporučená dávka rHuEPO je 40 000 U podávaných SC jednou týdně nebo 150 U / kg podávaných SC třikrát týdně u pacientů, jejichž hladiny Hb jsou nižší než 10 g / dL. Dávka rHuEPO by měla být snížena o 25%, pokud hladina Hb vzroste > 1 g / dL v jakémkoli dvoutýdenním období nebo dosáhne úrovně potřebné k zabránění transfuzi RBC.21
ESA jsou baleny v injekční lahvičce, kterou by se nemělo protřepávat, protože by došlo k denaturaci. brán v potaz. Předpokládá se, že ESA zvyšují nepříznivé kardiovaskularizace, zvyšují riziko venózního tromboembolismu, zkracují časovou progresi tumoru a snižují přežití u anemických pacientů s rakovinou prostřednictvím různých mechanismů.22,23 Z tohoto důvodu se použití ESA nedoporučuje u pacientů s rakovinou, kteří nepodstupují léčba chemoterapií nebo radioterapií.24 Všechny ESA mají varovnou tabulku s upozorněním na zvýšení rizika úmrtí, infarktu myokardu, cévní mozkové příhody, žilní tromboembolie, trombózy vaskulárního přístupu a progrese a recidivy tumoru.20,21 Program ESA APPRISE Oncology byl zřízen FDA, aby radila pacientům, pečovatelům a zdravotníkům o bezpečném používání ESA.25
Suplementace železem: Suplementace železem, nejlépe parenterálně, je indikována u pacientů s nízkou hladinou offerritinu ( 30 ng / ml), saturace transferinu (TSAT < 15%) a nízká (< 26 pg / buňka ) retikulocyt Hb kont t (CHr). U anemických pacientů s rakovinou byly rozpoznány dva typy nedostatku železa:
- Absolutní nedostatek železa (AID), ke kterému dochází při chronickém krvácení například kvůli GI nebo gynekologickým lézím, ztrátě krve chirurgickým zákrokem, výživě nedostatky a anémie chronických onemocnění (ACD). Je definována jako hladina feritinu v séru < 30 mcg / L a snížená TSAT o < 15% .1
- Funkční nedostatek železa (FID), který vzniká po pokračujícím užívání erytropoetinu. Je nejčastější příčinou nedostatečné odpovědi na terapii ESA, zejména u pacientů se selháním ledvin. Proto většina pacientů na terapii ESA bude nakonec vyžadovat suplementaci železem.6
Suplementace železem byla zavedena, když samotná terapie ESA prokázala špatnou míru odpovědi u pacientů léčených chemoterapií.1 Účinnost kombinace IV byla testována léčba železem a ESA a byla stanovena role železa ve funkčním deficitu železa.1 Zatímco současné důkazy podporují použití doplňování intravenózního železa pro zlepšení odpovědí hemoglobinu u anemických pacientů s rakovinou, jsou zapotřebí prospektivní studie o dlouhodobé účinnosti a bezpečnosti intravenózního železa Dále je třeba stanovit optimální dávkovací režimy.5
Železo lze podávat orálně nebo jako parenterální přípravky s nízkomolekulárním (LMW) železným dextranem, ferricglukonátem a železnou sacharózou. Parenterálně podávané železo má ve srovnání s perorálním železem lepší odpověď.6 Posledně uvedené se proto u pacientů s rakovinou s anémií používá jen zřídka a není v tomto článku diskutováno. Zkušební dávky se doporučují pro železo dextran. Pacientům, kteří vykazovali předchozí citlivost na železo dextran nebo jiné přípravky železa IV, nebo těm, kteří mají alergii na více léků, by měla být podána také zkušební dávka. TABULKA 2 ukazuje dávkovací režim pro doplnění železa IV.6
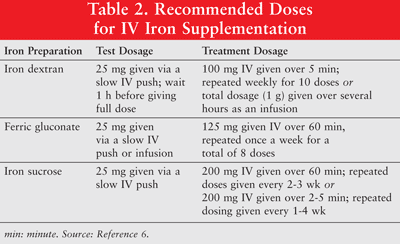
Parenterální železo je spojeno s hypotenzí, nevolností, zvracením a / nebo průjmem, bolestí, hypertenzí, dušností, svěděním, bolestmi hlavy a závratěmi. Navíc to může být nepohodlné pro správu a nákladné.9 Jelikož je dextran železa s vysokou molekulovou hmotností (HMW) spojován s vyšším výskytem nežádoucích účinků než LMW dextran železa, je celkově upřednostňován druhý.
Červená Transfúze krevních buněk: RBC jsou preferovaným krevním produktem pro transfuze ke korekci anémie v případech akutní anémie po krvácení. Někteří pacienti mohou vyžadovat infuzi, která je cytomegalovir negativní.Cílem použití transfuze RBC je léčba nebo prevence nedostatku kapacity kyslíku v krvi a transfuze není obvykle indikována, pokud je Hblevel pacienta ≥ 10 g / dL.6.
Transfúze RBC výhoda rychlého zvýšení hladin Hb a hematokritu bezprostředně po infuzi. Odhaduje se, že transfuze 300 ml (1 jednotka) čistých červených krvinek bude mít za následek průměrné zvýšení Hb o 1 g / dl nebo 3% hematokritu u jiného dospělého člověka, u kterého nedochází k současné ztrátě krve. To vede k celkovému rychlému zlepšení únavy.6
Před transfuzí erytrocytů musí být krev pacienta křížově porovnávána s ABOkompatibilitou. Pokud pacient vyžaduje opakované infuze, lze riziko nežádoucích účinků minimalizovat použitím krve snižující leukocyty a premedikace anantihistaminem nebo acetaminofenem.6
Transfúze RBC není bez rizika, včetně potenciálu infekčních infekcí přenášených transfuzí látky, transfuzní reakce, aloimunizace a imunosuprese.9 Mezi další rizika transfuze patří městnavé srdeční selhání, zvýšené trombotické příhody a přetížení železem.6 Je však užitečné poznamenat, že u pacientů vyžadujících infuzi erytrocytů během období odpovídajícího chemoterapii je velmi nepravděpodobné zažijte přetížení železem.6
Budoucí perspektivy
V současné době se uplatňují nové strategie pro zvládání anémie u pacientů s rakovinou. I když pro lidskou krev neexistuje žádná náhrada, vědci jsou v procesu vývoje produktů, které mají kapacitu červených krvinek přenášet kyslík. Připravujeme nosiče kyslíku na bázi Hb a perfluorované uhlovodíky.5
Závěr
Celkově lze říci, že optimální přístup k anémii jako důležitému problému v onkologii teprve bude stanoven. K tomuto problému přispívá nedostatek konzistence mezi poskytovateli zdravotní péče, jasná definice anémie u rakoviny a diagnostická kritéria.
1. Steinmetz HT. Úloha nitrožilního podávání železa při léčbě anémie u pacientů s rakovinou. Ther Adv Hematol. 2012; 3: 177-191.
2. deBenoist B, McLean E, Egli I a kol. Celosvětová prevalence anémie 1993–2005: Globální databáze WHO o anémii. Ženeva, Švýcarsko: Světová zdravotnická organizace; 2008.
3. Knight K, Wade S, Balducci L. Prevalence a výsledky anémie u rakoviny: systematický přehled literatury. Am J Med. 2004; 116 (doplněk 7A): 11S-26S.
4. Schwartz RN. Anémie u pacientů s rakovinou: výskyt, příčiny, dopady, léčba a použití léčebných pokynů a protokolů. Am J Health Syst Pharm. 2007; 64 (3 dod. 2): S5-S13; kvíz S28-S30.
5. Calabrich A, Katz A. Léčba anémie u pacientů s rakovinou. Budoucí Oncol. 2011; 7: 507-517.
6. Rodgers GM, Becker P, Blinder M a kol. Anémie vyvolaná rakovinou a chemoterapií. J Natl Compr Canc Netw. 2012; 10: 628-653.
7.. Groopman JE, Itri LM. Anemie vyvolaná chemoterapií u dospělých: výskyt a léčba. J Natl Cancer Inst. 1999; 91: 1616-1634.
8. Ludwig H, Strasser K. Symptomatologie anémie. Semin Oncol. 2001; 28: 7–14.
9. Gillespie TW. Anémie u rakoviny. Ošetřování rakoviny. 2003; 26: 119–128.
10.. Koeller JM. Klinické pokyny pro léčbu anémie související s rakovinou. Farmakoterapie. 1998; 18: 156-169.
11.. Cazzola M, Mercuriali F, Brugnara C. Použití rekombinantního lidského erytropoetinu mimo prostředí uremie. Krev. 1997; 89: 424-867.
12.. Nowrousian MR, Kasper C, Oberhoff C a kol. Patofyziologie anémie související s rakovinou. In: Smith JF, Boogaerts MA, Ehmer B, eds. Erytropoetin v léčbě rakoviny podporující. New York, NY: Marcel Dekker; 1997: 13–34.
13.. Vaupel P, Dunst J, Engert A a kol. Účinky rekombinantního lidského erytropoetinu (rHuEPO) na kontrolu nádoru u pacientů s anémií vyvolanou rakovinou. Onkologie. 2005; 28: 216-221.
14.. Zhao KL, Liu G, Jiang GL a kol. Souvislost hladiny hemoglobinu s morbiditou a mortalitou pacientů s lokálně pokročilým karcinomem jícnu podstupujícím radioterapii – sekundární analýza tří po sobě jdoucích klinických studií fáze III. Clin Oncol (R Coll Radiol). 2006; 18: 621-627.
15. Glaspy JA. Vývoj erytropoetických látek v onkologii. Odborné posudkové léky. 2005; 10: 553-567.
16.. Adamson JW, Spivak JL. Fyziologické základy pro farmakologické použití rekombinantního lidského erytropoetinu v chirurgii a léčbě rakoviny. Chirurgická operace. 1994; 115: 7–15.
17. Ferrario E, Ferrari L, Bidoli P a kol. Léčba anémie související s rakovinou epoetinem alfa: přehled. Cancer Treat Rev.2004; 30: 563-575.
18. Lyman GH, Glaspy J. Existují klinické výhody včasné erytropoetické intervence u anémie vyvolané chemoterapií? Asystematic review. Rakovina. 2006; 106: 223-233.
19. Rizzo JD, Brouwers M, Hurley P a kol. Aktualizace pokynů pro klinické praxe v Americké společnosti pro klinickou onkologii / Americká společnost pro hematologii o používání epoetinu a darbepoetinu u dospělých pacientů s rakovinou. J Clin Oncol. 2010; 28: 4996-5010.
20. Informace o předepisování přípravku Aranesp (darbepoetin alfa).Thousand Oaks, CA: Amgen Inc; Květen 2012.
21. Informace o předepisování přípravku Procrit (epoetin alfa). Horsham, PA: Janssen Products, LP; Červenec 2012.
22.. Beutel G, Ganser A. Rizika a přínosy látek stimulujících erytropoézu při léčbě rakoviny. Semin Hematol. 2007; 44: 157-165.
23. Fenner MH, Ganser A. Erytropoetin při anémii související s rakovinou. Curr Opin Oncol. 2008; 20: 685-689.
24.. Smith RE Jr, Aapro MS, Ludwig H a kol. Darbepoetinalfa k léčbě anémie u pacientů s aktivním nádorovým onemocněním, kteří neobdrželi chemoterapii nebo radioterapii: výsledky multicentrické, randomizované, dvojitě zaslepené, placebem kontrolované studie fáze III. J Clin Oncol. 2008; 26: 1040-1050.
25. Onkologický program ESA APPRISE. Amgen and Janssen Products, LP. www.esa-apprise.com. Zpřístupněno 13. října 2013.