Snížení tlaku par
Jak je popsáno v kapitole o kapalinách a pevných látkách, rovnovážný tlak par kapaliny je tlak vyvíjený jejími plynnými skupinami fáze, kdy dochází k odpařování a kondenzaci stejnou rychlostí:
\ text {liquid} \ rightleftharpoons \ text {gas}
Rozpouštění netěkavé látky v těkavé kapalině vede ke snížení tlaku par kapaliny. Tento jev lze racionalizovat zvážením účinku přidaných molekul rozpuštěné látky na procesy odpařování a kondenzace kapaliny. Aby se odpařily, musí být na povrchu roztoku přítomny molekuly rozpouštědla. Přítomnost rozpuštěné látky zmenšuje povrchovou plochu molekul rozpouštědla a tím snižuje rychlost odpařování rozpouštědla. Protože rychlost kondenzace není ovlivněna přítomností rozpuštěné látky, výsledkem je, že rovnováhy odpařování a kondenzace je dosaženo s menším počtem molekul rozpouštědla v plynné fázi (tj. Při nižším tlaku par) (obrázek 1). I když je tato kinetická interpretace užitečná, nezohledňuje několik důležitých aspektů koligativní povahy snižování tlaku par. Přísnější vysvětlení zahrnuje vlastnost entropie, což je téma diskuse v pozdější textové kapitole o termodynamice. Pro účely porozumění snížení tlaku par kapaliny je vhodné poznamenat, že větší entropie roztoku ve srovnání s jeho odděleným rozpouštědlem a solutem slouží k účinné stabilizaci molekul rozpouštědla a brání jejich odpařování. Výsledkem je nižší tlak par a odpovídající vyšší teplota varu, jak je popsáno v další části tohoto modulu.
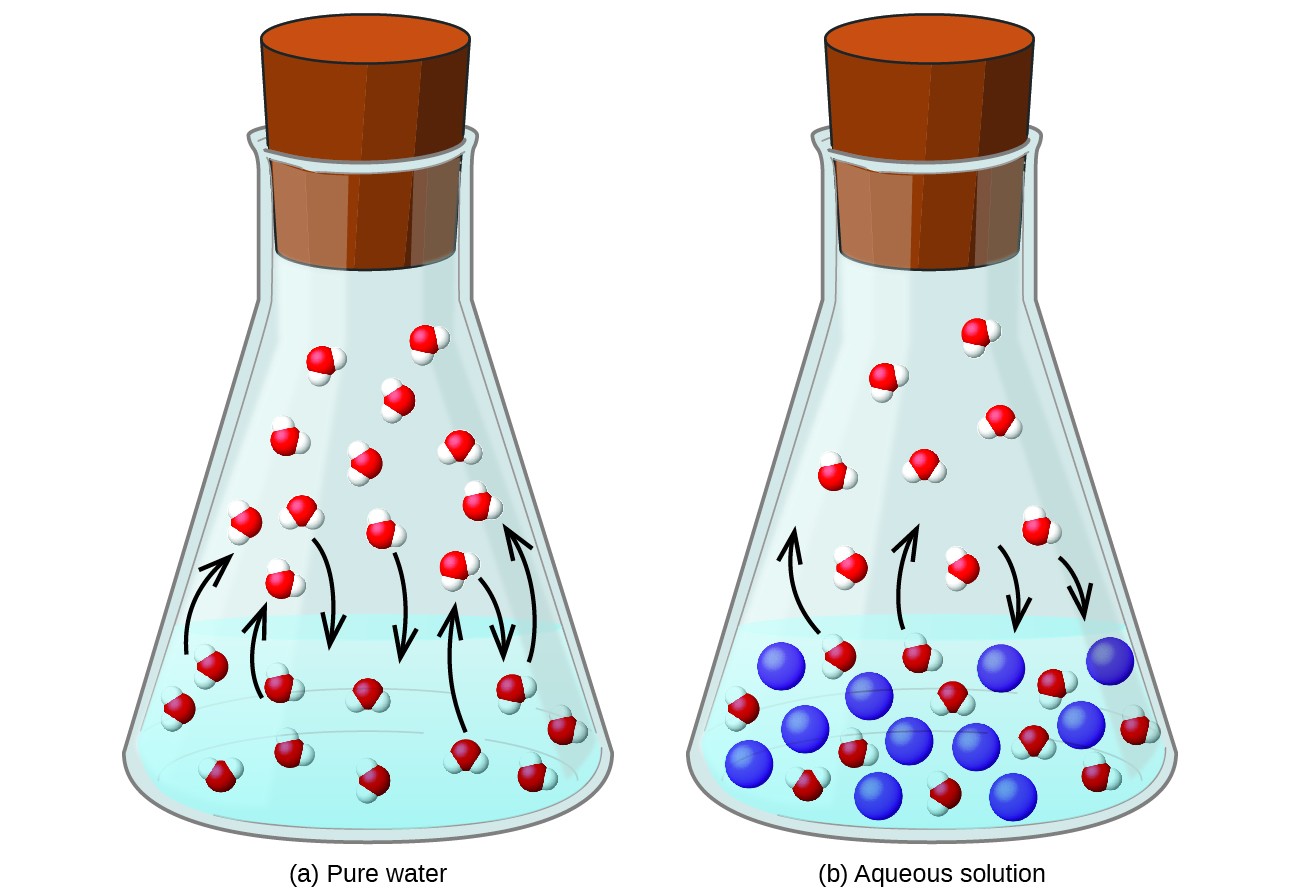
Obrázek 1. Přítomnost netěkavých rozpuštěných látek snižuje tlak par v roztoku tím, že brání odpařování molekul rozpouštědla.
Vztah mezi tlaky par složek roztoku a koncentracemi tyto složky popisuje Raoultův zákon: Parciální tlak vyvíjený jakoukoli složkou ideálního řešení se rovná tlaku par čisté složky vynásobenému jejím molárním zlomkem v roztoku.
{P} _ {\ text {A}} = {X} _ {\ text {A}} {P} _ {\ text {A}} ^ {\ star}
Připomínáme, že celkový tlak plynné směsi se rovná součtu parciálních tlaků pro všechny její složky (Daltonův zákon parciálních tlaků), celkový tlak par vyvíjený roztokem obsahujícím i složky je
{ P} _ {\ text {solution}} = \ sum _ {i} {P} _ {i} = \ sum _ {i} {X} _ {i} {P} _ {i} ^ {\ star}
Těkavou látkou je látka, jejíž tlak par je zanedbatelný (P ^ {\ star} ≈ 0), a proto je tlak par nad roztokem obsahujícím pouze těkavé látky způsoben pouze rozpouštědlem:
{P} _ {\ text {solution}} = {X} _ {\ text {solvent}} {P} _ {\ text {solvent}} ^ {\ star}
Destilace roztoků
Destilace je technika separace složek směsí, která je široce používána jak v laboratoři, tak v průmyslovém prostředí. Používá se k rafinaci ropy, k izolaci produktů fermentace a k čištění vody. Tato separační technika zahrnuje řízené zahřívání směsi vzorku k selektivnímu odpařování, kondenzaci a shromažďování jedné nebo více sledovaných složek. Typické zařízení pro laboratorní destilaci je znázorněno na obrázku 2.

Obrázek 2. Typický laboratorní destilační jednotka je uvedena na (a) fotografii a (b) schematickém diagramu složek. (kredit a: úprava díla „Rifleman82“ / Wikimedia Commons; kredit b: úprava díla „Slashme“ / Wikipedia)
Ropné rafinerie používají k oddělení ropné rafinerie rozsáhlou frakční destilaci složky ropy. Surová ropa se zahřívá na vysoké teploty na základně vysoké frakcionační kolony, přičemž se odpařuje mnoho složek, které uvnitř kolony stoupají. Vzhledem k tomu, že odpařené komponenty dosáhnou během výstupu adekvátně chladných zón, kondenzují a jsou shromažďovány. Zachycené kapaliny jsou jednodušší směsi uhlovodíků a jiných ropných sloučenin, které mají vhodné složení pro různé aplikace (např. Motorová nafta, petrolej, benzín), jak je znázorněno na obrázku 3.

Obrázek 3. Ropa je složitá směs, která je oddělena frakční destilací ve velkém měřítku za účelem izolace různých jednodušších směsí.
Nadmořská výška bodu varu
Jak je popsáno v kapitole o kapalinách a pevných látkách, bodem varu kapaliny je teplota, při které se její tlak par rovná atmosférickému tlaku okolí.Jelikož je tlak par roztoku snížen kvůli přítomnosti netěkavých rozpuštěných látek, je zřejmé, že bod varu roztoku bude následně zvýšen. Ve srovnání s čistým rozpouštědlem bude tedy roztok vyžadovat vyšší teplotu, aby se dosáhlo daného tlaku par, včetně jedné ekvivalentní tlaku okolní atmosféry. Zvýšení bodu varu pozorované, když je těkavá rozpuštěná látka rozpuštěna v rozpouštědle, ΔTb, se nazývá elevace bodu varu a je přímo úměrná molové koncentraci druhů rozpuštěných látek:
\ Delta {T} _ {\ text {b}} = {K} _ {\ text {b}} m
kde Kb je konstantní bod varu, nebo ebullioskopická konstanta am je koncentrace molalů (molality) všech druhů rozpuštěných látek.
Konstanty zvýšení bodu varu jsou charakteristické vlastnosti, které závisí na identitě rozpouštědla. Hodnoty Kb pro několik rozpouštědel jsou uvedeny v tabulce 1.
Míra snížení tlaku par rozpouštědla a zvýšení teploty varu závisí na celkovém počtu částic rozpuštěné látky v daném množství rozpouštědla, ne na hmotnosti nebo velikosti nebo chemické identitě částic. 1 m vodný roztok sacharózy (342 g / mol) a 1 m vodný roztok ethylenglykolu (62 g / mol) budou mít stejnou teplotu varu, protože každý roztok má jeden mol částic (molekul) rozpuštěné látky na kilogram rozpouštědla .
Příklad 6: Bod varu jodového roztoku
Najděte teplotu varu roztoku 92,1 g jodu, I2, v 800,0 g chloroformu, CHCI3 , za předpokladu, že jód je netěkavý a že řešení je ideální.
Zkontrolujte své učení
Jaká je teplota varu roztoku 1,0 g glycerin, C3H5 (OH) 3, ve 47,8 g vody? Předpokládejte ideální řešení.
Deprese bodu mrazu

Obrázek 4. Kamenná sůl ( NaCl), chlorid vápenatý (CaCl2) nebo jejich směs se používají k roztavení ledu. (zápočet: úprava díla Eddieho Welkera)
Řešení zamrzají při nižších teplotách než čisté kapaliny. Tento jev se využívá v „odmrazovacích“ systémech, které používají k rozpuštění ledu na silnicích a chodnících sůl (obrázek 4), chlorid vápenatý nebo močovinu, a při použití ethylenglykolu jako „nemrznoucí směsi“ v automobilových chladičích. Mořská voda zmrzne při nižší teplotě než sladká voda, a tak arktické a antarktické oceány zůstávají nezmrzlé i při teplotách pod 0 ° C (stejně jako tělesné tekutiny ryb a jiných chladnokrevných mořských živočichů, kteří v těchto oceánech žijí).
Pokles bodu tuhnutí zředěného roztoku ve srovnání s poklesem čistého rozpouštědla, ΔTf, se nazývá deprese bodu tuhnutí a je přímo úměrný koncentraci molal v solutu.
\ Delta {T} _ {\ text {f}} = {K} _ {\ text {f}} m
kde m je molal koncentrace rozpuštěné látky v rozpouštědlo a Kf se nazývá konstanta deprese bodu mrazu (nebo kryoskopická konstanta). Stejně jako u konstant elevace bodu varu se jedná o charakteristické vlastnosti, jejichž hodnoty závisí na chemické identitě rozpouštědla. Hodnoty Kf pro několik rozpouštědel jsou uvedeny v tabulce 1.
Koligativní vlastnosti a odstraňování ledu
Chlorid sodný a jeho analogy skupiny 2, vápník a chlorid hořečnatý, se často používají k odmrazování vozovek a chodníků, vzhledem k tomu, že roztok kterékoli z těchto solí bude mít bod tuhnutí nižší než 0 ° C, bod tuhnutí čisté vody. Soli kovů skupiny 2 se často mísí s levnějším a snáze dostupným chloridem sodným („kamenná sůl“) pro použití na silnicích, protože mají tendenci být o něco méně korozivní než NaCl a poskytují větší pokles bodu tuhnutí , protože se disociují za vzniku tří částic na jednotku vzorce, spíše než dvou částic, jako je chlorid sodný.
Protože tyto iontové sloučeniny mají tendenci urychlovat korozi kovů, nebylo by moudré použít je v nemrznoucí směs pro chladič ve vašem autě nebo pro odmrazování letadla před vzletem.Pro tyto aplikace se často používají kovalentní sloučeniny, jako je ethylen nebo propylenglykol. Glykoly používané v kapalině chladiče nejen snižují bod tuhnutí kapaliny, ale také zvyšují bod varu, což činí kapalinu užitečnou v zimě i v létě. Vyhřívané glykoly se často stříkají na povrch letadel před vzletem za nepříznivého zimního počasí, aby se odstranil již vytvořený led a zabránilo se tvorbě většího množství ledu, což by bylo zvláště nebezpečné, pokud se vytvoří na řídících plochách letadla (obrázek 5).

Obrázek 5. Deprese bodu mrazu se využívá k odstranění ledu z (a) vozovek a (b) řídicí plochy letadel.
Fázový diagram řešení
Korelační účinky na tlak par, bod varu a bod tuhnutí popsané v předchozí části jsou pohodlně shrnuty porovnáním fázových diagramů pro čistou kapalinu a roztok odvozený od této kapaliny. Fázová schémata pro vodu a vodný roztok jsou uvedena na obrázku 6.
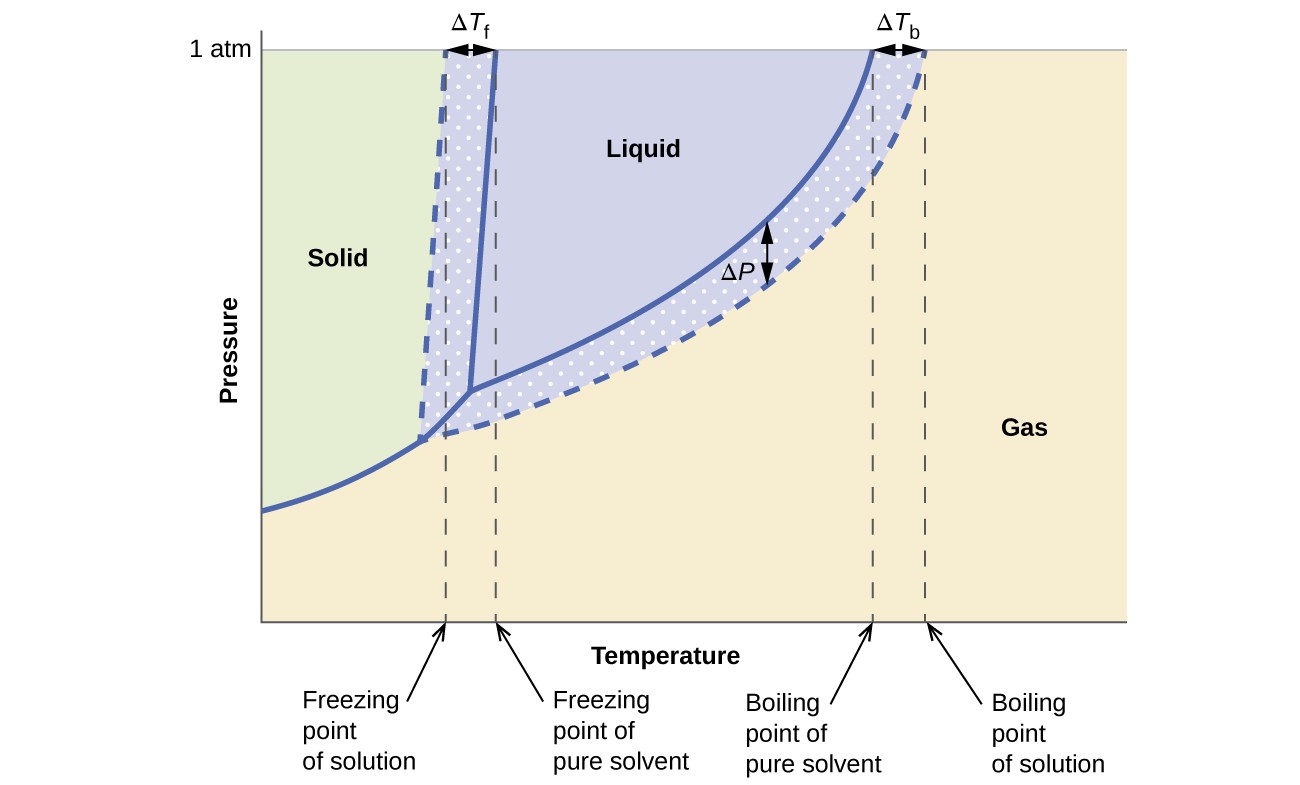
Obrázek 6. Tyto fáze diagramy ukazují vodu (pevné křivky) a vodný roztok neelektrolytu (přerušované křivky).
Křivka kapalina-pára pro roztok je umístěna pod odpovídající křivkou pro rozpouštědlo, která zobrazuje páru snížení tlaku, ΔP, které je výsledkem rozpuštění těkavé látky. V důsledku toho je při jakémkoli daném tlaku pozorován bod varu roztoku při vyšší teplotě, než je teplota čistého rozpouštědla, což odráží zvýšení bodu varu ΔTb spojené s přítomností netěkavé látky. Křivka tuhá látka-kapalina pro roztok je posunuta doleva od křivky pro čisté rozpouštědlo, což představuje pokles bodu mrznutí ΔTb, který doprovází tvorbu roztoku. Nakonec si všimněte, že křivky tuhého plynu pro rozpouštědlo a jeho roztok jsou identické. To je případ mnoha roztoků obsahujících kapalná rozpouštědla a netěkavé rozpuštěné látky. Stejně jako v případě odpařování, když je roztok tohoto druhu zmrazen, ve skutečnosti jsou to pouze molekuly rozpouštědla, které procházejí přechodem kapalina-tuhá látka a vytvářejí čisté pevné rozpouštědlo, které vylučuje rozpustné látky. Pevné a plynné fáze jsou tedy složeny pouze z rozpouštědla, takže přechody mezi těmito fázemi nepodléhají koagulačním účinkům.
Osmóza a osmotický tlak řešení
Řada přirozených a syntetické materiály vykazují selektivní permeaci, což znamená, že pouze molekuly nebo ionty určité velikosti, tvaru, polarity, náboje atd. jsou schopné procházet (pronikat) materiálem. Biologické buněčné membrány poskytují elegantní příklady selektivní permeace v přírodě, zatímco dialyzační hadičky používané k odstraňování metabolických odpadů z krve jsou jednodušším technologickým příkladem. Bez ohledu na to, jak mohou být vyrobeny, jsou tyto materiály obecně označovány jako semipermeabilní membrány.
Zvažte zařízení znázorněné na obrázku 7, ve kterém jsou vzorky čistého rozpouštědla a roztoku odděleny membránou, která obsahuje pouze rozpouštědlo molekuly mohou pronikat. Molekuly rozpouštědla budou difundovat přes membránu v obou směrech. Vzhledem k tomu, že koncentrace rozpouštědla je vyšší v čistém rozpouštědle než v roztoku, budou tyto molekuly difundovat ze strany rozpouštědla membrány na stranu roztoku rychleji, než v opačném směru. Výsledkem je čistý přenos molekul rozpouštědla z čistého rozpouštědla do roztoku. Difúzní přenos molekul rozpouštědla přes semipermeabilní membránu je proces známý jako osmóza.
Obrázek 7. (a) Roztok a čisté rozpouštědlo se nejprve oddělí osmotickou membránou. (b) Čistý přenos molekul rozpouštědla do roztoku probíhá, dokud jeho osmotický tlak nepřinese stejnou rychlost přenosu v obou směrech.
Když se osmóza provádí v zařízení, jako je to na obrázku 7 , objem roztoku se zvětšuje s ředěním akumulací rozpouštědla. To způsobí zvýšení hladiny roztoku, zvýšení jeho hydrostatického tlaku (kvůli hmotnosti kolony roztoku v trubici) a výsledkem je rychlejší přenos molekul rozpouštědla zpět na stranu čistého rozpouštědla. Když tlak dosáhne hodnoty, která vede k reverzní rychlosti přenosu rozpouštědla rovné rychlosti osmózy, přestane hromadný přenos rozpouštědla. Tento tlak se nazývá osmotický tlak (Π) roztoku. Osmotický tlak zředěného roztoku souvisí s jeho molaritou v solutu, M a absolutní teplotou T, podle rovnice
\ Pi = MRT
kde R je univerzální plynová konstanta.
Pokud je roztok umístěn do aparátu, jako je ten, který je znázorněn na obrázku 8, použití vyššího tlaku než je osmotický tlak roztoku obrátí osmózu a tlačí molekuly rozpouštědla z roztoku do čistého rozpouštědla. Tato technika reverzní osmózy se používá k rozsáhlému odsolování mořské vody a v menších měřítcích k výrobě vysoce čisté pitné vody z vodovodu.
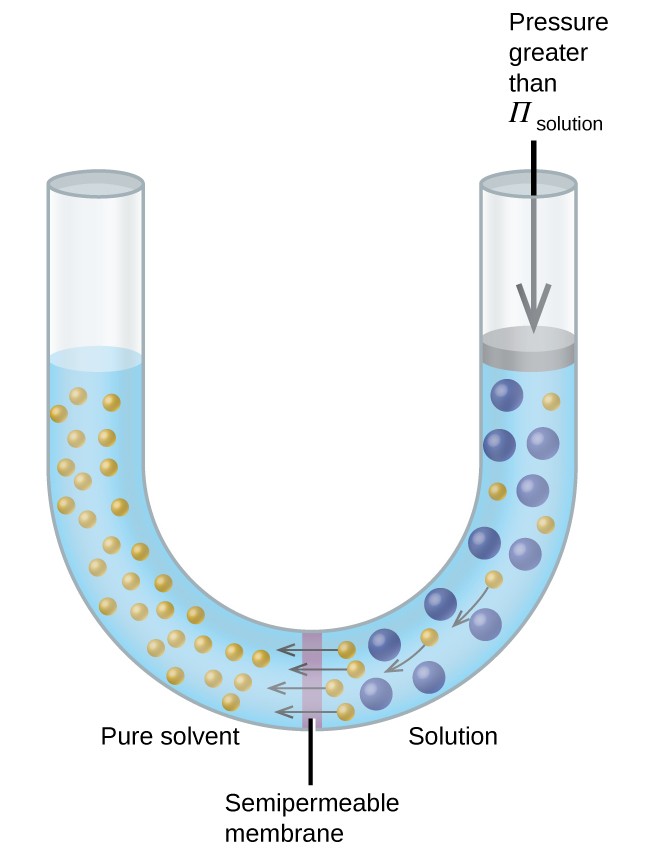
Obrázek 8. Použitím tlaku většího než osmotický tlak roztoku se osmóza zvrátí. Molekuly rozpouštědla z roztoku jsou natlačeny do čistého rozpouštědla.
Čištění vody reverzní osmózou
V procesu osmózy slouží difúze k pohybu vody přes semipermeabilní membrána z méně koncentrovaného roztoku do koncentrovanějšího roztoku. Osmotický tlak je množství tlaku, které musí být aplikováno na koncentrovanější roztok, aby se zastavila osmóza. Pokud se použije větší tlak, voda přejde z koncentrovanějšího roztoku do méně koncentrovaného (čistšího) roztoku. Tomu se říká reverzní osmóza. Reverzní osmóza (RO) se používá k čištění vody v mnoha aplikacích, od odsolovacích zařízení v pobřežních městech, po stroje na čištění vody v obchodech s potravinami (obrázek 9) a menší domácí jednotky s reverzní osmózou. S ručně ovládaným čerpadlem lze malé jednotky RO použít v zemích třetího světa, v oblastech postižených katastrofami a v záchranných člunech. Naše vojenské síly mají celou řadu generátorem ovládaných jednotek RO, které lze přepravovat ve vozidlech na vzdálená místa.

Obrázek 9. Systémy reverzní osmózy pro čištění pitné vody jsou zde zobrazeny na (a) malém a (b) velkém měřítku. (zápočet a: modifikace díla Jerryho Kirkharta; zápočet b: modifikace díla Willarda J. Lathropa)
Příklady osmózy jsou patrné v mnoha biologických systémech, protože buňky jsou obklopené polopropustnými membránami. Mrkev a celer, které ochably, protože ztratily vodu, lze znovu zkřehnout umístěním do vody. Voda se pohybuje do buněk mrkve nebo celeru osmózou. Okurka umístěná v koncentrovaném solném roztoku ztrácí vodu osmózou a absorbuje trochu soli, aby se stala okurkou. Osmóza může také ovlivnit zvířecí buňky. Koncentrace rozpuštěných látek jsou zvláště důležité při vstřikování roztoků do těla. Rozpuštěné látky v tělních tekutinách a krevním séru dávají těmto roztokům osmotický tlak přibližně 7,7 atm. Roztoky vstřikované do těla musí mít stejný osmotický tlak jako krevní sérum; to znamená, že by měly být izotonické s krevním sérem. Pokud se vstřikuje méně koncentrovaný roztok, hypotonický roztok, v dostatečném množství k naředění krevního séra, voda ze zředěného séra prochází do krvinek osmózou, což způsobuje expanzi a prasknutí buněk. Tento proces se nazývá hemolýza. Když se vstřikuje koncentrovanější roztok, hypertonický roztok, buňky ztrácejí vodu do koncentrovanějšího roztoku, scvrkávají se a pravděpodobně zemřou v procesu zvaném crenation. Tyto účinky jsou znázorněny na obrázku 10.
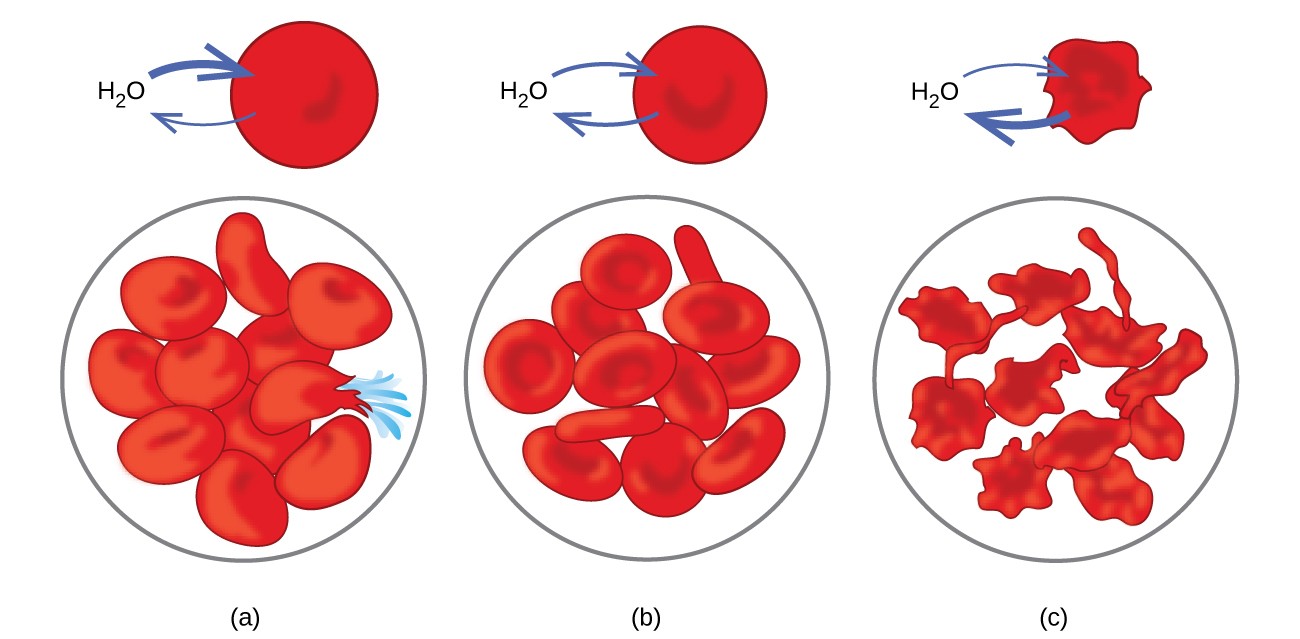
Obrázek 10. Membrány červených krvinek jsou propustné pro vodu a bude (a) bobtnat a případně prasknout v hypotonickém roztoku; (b) udržovat normální objem a tvar v izotonickém roztoku; a (c) scvrknout se a případně zemřít v hypertonickém roztoku. (zápočet a / b / c: úpravy díla „LadyofHats“ / Wikimedia Commons)
Stanovení molárních hmot
Osmotický tlak a změny bodu tuhnutí, var bod a tlak par jsou přímo úměrné koncentraci přítomné rozpustné látky. V důsledku toho můžeme použít měření jedné z těchto vlastností k určení molární hmotnosti rozpuštěné látky z měření.
Kolaktivní vlastnosti elektrolytů
Jak již bylo uvedeno v tomto modulu, koligativní vlastnosti roztoku závisí pouze na počtu rozpuštěných druhů solutů, nikoli na jejich identitě. Koncentrační podmínky v rovnicích pro různé koligativní vlastnosti (deprese bodu mrazu) , zvýšení bodu varu, osmotický tlak) se týkají všech druhů rozpuštěných látek přítomných v roztoku. U roztoků, které jsou v této kapitole uvažovány, byly rozpuštěnými látkami neelektrolyty, které se fyzicky rozpouštějí bez disociace nebo jiného doprovodného procesu. le, který se rozpouští, poskytuje jednu rozpuštěnou molekulu rozpuštěné látky. Rozpuštění elektrolytu však není tak jednoduché, jak dokládají dva běžné příklady níže:
Vzhledem k prvnímu z těchto příkladů a za předpokladu úplné disociace obsahuje 1,0 m vodný roztok NaCl 2,0 mol iontů (1,0 mol Na + a 1.0 mol Cl−) na každý kilogram vody a očekává se, že deprese jeho bodu mrazu bude
Když je toto řešení skutečně připraveno a změřena jeho deprese bodu mrazu, je získána hodnota 3,4 ° C. Podobné nesrovnalosti jsou pozorovány u jiných iontových sloučenin a rozdíly mezi naměřenými a očekávanými hodnotami koligativních vlastností se obvykle stávají významnějšími, jak se zvyšují koncentrace rozpuštěných látek. Tato pozorování naznačují, že ionty chloridu sodného (a dalších silných elektrolytů) nejsou v roztoku zcela disociovány.
Abychom to vysvětlili a vyhnuli se chybám doprovázejícím předpoklad celkové disociace, experimentálně měřený parametr pojmenovaný používá se čest německého chemika oceněného Nobelovou cenou Jacobus Henricus van’t Hoff. Van’t Hoffův faktor (i) je definován jako poměr částic rozpuštěné látky v roztoku k počtu rozpuštěných jednotek vzorce:
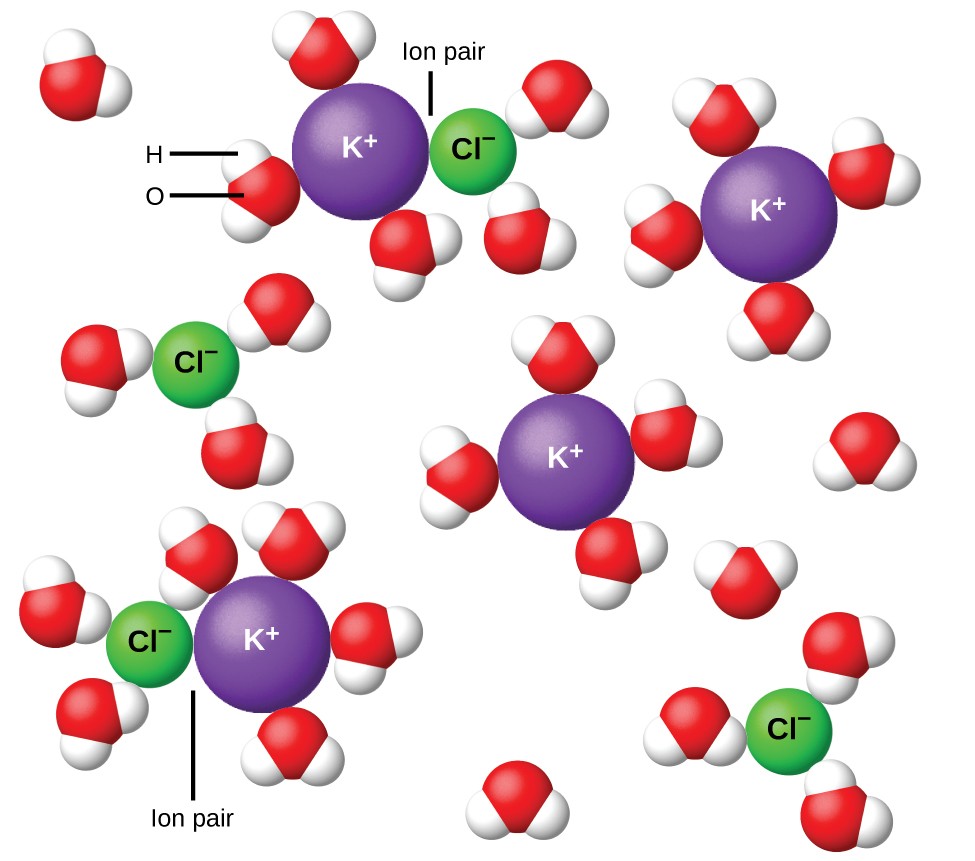
Obrázek 11. Iony jsou čím dál tím více oddělovány, čím více je roztok zředěn, a zbytkové interiontové přitažlivosti se zmenší.
V roce 1923 navrhli chemici Peter Debye a Erich Hückel teorii vysvětlující zjevnou neúplnou ionizaci silných elektrolytů. Navrhli, že ačkoliv je interiontová přitažlivost ve vodném roztoku velmi výrazně snížena solvatací iontů a izolačním účinkem polárního rozpouštědla, není zcela zrušena. Zbytkové přitažlivosti zabraňují iontům chovat se jako zcela nezávislé částice (obrázek 11). V některých případech se může pozitivní a negativní iont skutečně dotknout, což dává solvatovanou jednotku zvanou iontový pár. Aktivita nebo efektivní koncentrace jakéhokoli konkrétního druhu iontu je tedy menší než aktivita indikovaná skutečnou koncentrací. Čím více se ionty oddělují, tím více se roztok zředí a zbytkové interiontové přitažlivosti jsou čím dál tím méně. V extrémně zředěných roztocích jsou tedy účinné koncentrace iontů (jejich aktivity) v podstatě stejné jako skutečné koncentrace. Všimněte si, že van’t Hoffovy faktory pro elektrolyty v tabulce 2 jsou pro 0,05 m roztoky, při kterých je koncentrace i pro NaCl 1,9, na rozdíl od ideální hodnoty 2.
Příklad 11: Bod tuhnutí roztoku elektrolytu
Koncentrace iontů v mořské vodě je přibližně stejná jako v roztoku obsahujícím 4,2 g NaCl rozpuštěného ve 125 g vody. Předpokládejme, že každý z iontů v roztoku NaCl má stejný účinek na bod tuhnutí vody jako molekula neelektrolytu, a určíme teplotu tuhnutí roztoku (která se přibližně rovná teplotě tuhnutí mořské vody).
Zkontrolujte své učení
Předpokládejte, že každý z iontů v chloridu vápenatém, CaCl2, má stejný účinek na bod mrazu vody jako molekula neelektrolytu. Vypočítejte bod tuhnutí roztoku 0,724 g CaCl2 ve 175 g vody.
Vyzkoušet
- Maso lze klasifikovat jako čerstvé (nezmrazené), i když je skladováno při teplotě -1 ° C. Proč by maso při této teplotě nezmrazilo?
- Organická sloučenina má složení 93,46% C a 6,54% H hmotnostně. Roztok 0,090 g této sloučeniny v 1,10 g kafru taje při 158,4 ° C. Teplota tání čistého kafru je 178,4 ° C. Kf pro kafr je 37,7 ° C / m. Jaký je molekulární vzorec rozpuštěné látky? Ukažte své výpočty.Je známo, že sůl je fluorid alkalického kovu. Rychlé přibližné stanovení bodu tuhnutí naznačuje, že 4 g soli rozpuštěné ve 100 g vody vytvoří roztok, který zamrzne při asi -1,4 ° C. Jaký je vzorec soli? Ukažte své výpočty.
Glosář
aktivita: účinná koncentrace iontů v roztoku; je nižší než skutečná koncentrace kvůli iontovým interakcím.
Zvýšení bodu varu: zvýšení bodu varu kapaliny přidáním rozpuštěné látky
Konstanta zvýšení bodu varu: konstanta proporcionality v rovnici vztahující se ke zvýšení bodu varu k molární solutě; také známá jako ebullioskopická konstanta osmózou
deprese bodu tuhnutí: snížení bodu tuhnutí kapaliny přidáním rozpuštěné látky
konstanta deprese bodu tuhnutí: (také kryoskopická konstanta) konstanta proporcionality v rovnici vztahující se deprese bodu mrazu k rozpuštěné molalitě
hemolýza: prasknutí červených krvinek v důsledku akumulace přebytečné vody osmózou
hypertonický: vyšší osmotický tlak
hypotonický : méně osmotického tlaku
iontový pár: solvatovaný pár anion / kation udržovaný pohromadě mírnou elektrostatickou přitažlivostí
izotonický: stejného osmotického tlaku
molalita (m) : jednotka koncentrace definovaná jako poměr počtu molů rozpuštěné látky k hmotnosti rozpouštědla v kilogramech
molární zlomek (X): poměr molárního množství složky roztoku k celkovému počtu molů všech složek roztoku
osmóza: difúze molekul rozpouštědla polopropustnou membránou
osmotický tlak (Π ): potřebný opačný tlak, aby se zabránilo hromadnému přenosu molekul rozpouštědla přes semipermeabilní membránu.
Raoultův zákon: parciální tlak vyvíjený složkou roztoku se rovná součinu molární frakce složky v roztoku a jeho rovnováze tlak par v čistém stavu
semipermeabilní membrána: membrána, která selektivně umožňuje průchod určitých iontů nebo molekul
van’t Hoffův faktor (i): poměr počtu molů částic v roztoku na počet molů formulačních jednotek rozpuštěných v roztoku.
- Pro srovnání je uveden neelektrolyt. ↵

