Streptokoky jsou velkou skupinou grampozitivních, nemotivních a nespórotvorných koků asi 0,5 Velikost -1,2 µm. Často rostou v párech nebo řetězcích a jsou negativní na oxidázu a katalázu.
S pyogenes má tendenci kolonizovat horní dýchací cesty a je vysoce virulentní, protože překonává obranný systém hostitele. Mezi nejčastější formy onemocnění S pyogenes patří infekce dýchacích cest a kůže, přičemž za každou formu jsou obvykle odpovědné různé kmeny.
Buněčná stěna S pyogenes je velmi složitá a chemicky různorodá. Antigenní složky buňky jsou faktory virulence. Mezi extracelulární složky odpovědné za proces onemocnění patří invaziny a exotoxiny. Nejvzdálenější kapsle je složena z kyseliny hyaluronové, která má chemickou strukturu připomínající hostitelskou pojivovou tkáň, což umožňuje bakterii uniknout uznání hostitelem jako protiprávního činidla. Bakterie tak uniká fagocytóze neutrofily nebo makrofágy, což jí umožňuje kolonizovat. Kyselina lipoteichoová a M proteiny umístěné na buněčné membráně procházejí buněčnou stěnou a vystupují mimo kapsli.
Invaze buněk epitelu
Charakteristika S pyogenes je schopnost organismu napadnout epiteliální buňky. Stále častěji se objevuje selhání eradikace S-pyogenů penicilinem z hrdla pacientů, zejména těch, kteří jsou nositeli S-pyogenů. Výsledky jedné studie silně naznačují, že pokud je stav nosiče výsledkem přežití streptokoků v intraepiteliálních buňkách, může selhání penicilinu zabíjet požité S pyogeny souviset s nedostatkem účinného vstupu penicilinu do buněk epitelu. Tato pozorování mohou mít klinické důsledky pro pochopení nosičů a zvládnutí infekce S pyogenes.
Faktory bakteriální virulence
Mezi antigeny buněčné stěny patří kapsulární polysacharid (látka C ), peptidoglykan a kyselina lipoteichoová (LTA), R a T proteiny a různé povrchové proteiny, včetně M proteinu, fimbrických proteinů, proteinů vázajících fibronektin (např. protein F) a streptokinázy vázané na buňky.
C-látka se skládá z rozvětveného polymeru L-ramnózy a N-acetyl-D-glukosaminu. Může hrát roli ve zvýšené invazivní kapacitě. R a T proteiny se používají jako epidemiologické markery a nemají žádnou známou roli ve virulenci.
Další faktor virulence, C5A peptidáza, ničí chemotaktické signály štěpením komplementární složky C5A.
M protein, hlavním faktorem virulence, je makromolekula zabudovaná do fimbrií přítomných na buněčné membráně vyčnívající na bakteriální buněčnou stěnu. Je primární příčinou antigenního posunu a antigenního driftu mezi plynem. (Viz obrázek níže.)
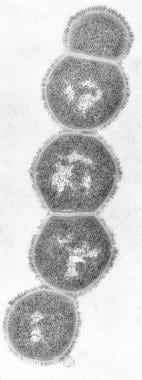 Streptokoky skupiny A. M protein.
Streptokoky skupiny A. M protein. M protein váže hostitelský fibrinogen a blokuje vazbu komplementu k podkladovému peptidoglykanu. To umožňuje přežití organismu potlačením fagocytózy. Kmeny, které obsahují velké množství M proteinu, odolávají fagocytóze, rychle se množí v lidských tkáních a iniciují proces onemocnění. Po akutní infekci se v některých případech vyvinou typově specifické protilátky proti aktivitě M proteinu.
Ačkoli tyto protilátky chrání před infekcí homologním typem M proteinu, neposkytují žádné imunita proti jiným typům M. Toto pozorování je jedním z faktorů představujících hlavní teoretickou překážku návrhu vakcíny proti S pyogenes, protože do dnešního dne bylo popsáno více než 80 M sérotypů.
Ohniska konkrétní streptokoková onemocnění bývají spojována s určitými typy M; proto je M sérotypizace velmi cenná pro epidemiologické studie.
Faktory bakteriální přilnavosti
Bylo navrženo alespoň 11 různých povrchových složek GAS role v adhezi. V roce 1997 Hasty a Courtney navrhli, aby GAS exprimoval různá pole adhesinů v různých environmentálních výklencích. Na základě jejich přehledu zprostředkovává M protein u lidí adhezi k buňkám HEp-2, ale nikoliv k bukálním buňkám, zatímco FBP54 zprostředkovává adhezi k bukálním buňkám, ale nikoli k buňkám HEp-2. Protein F zprostředkovává adhezi k Langerhansovým buňkám, ale nikoli ke keratinocytům.
Jednou z navrhovaných teorií týkajících se procesu adheze je dvoustupňový model. Počáteční krok k překonání elektrostatického odpuzování bakterií od hostitele je zprostředkován LTA, která poskytuje slabou, reverzibilní adhezi. Druhý krok má formu pevné, ireverzibilní adheze zprostředkované tkáňově specifickým M proteinem, proteinem F nebo FBP54, mimo jiné.Jakmile dojde k adherenci, streptokoky odolávají fagocytóze, proliferují a začínají napadat místní tkáně.
PLYN vykazuje obrovskou a vyvíjející se molekulární rozmanitost, která je poháněna horizontálním přenosem mezi různými kmeny. To platí také při srovnání s jinými streptokoky. Akvizice proroků představuje velkou část rozmanitosti a uděluje nejen virulenci prostřednictvím faktorů virulence spojené s fágem, ale také zvyšuje přežití bakterií proti obraně hostitele.
Extracelulární produkty a toxiny
Různé produkty extracelulárního růstu a toxiny produkované GAS jsou zodpovědné za poškození hostitelských buněk a zánětlivou reakci.
Hemolysiny
S pyogenes zpracovává 2 odlišné hemolysiny. Tyto proteiny jsou odpovědné za zónu hemolýzy pozorovanou na destičkách krevního agaru a jsou také důležité v patogenezi poškození tkáně infikovaného hostitele. Streptolysin O je toxický pro širokou škálu buněčných typů, včetně myokardu, a je vysoce imunogenní. Stanovení protilátkových odpovědí na tento protein (titr antistreptolysinu O) je často užitečné při serodiagnostice nedávné infekce.
Streptolysin S je dalším faktorem virulence schopným poškodit polymorfonukleární leukocyty a subcelulární organely. Na rozdíl od streptolysinu O se však nezdá být imunogenní.
Pyrogenní exotoxiny
Rodina streptokoků pyrogenní exotoxiny (SPE) zahrnují SPE A, B, C a F. Tyto toxiny jsou zodpovědné za vyrážku šarlachu. Mezi další patogenní účinky způsobené těmito látkami patří pyrogenicita, cytotoxicita a zvýšení citlivosti na endotoxin. SPE B je prekurzor cysteinové proteázy, další determinant virulence.
Streptokokové izoláty skupiny A spojené se streptokokovým TSS kódují určité SPE (tj. A, C, F) schopné fungovat jako superantigeny. Tyto antigeny indukují výraznou febrilní reakci, indukují proliferaci T lymfocytů a indukují syntézu a uvolňování více cytokinů, včetně faktoru nekrózy nádoru, interleukinu-1 beta a interleukinu-6. Tato aktivita je přičítána schopnosti superantigenu současně se vázat na oblast V-beta receptoru T-buněk a na hlavní histokompatibilní antigeny třídy II mononukleárních buněk prezentujících antigen, což vede k rozšířené, nespecifické proliferaci T-buněk a zvýšení produkce interleukinu-2.
Nukleázy
Čtyři antigenně odlišné nukleázy (A, B, C, D) pomáhají při zkapalňování hnisu a pomáhá vytvářet substrát pro růst.
Další produkty
Mezi další extracelulární produkty patří NADase (leukotoxický) , hyaluronidáza (která štěpí hostitelskou pojivovou tkáň, kyselinu hyaluronovou a vlastní kapsli organismu), streptokinázy (proteolytické) a streptodornáza AD (aktivita deoxyribonukleázy).
Proteináza, amyláza a esteráza jsou dalšími faktory streptokokové virulence, i když role těchto proteinů v patogenezi není plně objasněna.
Suppur spektrum ativních chorob
Streptokoková faryngitida
S pyogenes způsobuje až 15–30% případů akutní faryngitidy. Frankova choroba se vyskytuje na základě stupně bakteriální virulence po kolonizaci horních cest dýchacích. Pro správnou volbu antibiotik je nezbytná přesná diagnóza.
Impetigo
Pyoderma je nejčastější formou kožní infekce způsobené plynem . Také se označuje jako streptokokové impetigo nebo impetigo contagiosa, vyskytuje se nejčastěji v tropickém podnebí, ale může být vysoce převládající také v severním podnebí, zejména v letních měsících. Mezi rizikové faktory, které predisponují k této infekci, patří nízký socioekonomický status; nízká úroveň celkové hygieny; a lokální poranění kůže způsobené kousnutím hmyzem, svrabem, atopickou dermatitidou a menšími traumaty. Kolonizace neporušené kůže předchází rozvoji pyodermie přibližně o 10 dní.
Streptokoková pyodermie se může objevit u dětí patřících k určitým skupinám populace a v přeplněných ústavech. Způsoby přenosu jsou přímý kontakt, znečištění životního prostředí a mouchy domácí. Kmeny streptokoků, které způsobují pyodermu, se liší od kmenů, které způsobují exsudativní tonzilitidu.
Bakteriální toxiny způsobují proteolýzu epidermálních a subepidermálních vrstev, což umožňuje bakteriím rychle se šířit po vrstvách kůže a tím způsobit puchýře nebo hnisavé léze. Další častou příčinou impetiga je Staphylococcus aureus.
Pneumonie
Invazivní plyn může způsobit plicní infekci, často s rychlou progresí k nekrotizující pneumonii.
Nekrotizující fasciitida
Nekrotizující fasciitida je způsobena bakteriální invazí do podkožní tkáně s následným rozšířením povrchovou a hlubokou fascií letadla. Šíření GAS napomáhají bakteriální toxiny a enzymy (např. Lipáza, hyaluronidáza, kolagenáza, streptokináza), interakce mezi organismy (synergické infekce), místní tkáňové faktory (např. Snížený přísun krve a kyslíku) a obecné faktory hostitele (např. , imunokompromitovaný stav, chronické onemocnění, chirurgický zákrok).
Jak se infekce šíří hluboko po fasciálních rovinách, dochází k cévní okluzi, ischemii tkáně a nekróze. Ačkoli je plyn často izolován v případě nekrotizující fasciitidy, je tento chorobný stav často polymikrobiální.
Otitis media a sinusitida
Jedná se o běžné hnisavé komplikace streptokokové angíny. Jsou způsobeny šířením organismů eustachovou trubicí (zánět středního ucha) nebo přímým šířením do dutin (zánět vedlejších nosních dutin).
Nesuppurativní spektrum nemocí
Akutní revmatická horečka
ARF je opožděný, nehnisavý následek GAS tonsilofaryngitidy. Po faryngitidě uplyne latentní období 2-3 týdnů, než se objeví příznaky nebo příznaky ARF. Toto onemocnění se projevuje různými klinickými projevy, včetně artritidy, karditidy, chorey, podkožních uzlíků a erytému marginatum.
Revmatická horečka může být výsledkem genetické predispozice hostitele. Gen nemoci může být přenášen autosomálně dominantním způsobem nebo autosomálně recesivním způsobem s omezenou penetrací. Gen nemoci však dosud nebyl identifikován.
Značný důkaz podporuje souvislost mezi streptokokovými infekcemi horních cest dýchacích skupiny A a ARF, ačkoli existují pouze určité sérotypy skupiny M (tj. 1, 3, 5, 6, 18, 24) jsou spojeny s touto komplikací. Před výskytem revmatické horečky se v mnoha komunitách objevily velmi mukoidní kmeny, zejména kmeny typu M. Reumatická horečka je nejčastěji pozorována u dětí ve věku 5–15 let (věková skupina nejvíce náchylná k infekcím GAS).
Míra napadení po infekci horních cest dýchacích je přibližně 3% u jedinců s neléčenou nebo nedostatečně léčenou infekcí. Latentní období mezi GAS infekcí a nástupem revmatické horečky se pohybuje od 2 do 4 týdnů. Na rozdíl od poststreptokokové glomerulonefritidy (PSGN), která může následovat po faryngitidě nebo streptokokové pyodermii, může k revmatické horečce dojít až po infekci horních cest dýchacích.
Navzdory hloubce znalosti, které se nashromáždily o molekulární mikrobiologii Streptococcus pyogenes, zůstávají patogeneze ARF neznámé. Přímý účinek streptokokového extracelulárního toxinu, zejména streptolysinu O, může být podle některých hypotéz odpovědný za patogenezi ARF. Pozorování, že streptolysin O je na zvířecích modelech kardiotoxický, tuto hypotézu podporují, ale spojit tuto toxicitu s poškozením chlopní pozorovaným u ARF bylo obtížné.
Populárnější hypotézou je, že abnormální je odpovědná imunitní odpověď hostitele na určitou složku streptokoka skupiny A. M protein GAS sdílí určité aminokyselinové sekvence s některými lidskými tkáněmi a toto bylo navrženo jako zdroj zkřížené reaktivity mezi organismem a lidským hostitelem, který by mohl vést k imunopatologické imunitní odpovědi. Rovněž byla rozpoznána antigenní podobnost mezi skupinově specifickým polysacharidem S pyogenů a glykoproteiny nalezenými v lidských a hovězích srdečních chlopních a pacienti s ARF mají prodlouženou perzistenci těchto protilátek ve srovnání s kontrolami s nekomplikovanou faryngitidou. Zdá se, že jiné antigeny GAS zkříženě reagují s membránami srdečního sarkolemu.
V průběhu imunitní reakce hostitele na GAS se mohou antigeny hostitele v důsledku této molekulární mimikry mylně považovat za cizí; to vede k zánětlivé kaskádě s výsledným poškozením tkáně. U pacientů s ARF se Sydenhamovou choreou jsou přítomny běžné protilátky na antigeny nacházející se v buněčné membráně S pyogenes a v caudatovém jádru mozku, což dále podporuje koncept aberantní autoimunitní odpovědi ve vývoji ARF.
Zájem o to, zda tyto autoimunitní odpovědi hrají roli v patogenezi syndromu známého jako dětské autoimunitní neuropsychiatrické poruchy spojené se streptokokovými infekcemi (PANDAS), je značný, i když je třeba vyvinout další úsilí k prokázání souvislosti mezi streptokokové infekce a tyto syndromy.
Poststreptokoková glomerulonefritida
Glomerulonefritida může následovat streptokokovou infekci hltanu nebo kůže skupiny A a její výskyt se liší podle prevalence takzvaných nefritogenních kmenů streptokoků skupiny A v komunitě. Typ 12 je nejčastějším sérotypem M, který způsobuje PSGN po faryngitidě, a typ M 49 je sérotyp nejčastěji související s nefritidou spojenou s pyodermou. Latentní období mezi GAS infekcí a nástupem glomerulonefritidy se pohybuje od 1–2 týdnů.
Patogeneze se jeví jako imunologicky zprostředkovaná. Imunoglobuliny, složky komplementu a antigeny, které reagují se streptokokovým antisérem, jsou přítomny v glomerulu brzy v průběhu onemocnění a předpokládá se, že protilátky vyvolané nefritogenními streptokoky reagují s renální tkání takovým způsobem, že podporují poškození glomerulů. Na rozdíl od akutní revmatické horečky jsou recidivy PSGN vzácné. Diagnóza PSGN je založena na klinické anamnéze, nálezech fyzikálních vyšetření a potvrzujících důkazech nedávné streptokokové infekce.
Syndrom toxického šoku
S rostoucí frekvencí byly hlášeny závažné infekce plynem spojené se šokem a selháním orgánů. Převážně v Severní Americe a Evropě.
Mezi streptokokovou TSS a streptokokovou nekrotizující fasciitidou dochází ke značnému překrývání, pokud se většina případů vyskytuje ve spojení s infekcemi měkkých tkání. Streptokokový TSS se však může vyskytnout také ve spojení s jinými fokálními streptokokovými infekcemi, včetně faryngální infekce.
Patogeneze streptokokového TSS se zdá být částečně spojena se schopností určitých tj. A, C, F) streptokokové pyogenní exotoxiny (SPE), které fungují jako superantigeny.
Šarlatová horečka
Když na pozadí akutní streptokokové faryngitidy je přítomna jemná, difúzní, erytematózní vyrážka, nemoc se nazývá šarlach. Vyrážka na spálu je způsobena pyrogenními exotoxiny (tj. SPE A, B, C a F). Vyrážka velmi závisí na expresi toxinu; již existující humorální imunita vůči specifickému toxinu SPE zabraňuje klinickým projevům spálu.
Šarlatová horečka se zjevně stala méně častou a méně virulentní než v minulých desetiletích; výskyt je však cyklický, v závislosti na prevalenci kmenů produkujících toxiny a imunitním stavu populace. Způsoby přenosu, věkové rozdělení případů a další epidemiologické rysy jsou podobné jako u streptokokové faryngitidy.
Onemocnění centrální nervové soustavy
Primární důkaz pro poststreptokokové autoimunitní onemocnění centrálního nervového systému (CNS) je poskytováno studiemi Sydenham chorea, neurologického projevu revmatické horečky. Zprávy o obsedantně-kompulzivní poruše (OCD), tických poruchách a dalších neuropsychiatrických symptomech vyskytujících se ve spojení s beta-hemolytickými streptokokovými infekcemi skupiny A naznačují, že poststreptokoková autoimunita může vyvolat různé následky na CNS.