Maligní intravaskulární zánět
Sepse byla označována jako proces maligního intravaskulárního zánětu . Účinná, komplexní, imunologická kaskáda obvykle zajišťuje rychlou ochrannou reakci na invazi mikroorganismů u lidí. Nedostatečná imunologická obrana může umožnit vznik infekce; nadměrná nebo špatně regulovaná odpověď však může hostitele poškodit maladaptivním uvolňováním původních zánětlivých sloučenin (viz obrázek níže).
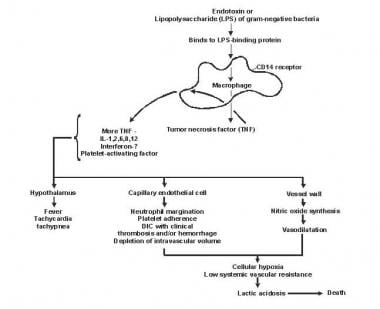 Patogeneze sepse a multiorgánového selhání.
Patogeneze sepse a multiorgánového selhání. Lipid A a další bakteriální produkty uvolňují cytokiny a další imunitní modulátory, které zprostředkovávají klinické projevy sepse. Interleukiny, tumor nekrotizující faktor (TNF) -α, interferon gama (IFN-γ) a další faktory stimulující kolonie se produkují rychle během několika minut nebo hodin po interakcích monocytů a makrofágů s lipidem A.
Uvolňování zánětlivých mediátorů se stává samo-stimulačním procesem a uvolňování dalších takových mediátorů, včetně interleukinu (IL) -1, faktoru aktivujícího trombocyty, IL-2, IL-6, IL-8, IL-10 a oxid dusnatý (NO), dále zvyšuje hladinu cytokinů. To vede k pokračující aktivaci polymorfonukleárních leukocytů (PMN), makrofágů a lymfocytů; prozánětlivé mediátory přijímají více těchto buněk. Všechny tyto procesy vytvářejí stav destruktivní imunologické disonance.
Sepsa je popsána jako autodestruktivní proces, který umožňuje rozšíření normální patofyziologické odpovědi na infekci, aby zahrnoval jinak normální tkáně a výsledky v MODS. Dysfunkce orgánů nebo selhání orgánů mohou být prvním klinickým příznakem sepse a žádný orgánový systém není imunní vůči následkům zánětlivých excesů sepse. Úmrtnost se zvyšuje se zvyšujícím se selháním orgánů.
Ačkoli je nekontrolovaný, jakmile MODS vyvine systémový důkaz prozánětlivé a protizánětlivé regulace, jsou obvykle přítomny, což naznačuje, že selhání homeostázy obrany hostitele je konečná cesta od sepse k MODS, spíše než jednoduché poškození koncového orgánu vyvolané hypotenzí, jak se může objevit při hemoragickém šoku. Přežití z těžké sepse s MODS je obvykle spojeno s obecným snížením prozánětlivé i protizánětlivé odpovědi.
Nedávno se objevila nová hypotéza, že přežití z těžké sepse vyžaduje generalizovaná down-regulace imunitní odpovědi těla, energetických funkcí a souvisejícího výkonu orgánů. MODS tedy může díky adaptivní reakci hostitele na zdrcující zánět umožnit jeho odstranění, aniž by došlo k trvalému poškození koncových orgánů. Jak je uvedeno níže, všechny orgány odhalují zobecněnou hyporesponzivitu, která je zjevně abnormální ve zdraví, ale může označovat strategii přežití u těžké sepse.
Dysfunkce orgánových systémů
Poruchy oběhu
Významné poruchy v autoregulaci oběhu jsou typické pro sepse. Vazoaktivní mediátory způsobují vazodilataci a zvyšují mikrovaskulární permeabilitu v místě infekce. NO hraje ústřední roli ve vazodilataci septického šoku. Může také dojít ke zhoršení sekrece vazopresinu, což může umožnit přetrvávání vazodilatace.
Ke změnám v systolickém a diastolickém komorovém výkonu dochází při sepse. Použitím Frank-Starlingova mechanismu se srdeční výdej často zvyšuje, aby se udržel krevní tlak v přítomnosti systémové vazodilatace. Pacienti s již existujícím srdečním onemocněním nejsou schopni odpovídajícím způsobem zvýšit srdeční výdej.
Regionálně sepse narušuje normální distribuci systémového průtoku krve do orgánových systémů. V důsledku toho nemusí základní orgány dostávat vhodný přísun kyslíku a výsledkem je takzvaná regionální hypoperfuze.
Mikrocirkulace je klíčovým cílovým orgánem pro poranění při sepse, protože vaskulární endotel je všeobecně ovlivněny cirkulujícími zánětlivými mediátory. I když není jasné, zda jsou mikrocirkulační abnormality příčinou nebo nevinným přihlížejícím k poranění koncového orgánu, je zjevná mikrovaskulární dysfunkce. Je vidět pokles počtu perfundovaných kapilár, i když při použití vazodilatačních terapií dochází k úplnému mikrovaskulárnímu náboru. Vyskytuje se také mitochondriální dysfunkce, která je často spojena se sníženými gradienty mitochondriálního transmembránového potenciálu, které jsou nezbytné pro řízení oxidační fosforylace. Konečným výsledkem je zjevná neschopnost koncových orgánů maximálně extrahovat kyslík.
Pokračuje debata o tom, zda je toto selhání energetického metabolismu adaptivním cytoprotektivním mechanismem podobným hibernaci nebo odráží primární mitochondriální patologii. Jedná se o oblasti aktivního výzkumu, ale v současné době se neprojevují v jasných pokynech klinické praxe. Zvýšená permeabilita kapilárního endotelu vede k rozsáhlému edému tkáně bohaté na bílkoviny.
Septický šok a SIRS jsou charakterizovány reverzibilní depresí myokardu, která se může ukázat jako rezistentní vůči podávání katecholaminu a tekutin. V patogenezi se podílí cirkulující „depresivní faktor myokardu“ – pravděpodobně představující synergické účinky TNF-α, IL-1β, jiných cytokinů a NO. Dvě charakteristiky této akutní stresové deprese myokardu jsou porucha adrenergní odezvy a diastolická dysfunkce vedoucí k relativní katecholaminová rezistence a spíše malé než rozšířené srdce. Makrovaskulární ischemie myokardu a hypoperfuze jsou nepravděpodobné.
U těžké sepse a septického šoku způsobují mikrocirkulační dysfunkce a mitochondriální deprese regionální tkáňové potíže, a regionální dysoxie proto přetrvává. Tento stav se nazývá mikrocirkulační a mitochondriální distresní syndrom (MMDS). Zánětlivá autoregulační dysfunkce vyvolaná sepse přetrvává a potřeba kyslíku se neshoduje s dodávkou, což vede k MODS.
Redistribuce objemu intravaskulární tekutiny vyplývající ze sníženého arteriálního vaskulárního tonusu, sníženého žilního návratu z venózního di uvolňování látek tlumících myokard způsobuje hypotenzi.
Plicní dysfunkce
Endoteliální poranění plicní vaskulatury vede k narušení průtok kapilární krve a zvýšená mikrovaskulární permeabilita, což vede k intersticiálnímu a alveolárnímu edému. Zachycení neutrofilů v plicní mikrocirkulaci iniciuje a zesiluje poškození alveolárních kapilárních membrán. Akutní poranění plic a syndrom akutní respirační tísně (ARDS) jsou častými projevy těchto účinků. Nejčastějšími příčinami ARDS jsou skutečně sepse a zápal plic.
Gastrointestinální dysfunkce
Gastrointestinální (GI) trakt může pomáhají šířit zranění sepse. Nadměrný růst bakterií v horním gastrointestinálním traktu může být odsáván do plic a produkovat nozokomiální nebo aspirační pneumonii. Může být ovlivněna normální bariérová funkce střeva, což umožňuje translokaci bakterií, endotoxinů a normálních trávicích proteáz do systémového oběhu a prodlužuje septickou reakci.
Septický šok může způsobit paralytický ileus, který může vést ke zpoždění při zahájení enterální výživy. Přebytečná produkce NO je považována za původce ileu vyvolaného sepsí. S ohledem na vysoké požadavky na bílkoviny a kalorie je narušena optimální úroveň příjmu výživy. Narkotika a myorelaxancia mohou dále zhoršovat pohyblivost GI traktu.
Dysfunkce jater
V důsledku role, kterou játra hrají v obraně hostitele mohou abnormální syntetické funkce způsobené dysfunkcí jater přispívat jak k zahájení, tak k progresi sepse. Retikuloendoteliální systém jater působí jako první obranná linie při odstraňování bakterií a jejich produktů; dysfunkce jater vede k přelévání těchto produktů do systémového oběhu.
Selhání jater („šokovaná játra“) se může projevit zvýšením jaterních enzymů a bilirubinu, poruchami srážlivosti a selhání vylučování toxinů, jako je amoniak, které vede ke zhoršení encefalopatie.
Porucha funkce ledvin
Akutní poškození ledvin (AKI) sepse často doprovází. Byly hlášeny různé etiologie AKI a příčina se obvykle považuje za multifaktoriální. Mechanismus AKI je složitý, ale pravděpodobně zahrnuje snížení účinného intravaskulárního objemu v důsledku systémové hypotenze, přímé vazokonstrikce ledvin, uvolňování cytokinů, a aktivace neutrofilů endotoxiny a jinými peptidy, které přispívají k poškození ledvin. Většina studií na zvířatech přesto ukazuje, že průtok krve ledvinami je při sepse zvýšen, nikoli snížen, i když je spojen se zhoršenou tubulární funkcí a nedostatkem významných histologických důkazů o poranění blán.
Dysfunkce centrálního nervového systému
Zapojení centrálního nervového systému (CNS) do sepse produkuje encefalopatii a periferní neuropatie. Patogeneze je špatně definována, ale pravděpodobně souvisí se systémovou hypotenzí, která může vést k hypoperfuzi mozku.
Koagulopatie
Subklinická koagulopatie signalizovaná mírným zvýšením trombinového času (TT) nebo aktivovaným parciálním tromboplastinovým časem (aPTT) nebo mírným snížením počet krevních destiček, je extrémně běžný; může se však také objevit zjevná diseminovaná intravaskulární koagulace (DIC). Receptory aktivované proteázou (PAR), zejména PAR 1, tvoří molekulární vazbu mezi koagulací a zánětem; PAR1 má cytoprotektivní účinky, když je stimulován aktivovaným proteinem C nebo nízkým dávkováním trombinu, ale působí rušivě na bariérovou funkci endoteliálních buněk, je-li aktivován vysokými dávkami trombinu.
Mechanismy orgánové dysfunkce a poranění
Přesné mechanismy poškození buněk a výsledné orgánové dysfunkce při sepse nejsou plně pochopeny. MODS je spojena s rozšířeným poškozením endoteliálních a parenchymálních buněk, z nichž některé lze vysvětlit následujícími 4 navrženými mechanismy.
Hypoxická hypoxie
Septická oběhová léze narušuje okysličení tkání, mění metabolickou regulaci dodávky kyslíku do tkání a přispívá k dysfunkci orgánů. Mikrovaskulární a endoteliální abnormality přispívají k septickému mikrocirkulačnímu defektu sepse. Reaktivní formy kyslíku, lytické enzymy a vazoaktivní látky (např. NO a endoteliální růstové faktory) vedou k mikrocirkulačnímu poškození, které je umocněno neschopností erytrocytů orientovat se v septické mikrocirkulaci.
Přímá cytotoxicita
Endotoxin, TNF-α a NO mohou způsobit poškození mitochondriálního přenosu elektronů, což vede k neuspořádanému energetickému metabolismu. Říká se tomu cytopatická nebo histotoxická anoxie, neschopnost využívat kyslík, i když je přítomen.
Apoptóza
Apoptóza ( programovaná buněčná smrt) je hlavním mechanismem, kterým jsou dysfunkční buňky normálně eliminovány. Prozánětlivé cytokiny mohou oddálit apoptózu v aktivovaných makrofágech a neutrofilech, ale urychlenou apoptózu mohou podstoupit i jiné tkáně (např. Střevní epitel). Proto poškození apoptózy hraje při poranění sepse kritickou roli.
Imunosuprese
Interakce mezi prozánětlivými a protizánětlivé mediátory mohou vést k nerovnováze mezi nimi. Může převládat zánětlivá reakce nebo imunodeficience, nebo mohou být přítomny obě.
Odezva hostitele a další faktory ovlivňující výsledek
Klinické charakteristiky, které souvisejí se závažností mezi sepse patří reakce hostitele na infekci, místo a typ infekce, načasování a typ antimikrobiální terapie, organizmus, který se provinil, vývoj šoku, základní onemocnění, dlouhodobý zdravotní stav pacienta a počet neúspěšných orgány. Faktory, které vedou k sepse a septickému šoku, nemusí být při určování konečného výsledku nezbytné.
Odpověď hostitele na sepsi je charakterizována jak prozánětlivými odpověďmi, tak protizánětlivými imunosupresivními odpověďmi. Směr, rozsah a trvání těchto reakcí jsou určeny jak hostitelskými faktory (např. Genetickými charakteristikami, věkem, koexistujícími chorobami, léky), tak patogenními faktory (např. Mikrobiální zátěž, virulence).
Zánětlivé reakce jsou iniciovány interakcí mezi patogenem asociovanými molekulárními vzory exprimovanými patogeny a receptory pro rozpoznávání vzorů exprimovanými hostitelskými buňkami na buněčném povrchu (mýtné receptory a C-typ lektinové receptory), v endosomu (TLR) nebo v cytoplazmě (receptory podobné genu 1 indukovatelné kyselinou retinovou a receptory podobné oligomerační doméně vázající nukleotidy).
Důsledkem přehnaného zánětu je poškození kolaterální tkáně a nekrotická buněčná smrt, která vede k uvolnění molekulárních vzorů spojených s poškozením, tzv. nebezpečných molekul, které alespoň udržují zánět částečně působením na stejné receptory rozpoznávání vzorů vyvolané patogeny.