US Pharm. 2013; 38 (11) (Onkologinen lisäys): 3-6.
TIIVISTELMÄ: Anemia on yleinen komplikaatio syöpää sairastavilla potilailla. Sen voi aiheuttaa joko itse kasvain tai käytetty kemoterapeuttinen hoito. Ehtojen vakavuus ja esiintyvyys vaihtelevat useiden tekijöiden perusteella. Hoidon tarkoituksena on lisätä veren happikantokykyä, vähentää väsymystä ja parantaa potilaan yleistä elämänlaatua. Erytropoieesia stimuloivia aineita, raudan lisäystä ja punasolujen verensiirtoja on suositeltu eri asetuksissa. Vaikka jotkut potilaat ovat osoittautuneet hyödyllisiksi joillekin potilaille, optimaalista terapeuttista modaalisuutta ei ole vielä vahvistettu.
Anemia on syöpäpotilaiden suurin sairastavuuden syy, joka liittyy heikkoon fyysiseen suorituskykyyn, ennusteeseen ja terapeuttiseen tulokseen .1 Maailman terveysjärjestön ( WHO) anemia määritellään hemoglobiinitasoksi (Hb) < 12 g / dl raskaana oleville naisille ja < 13 g / dl ≥ 15-vuotiailla miehillä.2
Epidemiologia
Anemia on yksi yleisimmistä ilmenemismuotoista syöpää sairastavilla potilailla. Itse asiassa on osoitettu, että 30-90% kaikista syöpäpotilaista on aneemisia, luku riippuu syöpätyypistä ja käytetystä anemian määritelmästä.3 Anemian esiintyvyys ja vakavuus riippuvat useista tekijöistä, jotka on lueteltu taulukossa 1.4,5

Etiologia
Syöpäpotilaiden pääasiallinen anemian syy on kaksi: itse syöpä ja syövän hoitoon käytetty hoito. Luuytimeen tunkeutuvat syöpäsolut voivat suoraan tukahduttaa hematopoieesin ja aiheuttaa anemiaa. Lisäksi syöpäsolut vapauttavat sytokiinit, jotka voivat johtaa raudan sitomiseen, mikä vähentää punasolujen (RBC) tuotantoa. Kasvaimet voivat johtaa krooniseen veren menetykseen kasvainkohdasta, mikä johtaa etenevään anemiaan syövästä ja organdamageista.6
Tätä ongelmaa täydentävät verihäviöt, ravitsemukselliset puutteet, hemolyysi, hormonaaliset häiriöt, perinnöllinen sairaus, munuaisten vajaatoiminta tai syöpään ja krooniseen sairauteen liittyvien tulehduksellisten sytokiinien esiintyminen. 4,6 Syöpäpotilaat yleensä menettävät ruokahalunsa, mikä johtaa ravitsemuksellisiin puutteisiin. Ruoansulatuskanavan (GI) kasvaimia sairastavilla potilailla ravinteiden imeytymishäiriö johtaa myös puutteisiin. Hemolyysi johtuu immuunivälitteisistä vasta-aineista tai hyytymiskyvyn muutoksista. Tämän seurauksena anemia on yleinen sairaus potilailla, joilla on äskettäin diagnosoitu syöpä. Lähes puolella potilaista, joilla on diagnosoitu gynekologinen syöpä, ja kolmanneksella potilaista, joilla on diagnosoitu non-Hodgkin-lymfooma, on diagnoosin yhteydessä anemia.
Lisäksi myelosuppressio on yksi kemoterapian sivuvaikutuksista ja merkittävä anemian tekijä. . Varsinkin luuston sädehoito aiheuttaa myös hematologista toksisuutta ja siten anemiaa. 6
Oireet
Yleisimmät anemian oireet ovat väsymys, hengenahdistus, sydämentykytys, masennus, sydämen vajaatoiminta, kognitiivisen toiminnan heikentyminen. toiminta, huimaus ja sydämen vajaatoiminta. 7,8
Diagnoosi
Anemiaongelman laajuus syöpäpotilailla lisääntyy epäoptimaalisilla diagnostisilla toimenpiteillä, standardimääritelmän puuttumisella ja tosiasia, että syy on usein monitekijäinen. 6,9 Yksityiskohtainen historia, joka tallentaa oireiden keston ja ajan, siihen liittyvien sairauksien esiintymisen, sukututkimuksen sekä antineoplastisille lääkkeille ja säteilylle altistumisen historian. Fyysinen tutkimus pyörtymisen, liikunnan hengenahdistuksen, päänsäryn, huimaus, rintakipu, uupumus, poikkeavat kuukautiset naisilla ja halvaus on tarkistettava. 6
Kansallinen syövän kattava verkosto suosittelee aCBC: n suorittamista potilaille, joilla on Hb < 11 g / dl tai Hb-määrän väheneminen 2 g / dl. Tämä on hyödyllistä määritettäessä, esiintyvätkö sytopeniat. Perifeerisen veren tahran visuaalinen tarkastelu punasolujen kokojen, muodon ja värin vahvistamiseksi on myös suositeltava. 6
Patofysiologia
Anemia on seurausta vähentyneiden verenkierrossa olevien erytrosyyttien yhdistelmästä , pienentynyt solutilavuus ja alentuneet Hb-tasot.6 Tämä voi tapahtua erilaisilla patofysiologisilla mekanismeilla, mukaan lukien liiallinen veren menetys, lisääntynyt punasolujen tuhoutuminen ja vähentynyt erytropoieesi. rauta on välttämätöntä erytropoieesille. Erytropoietiini kontrolloi erytroidisolujen kyllästymistä, erilaistumista ja eloonjäämistä tämän prosessin aikana. 10 EPO: ta tuottaa pääasiassa munuaiset ja se kulkeutuu luuytimeen.11
Epänormaali raudan metabolia tai raudan pidättyminen makrofageissa vähentää rauta, jota on saatavana erytropoieesissa.Raudan muuttunut aineenvaihdunta johtuu pääasiassa hepidiinistä, proteiinista, joka vähentää raudan imeytymistä suolistossa ja raudan vapautumista makrofageista. Hepsidiinin lisääntymistä lisäävät kasvaimista vapautuneet sytokiinit, mikä vähentää kiertävän raudan määrää. On myös todettu, että tietyt kemoterapeuttiset hoidot lisäävät sytokiinien, kuten interleukiini (IL) -6: n, tuotantoa.5 Toistuvat kemoterapiasyklit voivat pahentaa erytropoieesin vähenemistä kumulatiivisesti.7
Kun hapen kulkeutuminen vähenee, kehon kudossoluista tulee hypoksisia, mikä johtaa sarjaan fysiologisia reaktioita, kun keho yrittää saada aikaan tai ylläpitää kudosten hapetusta.
Uskotaan, että rauta-syöpäpotilaiden normaali käyttö voidaan keskeyttää kasvainsolujen välisellä vuorovaikutuksella ja isännän oma immuunijärjestelmä. Tämä vuorovaikutus johtaa spesifisten tulehdussytokiinien, kuten IL-1, gammainterferoni ja tuumorinekroositekijä alfa (TNF-a), säätelyyn, mikä vähentää erytroidien esiasteiden erilaistumista luuytimessä, häiritsee normaalia raudan käyttöä ja estää normaalia hypoksiaa. ajettu erytropoietiinin tuotanto. Nefrotoksiset kemoterapeuttiset aineet saattavat pahentaa ongelmaa aiheuttamalla munuaisten vajaatoimintaa.
Kroonisessa anemiassa kasvainten on osoitettu vapauttavan ananemiaa indusoivan tekijän, molekyylin, joka lyhentää erytrosyyttien elinikää. Tämä pahentaa anemiaa siihen pisteeseen, että punasolut eivät pysty kompensoimaan punasolujen huonompaa eloonjäämistä. 12
Syövän anemian riskitekijät
Seuraavat syöpäanemian riskitekijät on tunnistettu
- Myelosuppressiivinen kemoterapia tai sädehoito
- Alhaiset Hb-tasot (10–12 g / dl) sytotoksisen kemoterapian alkaessa
- platinaa sisältää myös hoito-ohjelmia, mikä myös lisää tarvetta verensiirtoon.
Hoito
Potilaan elämänlaadun yleisen parantamisen lisäksi anemian hoito on välttämätöntä useille Anemia vaarantaa riittävän määrän happea kaikkien solujen, myös tuumorisolujen, kuljetuksessa.7 Koska kudosten matala hapettuminen liittyy tuumoreiden heikentyneeseen herkkyyteen säteilylle ja muille kemoterapiamuotoille, näiden hoitojen tehokkuus vähenee anemiassa.13,14
Hoidon tavoitteena tulisi olla happikantoriinin määrän lisääminen g kapasiteetti veressä ja hoitaa taustalla oleva syy. Taustalla olevat olosuhteet, kuten ravitsemukselliset puutteet, ovat helpompia hoitaa kuin muut, kuten piilevän veren menetys. Useita vaihtoehtoja, jotka ovat käytettävissä anemiaa sairastavien syöpäpotilaiden hoidossa. Nämä sisältävät15:
- Sopiva lisähoito foolihapolla ja / tai B12-vitamiinilla ravitsemuksellisten puutteiden korjaamiseksi
- Erytropoieesia stimuloivat aineet (ESA)
- Rautalisäaine
- verensiirrot, jotka on tarkoitettu potilaille, joilla on akuutti vaikea verenhukka. Potilailla, joiden anemia on krooninen, suositellaan erytropoieettisia aineita.
Erytropoieesia stimuloivat aineet: ESA: t, mukaan lukien rekombinantti ihmisen erytropoietiini alfa (rHuEPO; Procrit, Epogen) ja darbepoetiini alfa (Aranesp), olivat perinteisesti kehitetty anemian hoito potilailla, joilla on krooninen munuaisten vajaatoiminta. Heillä on samanlainen tehokkuus ja rajoitukset käytettäessä vertailukelpoisia annoksia anemiaa sairastavilla syöpäpotilailla. 5 ESA: ta on tarkoitettu sellaisten potilaiden hoitoon, joiden endogeenisen EPO-tason alue on epätavallisen matala, koska ESA: n toimintatapa ja immunologiset ja hematologiset vaikutukset ovat samanlaisia kuin endogeenisen EPO: n. rHuEPO: lla tehdyt tutkimukset ovat osoittaneet, että se parantaa potilaiden H-tasoja ja elämänlaatua ja vähentää verensiirtovaatimuksia. 15,16 On ehdotettu, että ESA: t parantavat myös kemoterapiaa saavien potilaiden kognitiivista toimintaa. 17
Systeeminen katsaus American Cancer Societyn suorittama tutkimus osoitti, että optimaalinen kliininen hyöty kemoterapian aiheuttaman anemian erytropoieettisesta hoidosta voidaan saavuttaa varhaisella interventiolla.18 ESA: iden käytöstä on selvästi hyötyä; kaikki muut anemian syyt on kuitenkin tutkittava ja korjattava ennen ESAterapian käyttöä.
Darbepoetiini ja rHuEPO ovat molemmat tarkoitettu anemian hoitoon potilaille, joilla ei-myelooinen pahanlaatuisuus whomanemiassa liittyy kemoterapiaan.5 American Society of Hematology (ASH) ja American Society of Clinical Oncology (ASCO) suosittelevat hoidon aloittamista, kun Hb-tasot putoavat alle 10 g / dLand annosta pienennetään, jos Hblevelissä on vähintään 1 g / dl lisäys 2 viikkoa.19 Hoidon tavoitteena tulee olla Hb: n nostaminen pienimpään pitoisuuteen verensiirron välttämiseksi. Jos Hb: n vähäistä kasvua 1-2 g / dl ei saavuteta 6–8 viikon hoidon jälkeen, ESA-hoito on lopetettava.18 Vaikka potilaan vastetta näihin hoitoihin on vaikea ennustaa nykyisillä tiedoilla, on osoitettu, että noin 50-60% potilaista osoittaa Hb: n nousun 2 g / dl rHuEPO: lla hoidettaessa. 9 ESA-hoito tulisi lopettaa hoidon päättymisen jälkeen. kemoterapiakurssi. 20,21
Darbepoetiini alfan suositeltu annos on 2,25 mikrog / kg viikoittaisena ihonalaisena injektiona. Jos Hb-tasot eivät nouse vähintään 1 g / dl 6 viikon kuluttua, annos tulisi nostaa 4,5 mikrogrammaan / kg. Jos Hb-pitoisuus nousee yli 1 g / dl kahden viikon aikana tai jos Hb ylittää 12 g / dl, darbepoetiinin annosta tulisi pienentää 40% .20 Darbepoetin-hoito tulee lopettaa, jos Hb-taso nousee yli 13 g / dl. 9
Suositeltava rHuEPO-annos on 40 000 U annettuna SC kerran viikossa tai 150 U / kg annettuna SC kolme kertaa viikossa potilailla, joiden Hb-taso on alle 10 g / dl. RHuEPO-annosta tulisi pienentää 25%, jos Hb-taso nousee > 1 g / dl millä tahansa kahden viikon jaksolla tai saavuttaa tason, joka tarvitaan punasolujen verensiirron välttämiseksi.21
ESA: t on pakattu injektiopulloon, jota ei saa ravistaa, koska ne denaturoituvat. 20,21 Injektiopullon sisältöä ei tule laimentaa tai yhdistää.
ESA-hoidon riskejä on myös vähennettävä. otettu harkintaan. ESA: n uskotaan lisäävän haitallisia sydän- ja verisuonitapahtumia, lisäävän laskimotromboembolian riskiä, lyhentävän kasvaimen etenemisaikaa ja vähentävän aneemista syöpäpotilaiden eloonjäämistä erilaisten mekanismien avulla. 22,23 Tästä syystä ESAsis-valmisteen käyttöä ei suositella syöpäpotilaille, joille ei ole tehty hoito kemoterapialla tai sädehoidolla.24 Kaikissa ESA: eissa on blackbox-varoitus kuoleman, sydäninfarktin, aivohalvauksen, laskimotromboembolian, verisuonten pääsyn tromboosin sekä kasvaimen etenemisen ja uusiutumisen riskin lisäämisestä. 20,21 ESA APPRISE OncologyProgram on perustanut FDA neuvoo potilaita, hoitajia ja terveydenhuollon ammattilaisia ESA: n turvallisessa käytössä. 25
Raudan lisäys: Raudan lisäaine, mieluiten parenteraalisesti, on tarkoitettu potilaille, joilla on alhainen tarjousarvo (< 30 ng / ml), transferriinisaturaatio (TSAT < 15%) ja matala (< 26 pg / solu) ) retikulosyyttien Hb-pitoisuus t (CHr). Aneemista syöpää sairastavilla potilailla on tunnistettu kahden tyyppinen irondeficiteetti:
- Absoluuttinen raudan puute (AID), jota esiintyy kroonisen verenvuodon yhteydessä esimerkiksi ruoansulatuskanavan tai gynekologisten vaurioiden, veren menetys leikkauksesta, ravitsemuksellinen kroonisen sairauden anemia (ACD). Se määritellään seerumin ferritiinitasoksi < 30 mcg / l ja alentuneeksi TSAT-arvoksi < 15% .1
- Funktionaalinen raudan puute (FID), joka syntyy erytropoietiinin käytön jatkamisen jälkeen. Se on yleisin syy riittämättömään vasteeseen ESA-hoitoon, erityisesti munuaisten vajaatoimintaa sairastavilla potilailla. Siksi useimmat ESA-hoitoa saaneet potilaat tarvitsevat lopulta rautalisää. 6
Raudan lisäys otettiin käyttöön, kun ESA-hoito yksin osoitti huonoja vasteprosentteja solunsalpaajahoitoa saaneilla potilailla. rauta- ja ESA-hoito testattiin ja raudan rooli toiminnallisessa raudan puutteessa todettiin.1 Vaikka nykyiset todisteet tukevat IV-raudan lisäaineen käyttöä hemoglobiinivasteen parantamiseksi syöpäpotilailla, IV-raudan pitkän aikavälin tehokkuudesta ja turvallisuudesta on tehtävä ennakkotutkimuksia. Lisäksi on määritettävä optimaaliset annostusohjelmat. 5
Rautaa voidaan antaa suun kautta tai parenteraalisesti pienimolekyylipainoisen (LMW) rautadekstraanin, ferriglukonaatin ja rautasakkaroosin formulaatioina. Parenteraalisesti annetulla raudalla on ylivaste verrattuna oraaliseen rautaan.6 Viimeksi mainittua käytetään siksi harvoin anemiaa sairastavilla syöpäpotilailla, eikä sitä käsitellä tässä artikkelissa. Rautadekstraanille suositellaan testiannoksia. Potilaille, joilla on aikaisemmin ollut herkkyyttä rautadekstraanille tai muille IV-rautavalmisteille, tai potilaille, joilla on useita lääkeallergioita, tulisi antaa myös testiannos. TAULUKKO 2 näyttää laskimonsisäisen raudan annostelun annosteluohjelman. 6
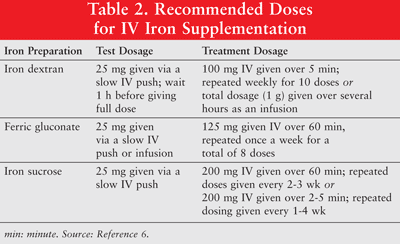
Parenteraaliseen rautaan liittyy hypotensio, pahoinvointi, oksentelu ja / tai ripuli, kipu, hypertensio, hengenahdistus, kutina, päänsärky ja huimaus. Lisäksi se voi olla hankalaa annostella ja kallista.9 Koska suurmolekyylipainoinen (HMW) rautadekstraaniin liittyy enemmän haittatapahtumia kuin LMW-rautadekstraaniin, jälkimmäinen on yleisesti suositeltava. 6
Punainen Verisolujensiirto: Punasolut ovat suositeltavia verituotteita verensiirroille anemian korjaamiseksi akuutissa anemiassa verenvuodon jälkeen. Jotkut potilaat saattavat tarvita infuusion, joka on sytomegaloviruksen negatiivinen.Punasolujen verensiirron tarkoituksena on hoitaa tai estää veren hapenkantokyvyn puute, eikä verensiirtoa yleensä ilmoiteta, jos potilaan H-taso on ≥10 g / dl. 6
Punasolujensiirrot tarjoavat Hb- ja hematokriittitasojen nopean nousun etuna heti infuusion jälkeen. On arvioitu, että 300 ml: n (1 yksikkö) puhtaiden punasolujen verensiirto johtaa keskimääräisen 1 g / dl Hb: n tai 3% hematokriitin lisääntymiseen muulla tavanomaisella aikuisella, jolla ei ole samanaikaista veren menetystä. Tämä johtaa väsymyksen yleiseen nopeaan parantumiseen. 6
Potilaan veri on sovitettava ristiin ABO-yhteensopivuuden suhteen ennen punasolujen siirtämistä. Jos potilas tarvitsee toistuvia infuusioita, haittavaikutusten riski voidaan minimoida käyttämällä leukosyyttejä vähentävää verta ja esilääkitystä anantihistamiinilla tai asetaminofeenilla. aineet, verensiirtoreaktiot, alloimmunisointi ja immunosuppressio.9 Muita verensiirron riskejä ovat kongestiivinen sydämen vajaatoiminta, lisääntyneet tromboottiset tapahtumat ja raudan ylikuormitus. kokemus raudan ylikuormituksesta. 6
Tulevaisuuden näkymät
Uusia strategioita syöpäpotilaiden anemian hallitsemiseksi toteutetaan parhaillaan. Vaikka ihmisverellä ei ole mitään korviketta, tutkijat ovat parhaillaan kehittämässä tuotteita, joilla on punasolujen happikantokyky. Valmistelussa ovat Hb-pohjaiset happikantajat ja perfluorihiilivedyt.5
Johtopäätös
Kaiken kaikkiaan optimaalista lähestymistapaa anemiaan onkologian tärkeänä aineena on vielä vahvistamatta. Terveydenhuollon tarjoajien välisen johdonmukaisuuden puute, syövän anemian selkeä määrittely ja diagnosointikriteerit edistävät tätä ongelmaa.
1. Steinmetz HT. Laskimonsisäisen raudan rooli syöpäpotilaiden anemian hoidossa. Ther Adv Hematol. 2012; 3: 177-191.
2. deBenoist B, McLean E, Egli I et ai. Anemian maailmanlaajuinen esiintyvyys 1993–2005: WHO: n maailmanlaajuinen anemia. Geneve, Sveitsi: Maailman terveysjärjestö; 2008.
3. Knight K, Wade S, Balducci L.Anemian esiintyvyys ja tulokset syövässä: järjestelmällinen katsaus kirjallisuuteen. Olen J Med. 2004; 116 (lisäys 7A): 11S-26S.
4. Schwartz RN. Anemia syöpäpotilailla: ilmaantuvuus, syyt, vaikutus, hoito ja hoito-ohjeiden ja -protokollien käyttö. Olen J Health Syst Pharm. 2007; 64 (3 täydennys 2): S5-S13; tietokilpailu S28-S30.
5. Calabrich A, Katz A.Anemian hallinta syöpäpotilailla. Tuleva Oncol. 2011; 7: 507-517.
6. Rodgers GM, Becker P, Blinder M et ai. Syöpä- ja kemoterapian aiheuttama anemia. J Natl Comp Canc Canc. 2012; 10: 628-653.
7. Groopman JE, Itri LM. Kemoterapian aiheuttama anemia aikuisilla: ilmaantuvuus ja hoito. J Natl Cancer Inst. 1999; 91: 1616-1634.
8. Ludwig H, Strasser K.Anemian oireet. Seminaari Oncol. 2001; 28: 7-14.
9. Gillespie TW. Anemia syövässä. Syöpähoito. 2003; 26: 119-128.
10. Koeller JM. Kliiniset ohjeet syöpään liittyvän anemian hoidossa. Lääkehoito. 1998; 18: 156-169.
11. Cazzola M, Mercuriali F, Brugnara C.Rekombinantin ihmisen erytropoietiinin käyttö uremian ulkopuolella. Veri. 1997; 89: 424-867.
12. Nowrousian MR, Kasper C, Oberhoff C, et ai.Syöpään liittyvän anemian patofysiologia. Julkaisussa: Smith JF, Boogaerts MA, Ehmer B, toim. Erytropoietiini syöpää tukevassa hoidossa. New York, NY: Marcel Dekker; 1997: 13-34.
13. Vaupel P, Dunst J, Engert A, et ai. Rekombinantin ihmisen erytropoietiinin (rHuEPO) vaikutukset kasvaimen hallintaan potilailla, joilla on syövän aiheuttama anemia. Onkologie. 2005; 28: 216-221.
14. Zhao KL, Liu G, Jiang GL et ai. Hemoglobiinitason yhdistäminen sädehoitoa saavien potilaiden, joilla on paikallisesti edennyt ruokatorven karsinooma, sairastuvuuteen ja kuolleisuuteen – kolmen peräkkäisen kliinisen vaiheen III tutkimuksen toissijainen analyysi. Clin Oncol (R Coll Radiol). 2006; 18: 621-627.
15. Glaspy JA. Punasolujen kehittyminen onkologiassa. Asiantuntijalausunto Emergency Drugs. 2005; 10: 553-567.
16. Adamson JW, Spivak JL. Fysiologinen perusta rekombinantin ihmisen erytropoietiinin farmakologiselle käytölle leikkauksessa ja syöpähoidossa. Leikkaus. 1994; 115: 7-15.
17. Ferrario E, Ferrari L, Bidoli P et ai. Syöpään liittyvän anemian hoito epoetiini alfalla: katsaus. Cancer Treat Rev. 2004; 30: 563-575.
18. Lyman GH, Glaspy J.Ovatko kliiniset hyödyt varhaisen erytropoieettisen intervention yhteydessä kemoterapian aiheuttamaan anemiaan? Asystemaattinen tarkastelu. Syöpä. 2006; 106: 223-233.
19. Rizzo JD, Brouwers M, Hurley P et ai. AmericanSociety of Clinical Oncology / American Society of Hematology kliinisen käytännön ohje päivitys epoetiinin ja darbepoetiinin käytöstä aikuisilla syöpäpotilailla. J Clin Oncol. 2010; 28: 4996-5010.
20. Aranesp (darbepoetiini alfa) lääkemääräykset.Thousand Oaks, Kalifornia: Amgen Inc; Toukokuu 2012.
21. Procrit (epoetiini alfa) lääkemääräykset. Horsham, PA: Janssen Products, LP; Heinäkuu 2012.
22. Beutel G, Ganser A.Punasolujen stimuloivien aineiden riskit ja edut syövän hoidossa. Semin Hematol. 2007; 44: 157-165.
23. Fenner MH, Ganser A.Erythropoietin syöpään liittyvässä anemiassa. Curr Opin Oncol. 2008; 20: 685-689.
24. Smith RE Jr, Aapro MS, Ludwig H et ai. Darbepoetinalfa anemian hoitoon aktiivista syöpää sairastavilla potilailla, jotka eivät saa kemoterapiaa tai sädehoitoa: vaiheen III, monikeskustutkimuksen, satunnaistetun, kaksoissokkoutetun, lumekontrolloidun tutkimuksen tulokset. J Clin Oncol. 2008; 26: 1040-1050.
25. ESA APPRISE onkologiaohjelma. Amgen ja Janssen Products, LP. www.esa-apprise.com. Pääsy 13. lokakuuta 2013.