Höyrynpaineen lasku
Kuten nesteitä ja kiintoaineita käsittelevässä luvussa kuvataan, nesteen tasapainohöyrynpaine on sen kaasumaisen paineen. vaihe, kun höyrystymistä ja kondensoitumista tapahtuu yhtä nopeasti:
\ text {liquid} \ rightleftharpoons \ text {gas}
Haihtumattoman aineen liuottaminen haihtuvassa nesteessä johtaa nesteen höyrynpaineen laskuun. Tämä ilmiö voidaan järkeistää ottamalla huomioon lisättyjen liuenneiden molekyylien vaikutus nesteen höyrystymis- ja kondensaatioprosesseihin. Höyrystämiseksi liuottimen molekyylien on oltava läsnä liuoksen pinnalla. Liuotetun aineen läsnäolo vähentää liuotinmolekyylien käytettävissä olevaa pinta-alaa ja vähentää siten liuottimen höyrystymisnopeutta. Koska liuenneen aineen läsnäolo ei vaikuta kondensaationopeuteen, nettotuloksena on, että höyrystymis-kondensaatiotasapaino saavutetaan vähemmällä liuotinmolekyylillä höyryfaasissa (ts. Pienemmällä höyrynpaineella) (kuva 1). Vaikka tämä kineettinen tulkinta on hyödyllinen, se ei ota huomioon useita tärkeitä näkökohtia höyrynpaineen alentamisen kolligatiivisesta luonteesta. Tarkempi selitys liittyy entropian ominaisuuteen, joka on keskustelunaihe myöhemmässä termodynamiikkaa käsittelevässä tekstiluvussa. Nesteen höyrynpaineen alenemisen ymmärtämiseksi on riittävää huomata, että liuoksen suurempi entropia verrattuna sen erilliseen liuottimeen ja liuenneeseen aineeseen stabiloi tehokkaasti liuotinmolekyylit ja estää niiden höyrystymistä. Tuloksena on matalampi höyrynpaine ja vastaavasti korkeampi kiehumispiste tämän moduulin seuraavassa osassa kuvatulla tavalla.
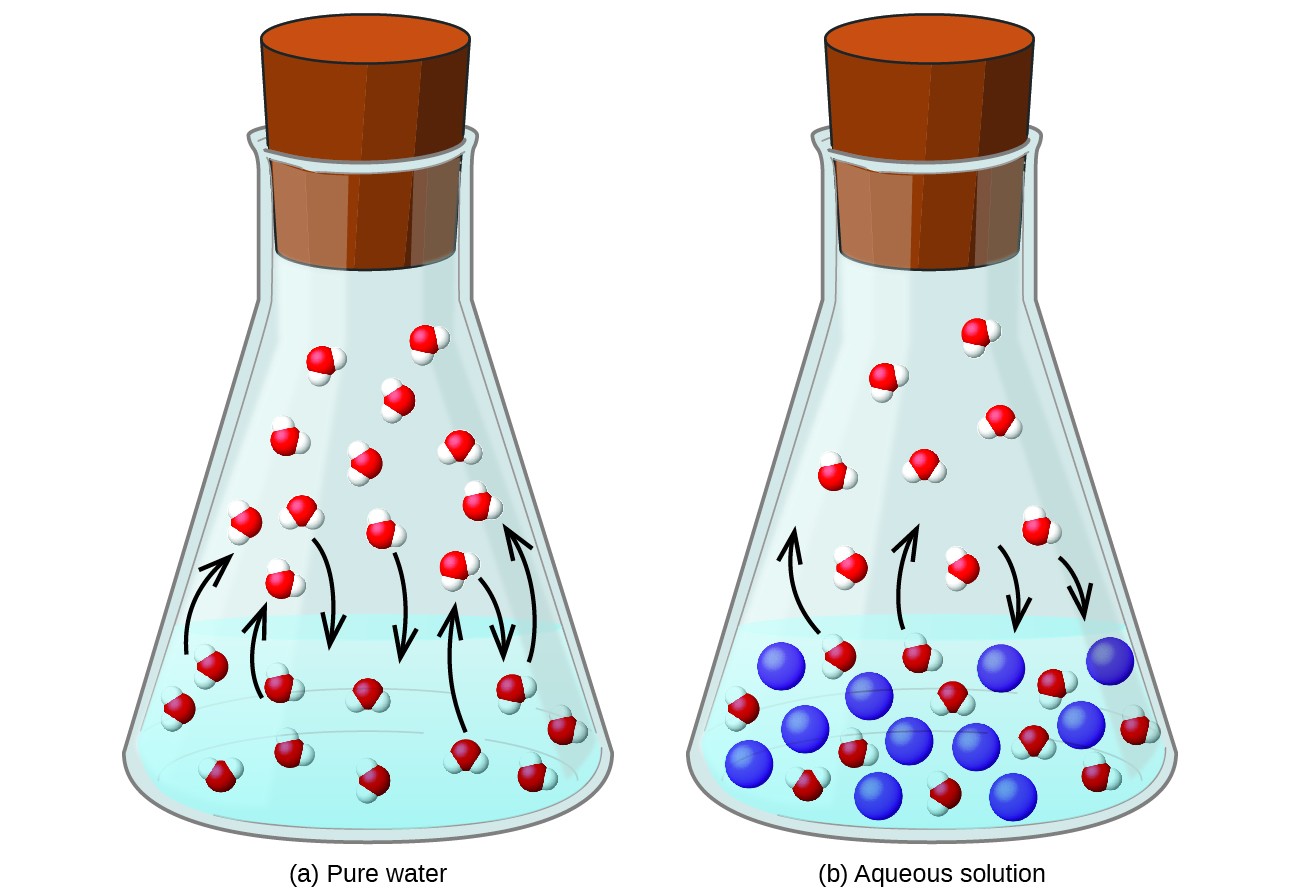
Kuva 1. Haihtumattomien liuenneiden aineiden läsnäolo alentaa liuoksen höyrynpainetta estämällä liuotinmolekyylien haihtumista. näitä komponentteja kuvataan Raoultin lailla: Ideaaliliuoksen minkä tahansa komponentin aiheuttama osapaine on yhtä suuri kuin puhtaan komponentin höyrynpaine kerrottuna sen moolijakeella liuoksessa.
{P} _ {\ text {A}} = {X} _ {\ text {A}} {P} _ {\ text {A}} ^ {\ star}
Palautetaan mieleen, että kaasumaisen seoksen kokonaispaine on yhtä suuri kuin kaikkien sen komponenttien osapaineiden summa (Daltonin osapainelaki), i-komponentteja sisältävän liuoksen kokonaishöyrynpaine on
{ P} _ {\ text {ratkaisu}} = \ summa _ {i} {P} _ {i} = \ summa _ {i} {X} _ {i} {P} _ {i} ^ {\ tähti}
Haihtumaton aine on aine, jonka höyrynpaine on merkityksetön (P ^ {\ star} ≈ 0), joten vain haihtumattomia liuenneita aineita sisältävän liuoksen höyrynpaine johtuu vain liuottimesta:
{P} _ {\ text {solution}} = {X} _ {\ text {liuotin}} {P} _ {\ text {liuotin}} ^ {\ tähti}
Liuosten tislaus
Tislaus on tekniikka seosten komponenttien erottamiseksi, jota käytetään laajasti sekä laboratoriossa että teollisuudessa. Sitä käytetään öljyn puhdistamiseen, käymistuotteiden eristämiseen ja veden puhdistamiseen. Tähän erotustekniikkaan kuuluu näyteseoksen hallittu lämmitys yhden tai useamman kiinnostavan komponentin höyrystämiseksi, kondensoimiseksi ja keräämiseksi. Tyypillinen laite laboratoriomittaisia tislauksia varten on esitetty kuvassa 2.

Kuva 2. Tyypillinen laboratoriotislausyksikkö on esitetty (a) valokuvassa ja (b) kaaviollisessa osassa komponentteja. (luotto a: muokkaus teoksesta ”Rifleman82” / Wikimedia commons; luotto b: työn muokkaus ”Slashme” / Wikipedia)
Öljynjalostamot käyttävät laajamittaista jakotislausta raakaöljyn komponentit. Raakaöljy kuumennetaan korkeisiin lämpötiloihin korkean jakotislauskolonnin pohjassa, höyrystämällä monia kolonnin sisällä nousevia komponentteja. Kun höyrystyneet komponentit saavuttavat nousunsa aikana riittävän viileät alueet, ne tiivistyvät ja kerääntyvät. Kerätyt nesteet ovat yksinkertaisempia seoksia hiilivetyjä ja muita maaöljyyhdisteitä, joilla on sopiva koostumus erilaisiin käyttötarkoituksiin (esim. Dieselpolttoaine, kerosiini, bensiini), kuten kuvassa 3 on esitetty.

Kuva 3. Raakaöljy on monimutkainen seos, joka erotetaan laajamittaisella jakotislauksella erilaisten yksinkertaisempien seosten eristämiseksi.
Kiehumispisteen korkeus
Kuten nesteitä ja kiintoaineita käsittelevässä luvussa kuvataan, nesteen kiehumispiste on lämpötila, jossa sen höyrynpaine on yhtä suuri kuin ilmakehän paine.Koska liuoksen höyrynpaine laskee haihtumattomien liuenneiden aineiden läsnäolon vuoksi, on järkevää, että liuoksen kiehumispiste nousee myöhemmin. Puhtaaseen liuottimeen verrattuna liuos vaatii siten korkeamman lämpötilan minkä tahansa annetun höyrynpaineen saavuttamiseksi, sisältäen yhden ekvivalentin ympäröivän ilmakehän paineeseen. Kiehumispisteen nousua, joka havaitaan, kun haihtumaton liuoteaine liuotetaan liuottimeen, ΔTb, kutsutaan kiehumispisteen korkeudeksi ja se on suoraan verrannollinen liuenneiden aineiden moolipitoisuuteen:
\ Delta {T} _ {\ text {b}} = {K} _ {\ text {b}} m
missä Kb on kiehumispisteen korkeusvakio tai ebullioskooppivakio ja m on Kaikkien liuenneiden aineiden molaarinen pitoisuus (molaalisuus).
Kiehumispisteen korkeusvakiot ovat tyypillisiä ominaisuuksia, jotka riippuvat liuottimen identiteetistä. Kb: n arvot useille liuottimille on lueteltu taulukossa 1.
Liuottimen höyrynpaineen laskeminen ja kiehumispisteen nousu riippuu tietyssä määrässä läsnä olevien liuenneiden hiukkasten kokonaismäärästä. liuottimen, ei hiukkasten massan, koon tai kemiallisten ominaisuuksien perusteella Sakkaroosin (342 g / mol) 1 m vesiliuoksella ja eteeniglykolin (62 g / mol) 1 m vesiliuoksella on sama kiehumispiste, koska jokaisessa liuoksessa on yksi mooli liuenneita hiukkasia (molekyylejä) kilogrammaa liuotinta kohti .
Esimerkki 6: Jodiliuoksen kiehumispiste
Etsi kiehumispiste liuokselle, jossa on 92,1 g jodia (I2) 800,0 g: ssa kloroformia, CHCl3 , olettaen, että jodi on haihtumaton ja että ratkaisu on ihanteellinen.
Tarkista oppimisenne
Mikä on 1,0 g: n liuoksen kiehumispiste glyseriini, C3H5 (OH) 3, 47,8 g: ssa vettä? Oletetaan ihanteellinen ratkaisu.
jäätymispisteen masennus

Kuva 4. Kivisuola ( Jää sulatetaan NaCl: lla, kalsiumkloridilla (CaCl2) tai näiden kahden seoksella. (luotto: Eddie Welkerin muokkaama työ)
Liuokset jäätyvät alhaisemmissa lämpötiloissa kuin puhtaat nesteet. Tätä ilmiötä hyödynnetään ”jäänpoistojärjestelmissä”, joissa käytetään suolaa (kuva 4), kalsiumkloridia tai ureaa jään sulattamiseen teillä ja jalkakäytävillä, ja etyleeniglykolia ”jäätymisenestonaineena” autojen jäähdyttimissä. Merivesi jäätyy alhaisemmassa lämpötilassa kuin makea vesi, joten Arktinen ja Etelämantereen valtameret jäädytymättömiksi jopa alle 0 ° C: n lämpötilassa (samoin kuin näissä valtamerissä elävien kalojen ja muiden kylmäveristen merieläinten kehonesteet).
Laimennetun liuoksen jäätymispisteen laskua puhtaaseen liuottimeen verrattuna ΔTf kutsutaan jäätymispisteen alenemaksi ja se on suoraan verrannollinen liuenneen aineen moolipitoisuuteen
\ Delta {T} _ {\ text {f}} = {K} _ {\ text {f}} m
jossa m on liuenneen aineen moolipitoisuus liuotinta ja Kf: tä kutsutaan jäätymispisteen masennusvakiona (tai kryoskooppivakiona). Aivan kuten kiehumispisteen korkeusvakioilla, nämä ovat tyypillisiä ominaisuuksia, joiden arvot riippuvat liuottimen kemiallisesta identiteetistä. Kf: n arvot useille liuottimille on lueteltu taulukossa 1.
Kolligatiiviset ominaisuudet ja jäänpoisto
Natriumkloridia ja sen ryhmän 2 analogeja kalsiumia ja magnesiumkloridia käytetään usein jäätiet ja jalkakäytävät johtuen siitä, että jommankumman näistä suoloista valmistetun liuoksen jäätymispiste on alle 0 ° C eli puhtaan veden jäätymispiste. Ryhmän 2 metallisuolat sekoitetaan usein halvemman ja helpommin saatavan natriumkloridin (”kivisuolan”) kanssa teillä käytettäväksi, koska ne ovat yleensä hieman vähemmän syövyttäviä kuin NaCl, ja ne aikaansaavat suuremman jäätymispisteen laskun , koska ne hajoavat saaden kolme hiukkaa kaavan yksikköä kohti, eikä kahta hiukkasia, kuten natriumkloridi.
Koska nämä ioniset yhdisteet pyrkivät nopeuttamaan metallin korroosiota, niitä ei olisi viisasta käyttää pakkasnestettä autosi jäähdyttimeen tai koneen jäänpoistoon ennen lentoonlähtöä.Näissä sovelluksissa käytetään usein kovalenttisia yhdisteitä, kuten eteeniä tai propyleeniglykolia. Jäähdytysnesteessä käytetyt glykolit eivät ainoastaan alenna nesteen jäätymispistettä, vaan ne myös nostavat kiehumispistettä, jolloin neste on hyödyllinen sekä talvella että kesällä. Lämmitettyjä glykoleja ruiskutetaan usein lentokoneiden pinnalle ennen lentoonlähtöä talvella säällä jo muodostuneen jään poistamiseksi ja jään muodostumisen estämiseksi, mikä olisi erityisen vaarallista, jos muodostuisi lentokoneen ohjauspinnoille (kuva 5).

Kuva 5. Jäätymispisteen masennusta hyödynnetään jään poistamiseksi (a) teiltä ja (b) lentokoneiden ohjauspinnat.
Liuoksen vaihekaavio
Kolligatiiviset vaikutukset höyrynpaineeseen, kiehumispisteeseen ja jäätymispisteeseen edellisessä osassa kuvatut ovat tiivistetysti kätevästi vertaamalla vaihekaavioita puhtaasta nesteestä ja siitä johdetusta liuoksesta. Veden ja vesiliuoksen vaihekaaviot on esitetty kuvassa 6.
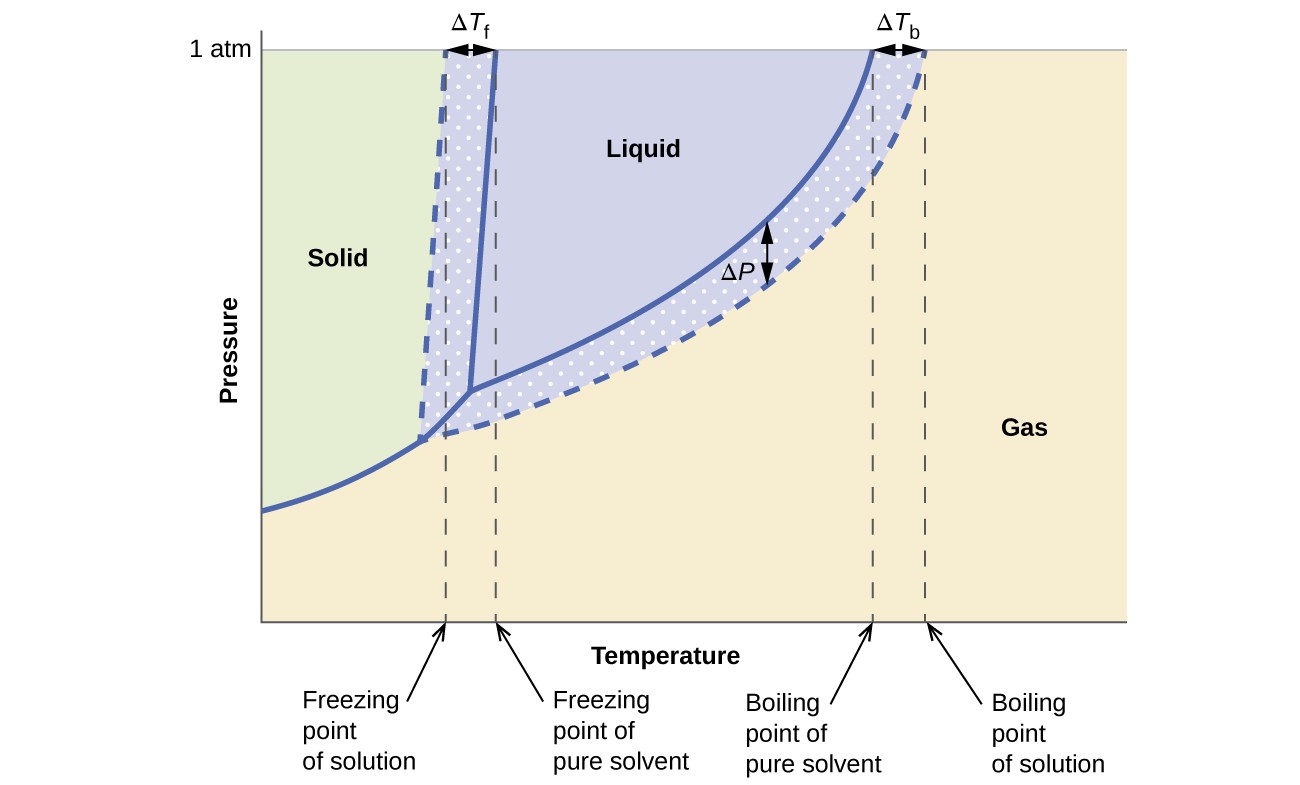
Kuva 6. Nämä vaiheet kaaviot esittävät vettä (kiinteät käyrät) ja ei-elektrolyytin vesiliuosta (katkoviivat käyrät).
Liuoksen neste-höyrykäyrä sijaitsee vastaavan liuottimen käyrän alapuolella, joka kuvaa höyryä paineen alentaminen, AP, joka johtuu haihtumattoman liuenneen aineen liukenemisesta. Näin ollen liuoksen kiehumispiste havaitaan missä tahansa annetussa paineessa korkeammassa lämpötilassa kuin puhtaan liuottimen lämpötila, mikä heijastaa kiehumispisteen korkeutta ΔTb, joka liittyy haihtumattoman liuenneen aineen läsnäoloon. Kiinteän nesteen käyrä liuosta varten siirretään vasemmalle puhtaan liuottimen käyrästä, mikä edustaa jäätymispisteen alennusta ATb, joka seuraa liuoksen muodostumista. Lopuksi huomaa, että kiinteän kaasun käyrät liuottimelle ja sen liuokselle ovat identtiset. Tämä pätee moniin liuoksiin, jotka sisältävät nestemäisiä liuottimia ja haihtumattomia liuenneita aineita. Aivan kuten höyrystyksessä, kun tällainen liuos jäädytetään, nesteestä kiinteään aineeseen siirtyminen tapahtuu itse asiassa vain liuotinmolekyyleissä muodostaen puhtaan kiinteän liuottimen, joka sulkee pois liuenneet aineet. Kiinteät ja kaasumaiset faasit koostuvat siten vain liuottimista, joten näiden faasien välisille siirtymille ei ole kolligatiivisia vaikutuksia.
Osmoosi ja liuosten osmoottinen paine
Lukuisia luonnollisia ja synteettisillä materiaaleilla on selektiivinen läpäisevyys, mikä tarkoittaa, että vain tietyn kokoiset, muodoltaan, napaisuudeltaan, varaukseltaan jne. olevat molekyylit tai ionit pystyvät kulkemaan (läpäisemään) materiaalin. Biologiset solukalvot tarjoavat tyylikkäitä esimerkkejä selektiivisestä läpäisystä luonnossa, kun taas dialyysiletkut, joita käytetään aineenvaihduntajätteiden poistamiseen verestä, on yksinkertaisempi tekninen esimerkki. Riippumatta siitä, miten ne voidaan valmistaa, näitä materiaaleja kutsutaan yleensä puoliläpäiseviksi kalvoiksi.
Harkitse kuvassa 7 esitettyä laitetta, jossa puhtaan liuottimen näytteet ja liuos erotetaan kalvolla, joka on vain liuotin. molekyylit voivat tunkeutua. Liuotinmolekyylit diffundoituvat kalvon yli molempiin suuntiin. Koska liuottimen pitoisuus on puhtaassa liuottimessa suurempi kuin liuos, nämä molekyylit diffundoituvat membraanin liuotinpuolelta liuospuolelle nopeammin kuin päinvastaisessa suunnassa. Tuloksena on liuotinmolekyylien nettosiirto puhtaasta liuottimesta liuokseen. Liuotinmolekyylien diffuusiopohjainen siirto puoliläpäisevän kalvon läpi on prosessi, joka tunnetaan nimellä osmoosi.
Kuva 7. a) Liuos ja puhdas liuotin erotetaan aluksi osmoottisella kalvolla. (b) Liuottimen molekyylien nettosiirto liuokseen tapahtuu, kunnes sen osmoottinen paine tuottaa yhtä suuret siirtymisnopeudet molempiin suuntiin.
Kun osmoosi suoritetaan kuviossa 7 esitetyssä laitteessa , liuoksen tilavuus kasvaa, kun se laimennetaan kertymällä liuottimeen. Tämä aiheuttaa liuoksen tason nousun, nostaen sen hydrostaattista painetta (johtuen putkessa olevan liuospylvään painosta) ja johtaa liuotinmolekyylien nopeampaan siirtymiseen takaisin puhtaaseen liuotinpuolelle. Kun paine saavuttaa arvon, joka tuottaa käänteisen liuottimen siirtonopeuden, joka on yhtä suuri kuin osmoosin nopeus, liuottimen irtoaminen loppuu. Tätä painetta kutsutaan liuoksen osmoottiseksi paineeksi (Π). Laimennetun liuoksen osmoottinen paine liittyy sen liuenneen aineen molaarisuuteen, M ja absoluuttiseen lämpötilaan T yhtälön mukaan
\ Pi = MRT
jossa R on yleinen kaasuvakio.
Jos liuos sijoitetaan kuviossa 8 esitetyn kaltaiseen laitteeseen, liuoksen osmoottista painetta suurempaa painetta kääntäen kääntyy osmoosi ja työnnetään liuotinmolekyylit liuoksesta puhtaaseen liuottimeen. Tätä käänteisosmoosimenetelmää käytetään meriveden laajamittaiseen suolanpoistoon ja pienemmissä mittakaavoissa erittäin puhdasta vesijohtovettä tuottamiseen juomiseen.
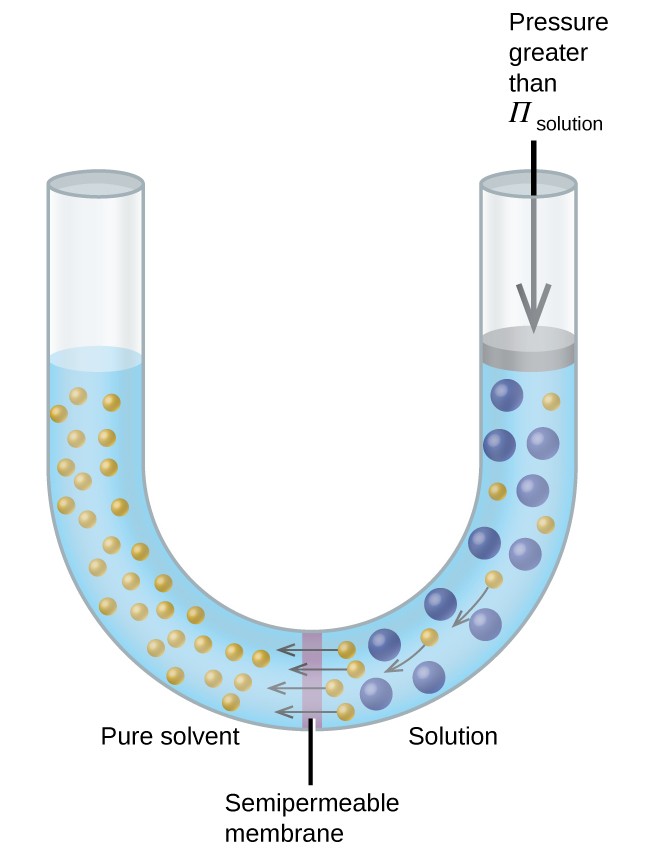
Kuva 8. Liuoksen osmoottista painetta suuremman paineen käyttäminen kääntää osmoosin. Liuoksen liuotinmolekyylit työnnetään puhtaaseen liuottimeen.
Käänteisosmoosivedenpuhdistus
Osmoosiprosessissa diffuusio palvelee veden siirtämistä vesiliuoksen läpi. puoliläpäisevä kalvo vähemmän väkevästä liuoksesta väkevämmäksi liuokseksi. Osmoottinen paine on paineen määrä, joka on kohdistettava väkevämpään liuokseen osmoosin lopettamiseksi. Jos käytetään suurempaa painetta, vesi siirtyy väkevämmästä liuoksesta vähemmän väkevöityyn (puhtaampaan) liuokseen. Tätä kutsutaan käänteisosmoosiksi. Käänteisosmoosia (RO) käytetään veden puhdistamiseen monissa sovelluksissa, rannikkokaupunkien suolanpoistolaitoksista ruokakauppojen vedenpuhdistuskoneisiin (kuva 9) ja pienempiin käänteisosmoosin kotitalousyksiköihin. Käsikäyttöisen pumpun avulla pieniä RO-yksiköitä voidaan käyttää kolmannen maailman maissa, katastrofialueilla ja pelastusveneissä. Armeijamme joukossa on useita generaattorikäyttöisiä RO-yksiköitä, jotka voidaan kuljettaa ajoneuvoissa syrjäisiin paikkoihin.

Kuva 9. Käänteisosmoosijärjestelmät juomaveden puhdistamiseksi on esitetty tässä (a) pienessä ja (b) suuressa mittakaavassa. (luotto a: muokkaus Jerry Kirkhartin työhön; luotto b: työ muokkaus Willard J. Lathropin toimesta)
Esimerkkejä osmoosista on ilmeisiä monissa biologisissa järjestelmissä, koska solut ovat ympäröivät puoliläpäisevät kalvot. Porkkanat ja selleri, joista on menetetty veden menettämisen vuoksi, voidaan tehdä rapeaksi asettamalla ne veteen. Vesi siirtyy porkkana- tai sellerisoluihin osmoosin avulla. Väkevään suolaliuokseen asetettu kurkku menettää veden osmoosin vaikutuksesta ja imee suolaa suolakurkkuksi. Osmoosi voi myös vaikuttaa eläinsoluihin. Liuenneiden aineiden pitoisuudet ovat erityisen tärkeitä, kun liuoksia ruiskutetaan elimistöön. Kehon solunesteissä olevat liuenneet aineet ja veriseerumi antavat näille liuoksille noin 7,7 atm: n osmoottisen paineen. Kehoon ruiskutetuilla liuoksilla on oltava sama osmoottinen paine kuin veriseerumilla; eli niiden tulisi olla isotonisia veriseerumin kanssa. Jos vähemmän konsentroitua liuosta, hypotonista liuosta, ruiskutetaan riittävässä määrin veriseerumin laimentamiseksi, laimennetusta seerumista tuleva vesi siirtyy verisoluihin osmoosin avulla, mikä saa solut laajenemaan ja repeämään. Tätä prosessia kutsutaan hemolyysiksi. Kun injektoidaan väkevämpi liuos, hypertoninen liuos, solut menettävät vettä väkevämmälle liuokselle, kutistuvat ja mahdollisesti kuolevat prosessissa, jota kutsutaan krenaatioksi. Nämä vaikutukset on kuvattu kuvassa 10.
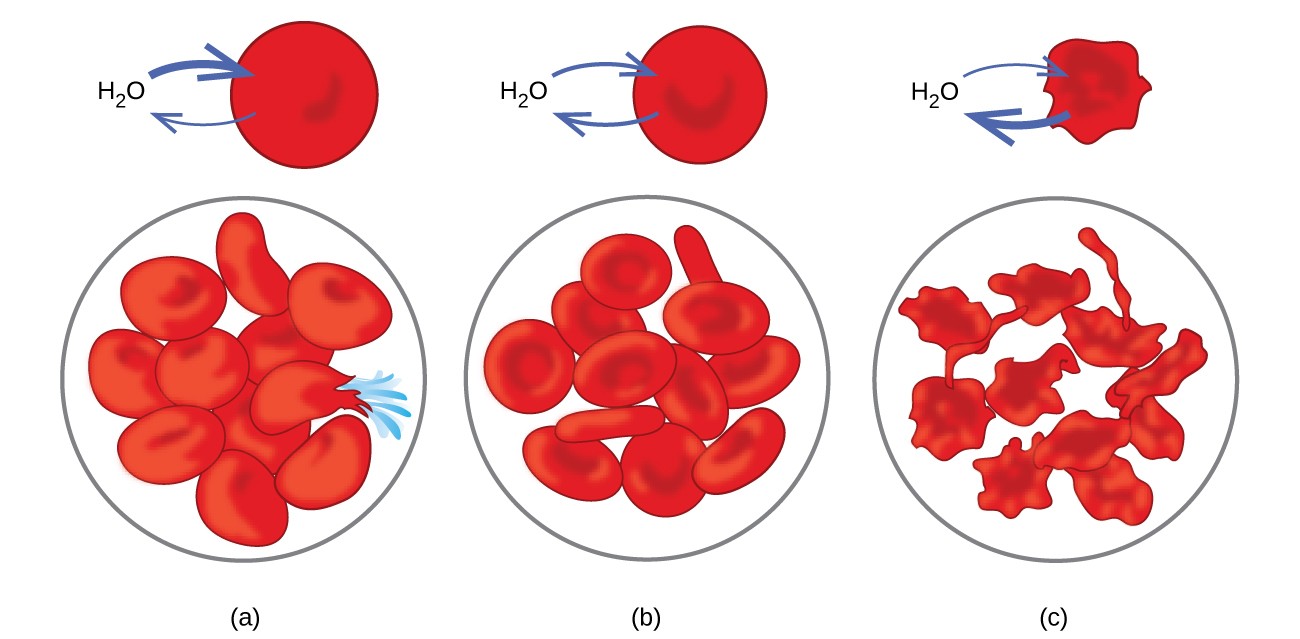
Kuva 10. Punasolujen kalvot ovat vettä läpäiseviä ja a) turpoaa ja mahdollisesti repeytyy hypotonisessa liuoksessa; (b) ylläpitää normaalia tilavuutta ja muotoa isotonisessa liuoksessa; ja (c) kutistuvat ja mahdollisesti kuolevat hypertonisessa liuoksessa. (hyvitys a / b / c: ”LadyofHats” / Wikimedia commons -työn muutokset)
Moolimassaan määritys
Osmoottinen paine ja jäätymispisteen muutokset, kiehuva piste ja höyrynpaine ovat suoraan verrannollisia läsnä olevan liuenneen aineen pitoisuuteen. Siksi voimme käyttää jonkin näistä ominaisuuksista mittaamaan liuenneen aineen moolimäärän mittausten perusteella.
Elektrolyyttien kolligatiiviset ominaisuudet
Kuten aiemmin tässä moduulissa todettiin, liuoksen kolligatiiviset ominaisuudet riippuvat vain liuenneiden liuenneiden lajien lukumäärästä, ei identiteetistä. Eri kolligatiivisten ominaisuuksien yhtälöiden pitoisuusehdot (jäätymispisteen aleneminen) , kiehumispisteen korkeus, osmoottinen paine) koskevat kaikkia liuoksessa olevia liuenneita lajeja. Tässä luvussa toistaiseksi tarkastelluissa liuoksissa liuenneet aineet ovat olleet eielektrolyyttejä, jotka liukenevat fyysisesti ilman dissosiaatiota tai muuta liitännäisprosessia. Liukeneva liuos tuottaa yhden liuenneen liuenneen molekyylin. Elektrolyytin liukeneminen ei kuitenkaan ole niin yksinkertaista, kuten alla olevat kaksi yleistä esimerkkiä osoittavat:
Ottaen huomioon ensimmäisen näistä esimerkeistä ja olettaen täydellisen dissosiaation, 1,0 m NaCl: n vesiliuos sisältää 2,0 moolia ioneja (1,0 moolia Na + ja 1.0 mol Cl−) kutakin vesikiloa kohden, ja sen jäätymispisteen laskun odotetaan olevan
Kun tämä liuos tosiasiallisesti valmistetaan ja sen jäätymispisteen lasku mitataan, saadaan kuitenkin arvo 3,4 ° C. Samanlaisia eroja havaitaan muillakin ioniyhdisteillä, ja mitattujen ja odotettujen kolligatiivisten ominaisarvojen väliset erot tulevat tyypillisesti merkittävämmiksi liuenneiden aineiden pitoisuuksien kasvaessa. Nämä havainnot viittaavat siihen, että natriumkloridin (ja muiden vahvojen elektrolyyttien) ionit eivät ole täysin dissosioituneet liuoksessa.
Tämän huomioon ottamiseksi ja kokonaisdissosiaation oletukseen liittyvien virheiden välttämiseksi kokeellisesti mitattu parametri Nobel-palkinnon saaneen saksalaisen kemisti Jacobus Henricus van’t Hoffin kunnia on käytetty. Van’t Hoff -kerroin (i) määritellään liuenneiden liuenneiden hiukkasten suhteeksi liuenneiden kaavayksiköiden lukumäärään:
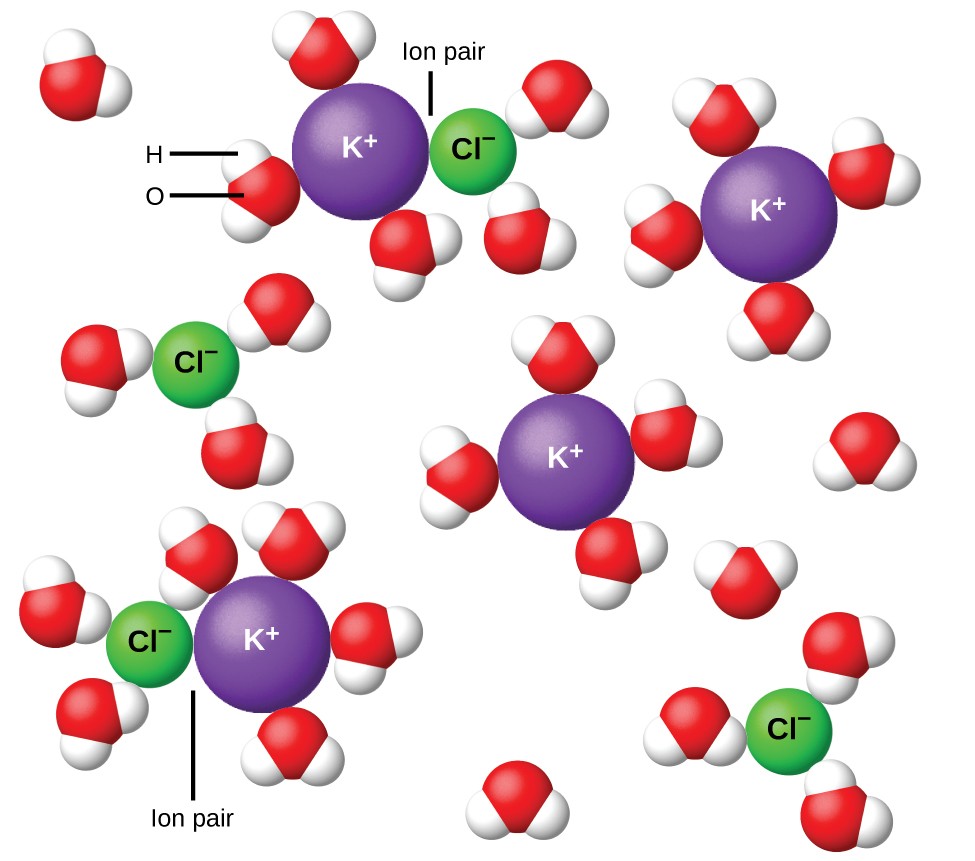
Kuva 11. Ionit erottuvat yhä laajemmin, mitä enemmän liuos laimennetaan, ja jäännösinterionioniset vetovoimat vähenevät.
Vuonna 1923 kemistit Peter Debye ja Erich Hückel ehdottivat teoriaa selittääkseen voimakkaiden elektrolyyttien ilmeisen epätäydellisen ionisaation. He ehdottivat, että vaikka ionien välinen vetovoima vesiliuoksessa vähenee suuresti ionien solvaation ja polaarisen liuottimen eristävän toiminnan vaikutuksesta, sitä ei kuitenkaan tyhjennetä kokonaan. Jäännösvetovoimat estävät ioneja käyttäytymästä täysin itsenäisinä hiukkasina (kuva 11). Joissakin tapauksissa positiivinen ja negatiivinen ioni voivat todella koskettaa, jolloin solvattu yksikkö on ionipari. Täten minkä tahansa tietyn tyyppisen ionin aktiivisuus tai tehokas pitoisuus on pienempi kuin todellisen pitoisuuden osoittama. Ionit erottuvat yhä laajemmin, mitä enemmän laimennetaan liuosta, ja jäännösinterionioniset vetovoimat vähenevät. Siten erittäin laimennetuissa liuoksissa ionien tehokkaat pitoisuudet (niiden aktiivisuudet) ovat olennaisesti yhtä suuria kuin todelliset pitoisuudet. Huomaa, että taulukossa 2 olevat elektrolyyttien van’t Hoff-kertoimet koskevat 0,05 m liuoksia, joiden pitoisuudella i: n arvo NaCl: lle on 1,9, toisin kuin ihanteellinen arvo 2.
Esimerkki 11: Elektrolyytin liuoksen jäätymispiste
Ionien pitoisuus merivedessä on suunnilleen sama kuin liuoksessa, joka sisältää 4,2 g NaCl liuotettuna 125 g: aan vettä. Oletetaan, että jokaisella NaCl-liuoksen ionilla on sama vaikutus veden jäätymispisteeseen kuin ei-elektrolyyttimolekyylillä, ja määritä liuoksen jäätymislämpötila (joka on suunnilleen sama kuin meriveden jäätymislämpötila).
Tarkista oppimisenne
Oletetaan, että kukin kalsiumkloridin, CaCl2: n, ioneista, sillä on sama vaikutus veden jäätymispisteeseen kuin ei-elektrolyyttimolekyylillä. Laske jäätymispiste liuokselle, jossa on 0,724 g CaCl2 175 g: ssa vettä.
Kokeile
- Liha voidaan luokitella tuoreeksi (ei jäädytetyksi), vaikka sitä säilytetään paikassa -1 ° C. Miksi liha ei jäätyisi tässä lämpötilassa?
- Orgaanisen yhdisteen koostumus on 93,46% C ja 6,54 H H massasta. Liuos, jossa on 0,090 g tätä yhdistettä 1,10 g: ssa kamferia, sulaa 158,4 ° C: ssa. Puhtaan kamferin sulamispiste on 178,4 ° C. Kamfarin Kf on 37,7 ° C / m. Mikä on liuenneen aineen molekyylikaava? Näytä laskelmat.
- Suolan tiedetään olevan alkalimetallifluoridi. Nopea likimääräinen jäätymispisteen määritys osoittaa, että 4 g 100 g: aan vettä liuotettua suolaa tuottaa liuoksen, joka jäätyy noin -1,4 ° C: ssa. Mikä on suolan kaava? Näytä laskelmat.
Sanasto
aktiivisuus: ionien tehokas pitoisuus liuoksessa; se on pienempi kuin todellinen pitoisuus ionisten vuorovaikutusten vuoksi.
Kiehumispisteen nousu: nesteen kiehumispisteen nousu lisäämällä liuotettua ainetta.
Kiehumispisteen korkeusvakio: suhteellisuusvakio yhtälössä, joka liittyy kiehumispisteen nousuun liuenneen aineen molaalisuuteen tunnetaan myös nimellä ebullioskooppinen vakio
kolligatiivinen ominaisuus: liuoksen ominaisuus, joka riippuu vain liuenneen lajin pitoisuudesta
crenation: prosessi, jossa biologiset solut kutistuvat veden menetyksen vuoksi osmoosilla
jäätymispisteen lasku: nesteen jäätymispisteen alentaminen lisäämällä liuotinta
jäätymispisteen masennusvakio: (myös kryoskooppivakio) suhteellisuusvakio yhtälöön jäätymispisteen masennus liuenneen molaalisuuden vuoksi
hemolyysi: punasolujen repeämä osmoosin kerääntyneen ylimääräisen veden vuoksi
hypertoninen: suurempi osmoottinen paine
hypotoninen : vähemmän osmoottista painetta
ionipari: solvatoitunut anioni- / kationipari, jota yhdessä kohtalainen sähköstaattinen vetovoima pitää yhdessä
isotoninen: yhtä suuri osmoottinen paine
molaalisuus (m) : konsentraatioyksikkö, joka määritetään liuenneen aineen moolimäärän ja liuottimen massan suhteena kilogrammoina
moolijae (X): liuoksen komponentin moolimäärän suhde kaikkien liuoksen komponenttien moolien kokonaismäärään
osmoosi: liuotinmolekyylien diffuusio puoliläpäisevän kalvon läpi
osmoottinen paine (Π ): vastapaine, jota tarvitaan liuotinmolekyylien massansiirron estämiseksi puoliläpäisevän membraanin läpi höyrynpaine puhtaassa tilassa
puoliläpäisevä kalvo: kalvo, joka sallii valikoivasti tiettyjen ionien tai molekyylien kulkemisen
van’t Hoff -kerroin (i): moolien määrän suhde liuoksessa olevien hiukkasten määrän liuokseen liuotettujen kaavan yksiköiden moolimäärään
- Vertailun vuoksi esitetty ei-elektrolyytti. ↵

