- Suurten vasta-ainepitoisuuksien (titeri > 1: 640) läsnäolon pitäisi tehdä epäilyttäväksi autoimmuunisairauden esiintyminen esittää. Tässä skenaariossa suosittelen, että seerumit testataan sitten vasta-aineiden suhteen dsDNA: lle, Sm: lle, RNP: lle, Ro: lle (SS-A), La: lle (SS-B) ja ehkä Scl-70: lle. Vasta-aineiden läsnäolo näille lisää huomattavasti todennäköisyyttä, että potilaalla on SLE, MCTD, Sjögren tai skleroderma. Jotkut laboratoriot testaavat automaattisesti nämä vasta-aineet aina, kun ANA-seulonta on positiivinen. Näiden vasta-aineiden läsnäolo ei kuitenkaan ole taudin diagnostinen. Jos alustavaa diagnoosia ei voida tehdä, käytänni olen tarkkailla potilasta huolellisesti ajan mittaan ANA: han liittyvän taudin kehittymisen varalta ja nähdä potilaan vähintään kahdesti vuodessa.
- Pienien titterien yhdistelmä vasta-ainetta (< 1:80), eikä lainkaan tai vain muutama taudin merkki tai oire viittaa paljon pienempään todennäköisyyteen autoimmuunisairaudesta. Tämän seurauksena nämä potilaat, joilla on alhainen ANA-tiitteri, on arvioitava uudelleen harvemmin – vuosittain, ellei kliinisten oireiden kehittyminen viittaa autoimmuunisairauteen.
- Potilaalla, jolla on negatiivinen ANA, ei todennäköisesti ole joko SLE: tä, MCTD: tä. , Sjögren tai skleroderma. Kuitenkin, jos systeemisestä autoimmuunisairaudesta on edelleen vahvaa kliinistä näyttöä, voidaan testata spesifisiä vasta-aineita kaksijuosteiselle (ds) DNA: lle, Sm: lle, RNP: lle, Ro: lle, La: lle tai Scl-70: lle, vaikka kokemukseni mukaan ne ovat tyypillisesti negatiivisia. Siitä huolimatta on järkevää nähdä sellaisia potilaita, joilla on korkea kliininen epäilyindeksi ainakin vuosittain – vaikkakin useammin, jos kliinisesti aiheellista.
- Antinukleaariset vasta-aineet tuottavat laajan valikoiman värjäytymismalleja (homogeeniset, diffuusit , perifeerinen, reunus, pilkullinen, nukleolaarinen, anticentromere jne.). Ydinvärjäyskuvion on todettu olevan suhteellisen matala herkkyys ja spesifisyys erilaisille autoimmuunisairauksille. Spesifisiin ydinantigeeneihin kohdistuvien vasta-aineiden läsnäolo on yleensä hyödyllisempää. (Näitä vasta-aineita ovat seuraavat: dsDNA, Sm, RNP, Ro, La tai Scl-70.)
Viime vuosina tutkijat ja biotekniikkayritykset ovat kehittäneet kiinteän faasin immunomääritykset IF ANA -testin korvaamiseksi. 4-23 Tämän yrityksen taustalla olevat perustelut liittyvät IF-tekniikan suorituskykyominaisuuksiin. Tämä testi on erittäin työvoimavaltainen ja vaihtelee teknikkojen eri tulkintojen vuoksi. Myös testausta vaikeuttaa kuvan häipyminen, kun sitä tutkitaan fluoresoivalla mikroskoopilla. Lisäksi IF-tekniikassa käytetään potilasseerumien sarjalaimennuksia, mikä antaa tuloksia, jotka eivät välttämättä ole lineaarisia. Tiitterin kaksinkertaiset vaihtelut ovat yleisiä päivittäisessä testauksessa samasta näytteestä; nelinkertaisten erojen sanotaan olevan ”merkittäviä”. Sitä vastoin kiinteäfaasiset immuunimääritykset ovat automatisoituja ja hyvin toistettavia. Tulokset ovat lineaarisia, tekniikka on vähemmän työvoimavaltaista ja siten halvempaa suorittaa.
Näiden näkökohtien takia käyttäen kiinteän faasin immunomääritystä ANA: n kvantitoimiseksi.Siksi yrittäessä kehittää kiinteäfaasisia ANA-immunomäärityksiä, joukko ryhmiä on asettanut kiinteään faasiin mitä tahansa antigeenejä, jotka tyypillisesti määritetään spesifisemmissä ANA-immunomäärityksissä (esim. DNA, Sm, RNP, Ro / SSA, La / SSB, nukleoproteiini, solu-uutteet jne.) .Julkaisuissa raporteissa ANA-tiitterien ja näiden kiinteän faasin määritysten välinen korrelaatiokerroin on varsin hyvä.Siksi monet kaupalliset yritykset ovat vaihtaneet ANA: ta näihin kiinteän faasin immunomäärityksiin. 4-23 Huolestuttavaa on kuitenkin väärien negatiivisten tulosten korkea esiintyvyys / prosenttiosuus potilailla, joilla on tiedossa oleva SLE ja siihen liittyvät sairaudet, sekä ”väärien positiivisten” jatkuva korkea esiintyvyys (esim. positiivinen ANA jossakin ilman SLE: tä) näissä tutkimuksissa. 15–21 Lisätyötä tarvitaan näiden kiinteän faasin immunomääritysten herkkyyden ja erityisesti spesifisyyden parantamiseksi sen varmistamiseksi, että SLE-tautia ja siihen liittyviä sairauksia sairastavat potilaat eivät jää väliin näistä kiinteän vaiheen immunomäärityksistä.
DNA: n vasta-aineet
DNA: n vasta-aineet voidaan jakaa ensisijaisesti vasta-aineisiin, jotka reagoivat yksijuosteisen (ss) DNA: n kanssa, ja vasta-aineisiin, jotka tunnistavat dsDNA: n. 24-26
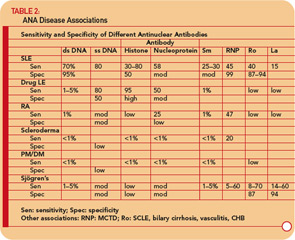
Anti- ssDNA-vasta-aineita on raportoitu SLE: ssä, nivelreumassa, lääkkeisiin liittyvässä lupuksessa, SLE-potilaiden terveissä sukulaisissa ja harvemmin muissa reumaattisissa sairauksissa. (Katso taulukko 2, s. 17.) Siten anti-ssDNA: lla on rajoitettu käyttökelpoisuus SLE: n tai muiden reumaattisten sairauksien diagnosoinnissa. Anti-ssDNA ei korreloi hyvin taudin aktiivisuuden kanssa, joten se ei ole hyödyllinen taudin hoidossa.
dsDNA: n vasta-aineet havaitaan useimmiten kiinteän vaiheen immunomäärityksillä, mutta joissakin laboratorioissa myös crithidia IF -testillä tai toisinaan Farrin radioimmunomääritys.Useimmat sairaala- ja kaupalliset laboratoriot tekevät vain yhden. Farrin määrityksellä on todennäköisesti korkein spesifisyys ja alin herkkyys kolmesta määrityksestä SLE: n diagnosoimiseksi, kun taas kiinteän vaiheen määrityksillä on korkein herkkyys ja alin spesifisyys; crithidia-määritys putoaa väliin. Farrin määrityksellä on myös haitta radioaktiivisen materiaalin käytöstä, jota useimmat laboratoriot välttävät, ja krithidiatesti on erittäin työvoimavaltainen. Pidän parempana ELISA-määrityksestä jokapäiväiseen käyttöön.
Anti-dsDNA ovat spesifisiä (95%), vaikkakaan ei erityisen herkkiä (70%) SLE: lle, joten ne ovat erittäin hyödyllisiä diagnosoinnissa, kun ne ovat positiivisia. 9 (Katso taulukko 2 , s. 17.) Niitä esiintyy toisinaan muissa sairauksissa, mukaan lukien nivelreuma, nuorten niveltulehdus, lääkkeiden aiheuttama lupus, autoimmuunihepatiitti ja jopa normaaleilla ihmisillä.
Anti-dsDNA-vasta-aineiden otsikot vaihtelevat usein. joilla on sairauden aktiivisuus, erityisesti lupus-nefriitti, ja ne ovat siksi hyödyllisiä monille potilaille SLE-kurssin seuraamiseksi. Jos potilaan tiitteri on nouseva tai erittäin korkea, mutta kliinisesti lepotilassa, en käsittele serologisia poikkeavuuksia, mutta pidän varoitusmerkkinä, että potilasta on seurattava tarkemmin ja hoidettava, kun jotain tapahtuu kliinisesti potilaan saamiseksi. muutos hoidossa. Jotkut tutkijat ovat kuitenkin hoitaneet näitä serologisia poikkeavuuksia (varsinkin kun ne liittyvät mataliin komplementtitasoihin) ja raportoineet parantuneista kliinisistä tuloksista. Vastaavasti käytän putoavaa tiitteriä henkilöllä, joka paranee hoidon puhkeamisen jälkeen, ohjeena hoidon vähentämisessä (esim. Kortikosteroidit ja / tai immunosuppressiiviset aineet).
DsDNA-vasta-aineiden ja muiden vasta-aineiden välinen yhteys SLE-taudin ilmenemismuodot ovat paljon vähemmän selvät. Esimerkiksi anti-dsDNA-tiitterin ja neuropsykiatrisen SLE: n taudin aktiivisuuden välillä ei ole yhteyttä.
Aktiivisen lupuksen ilmenemismuotojen erottaminen tarttuvista komplikaatioista tai lääkkeiden toksisista vaikutuksista – ja etuyhteydettömästä taudista – on aina haaste. Anti-dsDNA-vasta-aineiden läsnäolo voi olla hyödyllistä joillekin potilaille tämän eron tekemisessä.
Anti-Smith- ja anti-ribonukleoproteiinivasta-aineet
Smithin (Sm) ja ribonukleoproteiinin vasta-aineet (anti-RNP) havaitaan useimmiten kiinteän faasin immunomäärityksillä. 24,27
Anti-Sm-vasta-aineita löytyy vain 10-40% SLE-potilaista, mutta niitä esiintyy hyvin harvoin potilailla, joilla on muut olosuhteet (ts. ne eivät ole herkkiä, mutta ovat hyvin spesifisiä). Anti-Sm-tiitterien mittaaminen voi olla hyödyllistä diagnostisesti, erityisesti aikana, jolloin anti-DNA-vasta-aineita ei voida havaita. Kun otetaan huomioon anti-Sm: n suhteellisen alhainen herkkyys, negatiivinen arvo ei kuitenkaan millään tavalla sulje pois SLE: n diagnosointia.
Anti-RNP-vasta-aineita löytyy noin 40-60%: lla SLE-potilaista, mutta eivät ole spesifisiä SLE: lle, koska ne ovat MCTD: n määrittävä piirre. Näitä vasta-aineita voi esiintyä myös matalissa tiittereissä ja matalissa taajuuksissa muissa reumaattisissa sairauksissa, mukaan lukien RA ja skleroderma. (Katso taulukko 2, s. 17.)
Anti-Sm- tai anti-RNP-vasta-aineiden tiitteri (tasot) ei korreloi minkään kliinisen aktiivisuuden kanssa.
Anti-Ro / SSA ja Anti-La / SSB-vasta-aineet
Ro / SSA- ja La / SSB-vasta-aineet havaitaan useimmiten kiinteän vaiheen immunomäärityksillä. 28,29 Anti-Ro / SSA ja anti-La / SSB on havaittu korkealla taajuudella potilailla, joilla on Sjögrenin oireyhtymä ja SLE, mutta myös potilailla, joilla on valoherkkä dermatiitti, ja 0,1%: lla – 0,5%: lla terveistä aikuisista.
Anti-Ro / SSA-vasta-aineita löytyy noin 50%: lla potilailla, joilla on SLE. (Katso taulukko 2, s. 17.) Niihin on liittynyt valoherkkyys, subakuutti ihon lupus, ihon vaskuliitti (palpoituva purppura), interstitiaalinen keuhkosairaus, vastasyntyneen lupus ja synnynnäinen sydänlohko. Anti-Ro / SSA-vasta-aineita löytyy noin 75%: lla potilaista, joilla on primaarinen Sjögrenin oireyhtymä (katso taulukko 2, s. 17), ja näiden vasta-aineiden korkeisiin tiittereihin liittyy enemmän rauhasominaisuuksia, erityisesti purppura ja vaskuliitti. Sitä vastoin Ro / SSA-vasta-aineita on vain 10%: lla 15%: lla potilaista, joilla on sekundäärinen Sjögrenin oireyhtymä, johon liittyy nivelreuma. Siksi Ro / SSA- tai anti-La / SSB-vasta-aineiden esiintyminen potilailla, joilla epäillään primaarista Sjögrenin oireyhtymää, tukee vahvasti diagnoosia.
Noin 50% SLE-potilaista, joilla on anti-Ro-vasta-aine, on myös -La-vasta-aine, läheinen RNA-proteiiniantigeeni. Vastaavasti useimmilla Sjögrenin oireyhtymää sairastavilla potilailla on myös anti-La (SSB) -vasta-aineita. On erittäin harvinaista löytää potilaita, joilla on anti-La-vasta-aineita ilman anti-Ro-vasta-aineita.
Mielestäni indikaatiot anti-Ro / SSA- ja anti-La / SSB-vasta-ainetestien tilaamiseksi ovat seuraavat:
- SLE-naiset, jotka ovat raskaana tai ovat voi tulla raskaaksi tulevaisuudessa;
- naiset, joilla on aiemmin ollut lapsen sydänsairaus tai sydänlihastulehdus;
- potilaat, joilla on aiemmin ollut selittämätöntä valoherkkää ihonpurkausta;
- Potilaat, joiden epäillään olevan SLE, mutta joiden ANA-testi on negatiivinen; tai
- potilaat, joilla on kserostomian, keratokonjunktiviitti siccan ja / tai syljen ja kyynelrauhasen oireita.
Antiribosomaaliset P-proteiinivasta-aineet
Anti- ribosomaalisen P-proteiinin vasta-aineita on havaittu 10-20% SLE-potilaista Yhdysvalloissa ja 40-50% aasialaisista SLE-potilaista, mutta harvoin muissa reumaattisissa sairauksissa .30 Ribosomaaliset P-proteiinivasta-aineet voivat olla erittäin voimakkaita spesifinen lupukseen liittyvälle psykoosille, vaikka kaikki tutkimukset eivät ole vahvistaneet tätä. Lupusta kärsivien potilaiden masennus sekä munuaisten ja maksan osallistuminen on joissakin pienissä tutkimuksissa liittynyt myös anti-ribosomaalisiin P-proteiinivasta-aineisiin.
Alhaisen herkkyyden ja heikon kliinisen korrelaation takia monet tutkijat – myös minä – katso vähän kliinistä hyödyllisyyttä tässä testissä.
Centromere-vasta-aineet
Centromere-vasta-aineita (ACA) löytyy melkein yksinomaan potilaista, joilla on rajoitettu ihon systeeminen skleroosi (lcSSc), etenkin niillä, joilla on CREST.31 ACA: ta on havaittu 57%: lla CREST-potilaista, mutta niitä on havaittu myös potilailla, joilla on muita sairauksia, mukaan lukien joillakin potilailla, joilla on vain Raynaud’n ilmiö. ACA: t havaitaan tyypillisesti Hep-2-solujen tyypillisen IF-kuvion avulla.
Anti-Scl-70 (topoisomeraasi-1) vasta-aineet
Noin 15-20% sklerodermaa sairastavista potilaista on vasta-aineita 70 kd: n proteiinille (topoisomeraasi-1), jota myöhemmin kutsutaan nimellä Scl-70.31. Tavallinen menetelmä havaitsemiseksi on ELISA. Näiden vasta-aineiden läsnäolo näyttää lisäävän keuhkofibroosin riskiä sklerodermaa sairastavilla potilailla ja on varsin spesifinen sairaudelle.
Yhteenveto
Jos epäillään SLE: tä historiaan, fyysiseen fyysiseen tilanteeseen tutkimus ja täydellinen verenkuva (esim. leukopenia, trombosytopenia), pyydä ANA-testi. Jos se on negatiivinen, on erittäin epätodennäköistä, että potilaalla on SLE, ja potilas voidaan rauhoittaa. Jos titteri on < 1: 160, SLE on epätodennäköinen ja potilas voidaan vakuuttaa, että SLE on epätodennäköinen, mutta potilasta tulee seurata säännöllisesti. Tiitteri ≥1: 160 lisää SLE: n ja siihen liittyvien häiriöiden todennäköisyyttä. On kuitenkin tärkeää muistaa, että 85 prosentilla yksilöistä, joilla on positiivinen ANA, ei ole SLE: tä. Jos ANA on positiivinen, tulisi testata myös vasta-aineita dsDNA: lle, Sm: lle, RNP: lle, Ro / SSA: lle ja La / SSB: lle. Näiden vasta-aineiden läsnäolo lisää suuresti todennäköisyyttä, että potilaalla on SLE ja siihen liittyvät häiriöt (katso taulukko 2, s. 17), ja potilasta on seurattava tarkemmin. Sentrometri- ja anti-Scl-70-vasta-aineiden havaitseminen on erittäin hyödyllistä skleroderman diagnosoinnissa. Ro / SSA: n ja La / SSB: n vasta-aineiden havaitseminen on hyödyllistä myös Sjögrenin oireyhtymän diagnosoinnissa.
Ainoa näistä testeistä, joka on hyödyllinen aktiivisuuden seuraamiseksi, on anti-dsDNA.
Kiitos: Olen kiitollinen useiden UpToDate in Medicine -kirjoittajien työstä, jonka työ tarjosi hyödyllisen kehyksen tämän paperin kehittämiselle, sekä tohtoreille. Robert Shmerling, David Lee ja Donald Bloch, joiden kanssa olen kirjoittanut papereita ja lukuja tästä aiheesta.
Dr. Schur on lääketieteen professori Harvardin lääketieteellisessä koulussa ja reumatologian, immunologian ja allergian osasto lääketieteen osastolla Brighamissa ja Bostonin naisten sairaalassa.
- Reichlin M. antinukleaariset vasta-aineet. Ajantasalla. Lokakuu 2008.
- American College of Rheumatology Ad Hoc Committee on Immunologic Testing Guidelines. Ohjeet immunologisiin laboratoriotesteihin reumaattisissa sairauksissa: Johdanto. Niveltulehdus Rheum. 2002; 47: 429-433.
- Salomon DH, Kavanaugh AJ, Schur PH et ai. Todisteisiin perustuvat ohjeet immunologisten testien käytöstä: Antinukleaaristen vasta-aineiden testaus. Niveltulehdus Rheum. 2002; 47: 434-444.
- Sinclair D, Saas M, Williams D, Hart M, Goswami R. Voiko ELISA korvata immunofluoresenssin ydinvoiman vasta-aineiden havaitsemisessa? -ydinvasta-aineseulonta ELISA: t. Clin Lab. 2007; 53: 183-191.
- Avaniss-Aghajani E, Berzon S, Sarkissian A. multipleksoitujen helmipohjaisten immunomääritysten kliininen arvo ydinantigeenien autoantivasta-aineiden havaitsemiseksi. Clin Rokote Immunol. 2007; 14: 505-509.
- Copple SS, Martins TB, Masterson C, Joly E, Hill HR. Kolmen multiplex-immunomäärityksen vertailu uutettavien ydinvasta-aineiden vasta-aineiden havaitsemiseksi kliinisesti määriteltyjen seerumien avulla. Ann N Y Acad Sci.2007; 1109: 464-472.
- Caramaschi P, Ruzzenente O, Pieropan S et ai. ANA-spesifisyyden määrittäminen multipleksoidulla fluoresoivalla mikropallon immunomäärityksellä potilailla, joilla on ANA-positiivisuus korkealla titterillä infliksimabihoidon jälkeen: Alustavat tulokset. Rheumatol Int. 2007; 27: 649-654.
- Biagini RE, Parks CG, Smith JP, Sammons DL, Robertson SA. AtheNA MultiLyte ANA II -analyysin analyyttinen suorituskyky lupuspotilaiden seerumeissa, joilla on useita positiivisia ANA: ta. Anal Bioanal Chem. 2007; 388: 613-618.
- Gonzalez C, Garcia-Berrocal B, Perez M et ai. Sidekudosairauksien laboratorioseulonta kliinisesti määriteltyjen potilaiden uudella automaattisella ENA-seulontamäärityksellä (EliA Symphony). Clin Chim Acta. 2005; 359: 109-114.
- Eissfeller P, Sticherling M, Scholz D et ai. Eri testijärjestelmien vertailu samanaikaisen auto-vasta-aineen havaitsemiseksi sidekudossairauksissa Ann N Y Acad Sci. 2005; 1050: 327-339.
- Smith J, Onley D, Garey C et ai. ANA-spesifisyyden määrittäminen UltraPlex-alustan avulla. Ann N Y Acad Sci. 2005; 1050: 286-294.
- Martins TB, Burlingame R, von Muhlen CA, et ai. Multipleksoidun fluoresoivan mikrosfäärin immunomäärityksen arviointi ydinantigeenien auto-vasta-aineiden havaitsemiseksi. Clin Diagn Lab Immunol. 2004; 11: 1054-1059.
- Bernardini S, Infantino M, Bellincampi L et ai. Antinukleaaristen vasta-aineiden seulonta: Vertailu entsyymi-immunomäärityksen perusteella, joka perustuu ydinhomogenaatteihin, puhdistettuihin tai rekombinanttiantigeeneihin ja immunofluoresenssimääritykseen. Clin Chem Lab Med. 2004; 42: 1155-1160.
- Nossent H, Rekvig OP. Antinukleaaristen vasta-aineiden seulonta uudella vuosituhannella: Jäähyväiset mikroskoopille? Scand J Rheumatol. 2001; 30: 123-126; keskustelu 127-128.
- Lopez-Hoyos M, Rodriguez-Valverde V, Martinez-Taboada V.Antinukleaaristen vasta-aineiden sidekudostaudin suorituskyky. Ann N Y Acad Sci. 2007; 1109: 322-329.
- Ghillani P, Rouquette AM, Desgruelles C et ai. LIAISON ANA -seulamäärityksen arviointi antinukleaaristen vasta-aineiden testaamiseksi autoimmuunisairauksissa. Ann N Y Acad Sci. 2007; 1109: 407-413.
- Bonilla E, Francis L, Allam F et ai. Immunofluoresenssimikroskopia on parempi kuin fluoresoivat helmet antinukleaaristen vasta-aineiden reaktiivisuuden havaitsemiseksi systeemisessä lupus erythematosus -potilaissa. Clin Immunol. 2007; 124: 18-21.
- Nifli AP, Notas G, Mamoulaki M et ai. Multipleksi-, helmipohjaisen fluoresoivan määrityksen ja immunofluoresenssimenetelmien vertailu ANA- ja ANCA-autovasta-aineiden havaitsemiseksi ihmisen seerumissa. J Immunol Methods. 2006; 311: 189-197.
- Shovman O, Gilburd B, Zandman-Goddard G et ai. Multipleksoitu AtheNA-monilyytti-immunomääritys ANA-seulontaan autoimmuunisairauksien yhteydessä. Autoimmuniteetti. 2005; 38: 105-109.
- Ulvestad E. Hybridi-ELISA: n suorituskykyominaisuudet ja kliininen hyöty ANA: n havaitsemiseksi. Apmis. 2001; 109: 217-222.
- Olaussen E, Rekvig OP. Antinukleaaristen vasta-aineiden (ANA) seulontatestit: Keskushermoston antigeenien valikoiva käyttö järkevänä perustana seulonnalle ELISA: lla. J Autoimmun. 1999; 13: 95-102.
- Homburger HA, Cahen YD, Griffiths J, Jacob GL. Antinukleaaristen vasta-aineiden havaitseminen: Entsyymi-immunomäärityksen ja epäsuorien immunofluoresenssimenetelmien vertaileva arviointi. Arch Pathol Lab Med. 1998; 122: 993-999.
- Gniewek RA, Stites DP, McHugh TM, Hilton JF, Nakagawa M.Ydinvastaisten vasta-aineiden testausmenetelmien vertailu: immunofluoresenssimääritys versus entsyymi-immunomääritys. Clin Diagn Lab Immunol. 1997; 4: 185-188.
- Reichlin M. DNA: n, SM: n ja RNP: n vasta-aineet. Ajantasalla. Lokakuu 2008.
- Hahn BH. DNA: n vasta-aineet. Uusi Engl J Med. 1998; 338: 1359.
- Kavanaugh AF, Solomon DH, American College of Rheumatology Ad Hoc Committee on Immunologic Testing Guidelines. Ohjeet immunologisiin laboratoriotesteihin reumaattisissa sairauksissa: Anti-DNA-vasta-ainetestit. Niveltulehdus Rheum. 2002; 47: 546-555.
- Benito-Garcia E, Schur PH, Lahita R.Suositukset immunologisiin laboratoriotesteihin reumaattisissa sairauksissa: Anti-Sm- ja Anti-RNP-vasta-ainetestit. Niveltulehdus Rheum. 2004; 51: 1030-1044.
- Reichlin M.Ro / SSA- ja anti-La / SSB-vasta-aineiden kliininen merkitys. Ajantasalla. Lokakuu 2008.
- Reveille JD, Sherrer YRS, Solomon DH, Schur P, Kavanaugh A.Ilmoitetut perustelut immunologisten laboratoriotestien käytölle: Anti-Ro (SS-A) ja La (SS- B): ACR Ad Hoc -komitean raportti immunologisten testien ohjeista. Lähetetty julkaistavaksi.
- Reichlin M. antiribosomaaliset P-proteiinivasta-aineet. Ajantasalla. Lokakuu 2008.
- Denton CP. Skleroderman luokitus. Ajantasalla. Lokakuu 2008.