蒸気圧の低下
液体と固体の章で説明したように、液体の平衡蒸気圧は、その気体によって加えられる圧力です。気化と凝縮が同じ速度で発生しているときのフェーズ:
\ text {liquid} \ rightleftharpoons \ text {gas}
不揮発性物質の溶解揮発性の液体では、液体の蒸気圧が低下します。この現象は、追加された溶質分子が液体の気化および凝縮プロセスに及ぼす影響を考慮することで合理化できます。気化するには、溶媒分子が溶液の表面に存在する必要があります。溶質の存在は、溶媒分子が利用できる表面積を減少させ、それによって溶媒の気化速度を低下させます。凝縮速度は溶質の存在による影響を受けないため、最終的な結果として、気相中の溶媒分子が少なくなると(つまり、蒸気圧が低くなると)、気化と凝縮の平衡が達成されます(図1)。この速度論的解釈は有用ですが、蒸気圧低下の束一性のいくつかの重要な側面を説明していません。より厳密な説明には、エントロピーの特性が含まれます。これは、熱力学に関する後のテキストの章で説明するトピックです。液体の蒸気圧の低下を理解するために、個別の溶媒および溶質と比較して溶液のエントロピーが大きいことは、溶媒分子を効果的に安定化し、それらの気化を妨げるのに役立つことに注意するのが適切です。このモジュールの次のセクションで説明するように、蒸気圧が低くなり、それに応じて沸点が高くなります。
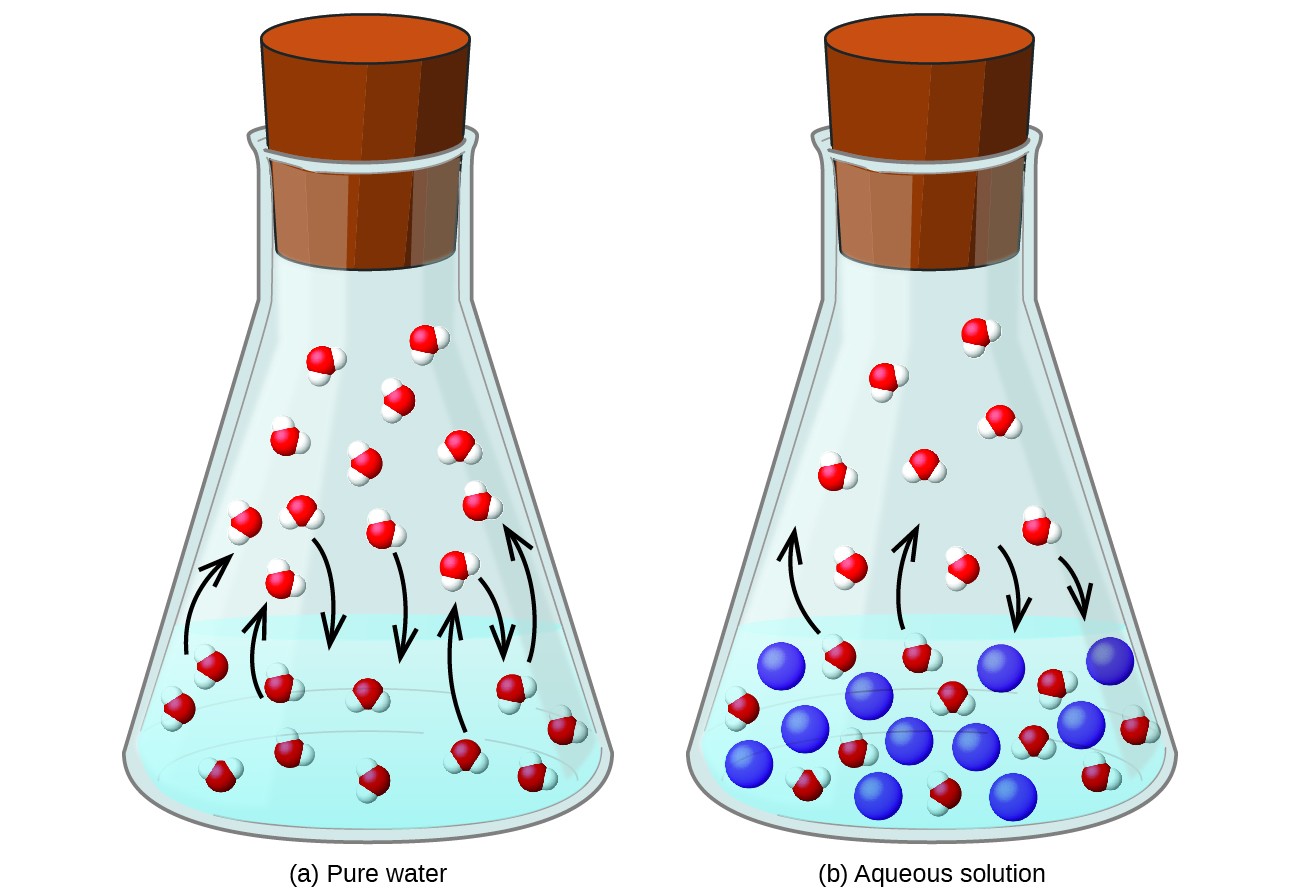
図1.不揮発性溶質の存在は、溶媒分子の蒸発を妨げることにより、溶液の蒸気圧を低下させます。
溶液成分の蒸気圧との濃度の関係これらの成分は、Raoultの法則によって説明されます。理想的な溶液の任意の成分によって加えられる部分圧力は、純粋な成分の蒸気圧に溶液中のそのモル分率を掛けたものに等しくなります。
{P} _ {\ text {A}} = {X} _ {\ text {A}} {P} _ {\ text {A}} ^ {\ star}
気体混合物の全圧がそのすべての成分の分圧の合計に等しいことを思い出すと(ダルトンの分圧の法則)、i個の成分を含む溶液によって加えられる全蒸気圧は
{ P} _ {\ text {solution}} = \ sum _ {i} {P} _ {i} = \ sum _ {i} {X} _ {i} {P} _ {i} ^ {\ star}
不揮発性物質とは、蒸気圧が無視できる物質(P ^ {\ star}≈0)であるため、不揮発性溶質のみを含む溶液の上の蒸気圧は、溶媒のみによるものです。
{P} _ {\ text {solution}} = {X} _ {\ text {solvent}} {P} _ {\ text {solvent}} ^ {\スター}
溶液の蒸留
蒸留は、実験室と産業環境の両方で広く適用されている混合物の成分を分離するための技術です。石油の精製、発酵生成物の分離、水の浄化に使用されます。この分離技術には、サンプル混合物の制御された加熱が含まれ、目的の1つまたは複数の成分を選択的に気化、凝縮、および収集します。実験室規模の蒸留の典型的な装置を図2に示します。

図2.典型的な実験室用蒸留装置は、(a)写真と(b)コンポーネントの概略図に示されています。 (クレジットa:「Rifleman82」/ウィキメディアコモンズによる作業の変更;クレジットb:「Slashme」/ウィキペディアによる作業の変更)
石油精製所は、大規模な分別蒸留を使用して原油の成分。原油は、背の高い分留塔の基部で高温に加熱され、塔内で上昇する多くの成分を気化します。気化した成分は、上昇中に十分に冷却されたゾーンに到達すると、凝縮して収集されます。収集された液体は、図3に示すように、さまざまな用途(ディーゼル燃料、灯油、ガソリンなど)に適した組成の炭化水素と他の石油化合物のより単純な混合物です。

図3.原油は、さまざまな単純な混合物を分離するために大規模な分別蒸留によって分離される複雑な混合物です。
沸騰点の上昇
液体と固体の章で説明したように、液体の沸騰点は、その蒸気圧が周囲の大気圧に等しくなる温度です。不揮発性溶質の存在により溶液の蒸気圧が低下するため、溶液の沸点がその後上昇するのは当然のことです。したがって、純粋な溶媒と比較して、溶液は、周囲の大気の蒸気圧と同等のものを含め、任意の蒸気圧を達成するためにより高い温度を必要とします。不揮発性溶質を溶媒に溶解したときに観察される沸点上昇ΔTbは沸点上昇と呼ばれ、溶質種のモル濃度に正比例します。
\ Delta {T} _ {\ text {b}} = {K} _ {\ text {b}} m
ここで、Kbは沸点上昇定数、または沸騰定数であり、mはすべての溶質種のモル濃度(モル濃度)。
沸点上昇定数は、溶媒の正体に依存する特徴的な特性です。いくつかの溶媒のKbの値を表1に示します。
溶媒の蒸気圧が低下し、沸点が上昇する程度は、特定の量に存在する溶質粒子の総数によって異なります。粒子の質量やサイズ、化学的同一性ではなく、溶媒の量。スクロースの1m水溶液(342 g / mol)とエチレングリコールの1 m水溶液(62 g / mol)は、各溶液に溶媒1 kgあたり1モルの溶質粒子(分子)があるため、同じ沸点を示します。 。
例6:ヨウ素溶液の沸点
800.0gのクロロホルムCHCl3に92.1gのヨウ素I2を溶かした溶液の沸点を求めます。 、ヨウ素が不揮発性であり、ソリューションが理想的であると仮定します。
学習内容を確認してください
1.0gの溶液の沸点はどれくらいですかグリセリン、C3H5(OH)3、47.8 gの水中?理想的なソリューションを想定します。
凝固点降下

図4.岩塩(氷を溶かすために、NaCl)、塩化カルシウム(CaCl2)、またはその2つの混合物が使用されます。 (クレジット:Eddie Welkerによる作業の変更)
溶液は純粋な液体よりも低い温度で凍結します。この現象は、塩(図4)、塩化カルシウム、または尿素を使用して道路や歩道の氷を溶かす「除氷」スキームや、自動車のラジエーターの「不凍液」としてエチレングリコールを使用する場合に利用されます。海水は淡水よりも低い温度で凍結するため、北極海と南極海は0°C未満の温度でも凍結しません(これらの海に生息する魚やその他の冷血の海の動物の体液も同様です)。
純粋な溶媒と比較した希薄溶液の凝固点降下ΔTfは凝固点降下と呼ばれ、溶質のモル濃度に正比例します
\ Delta {T} _ {\ text {f}} = {K} _ {\ text {f}} m
ここで、mは溶質のモル濃度です。溶媒とKfは、凝固点降下定数(または凝固点降下定数)と呼ばれます。沸点上昇定数と同様に、これらは特性であり、その値は溶媒の化学的同一性に依存します。いくつかの溶媒のKfの値を表1に示します。
束一性と除氷
塩化ナトリウムとそのグループ2の類似体である塩化カルシウムと塩化マグネシウムは、これらの塩のいずれかの溶液は、純水の凝固点である0°Cよりも低い凝固点を持つため、道路や歩道を除氷します。グループ2の金属塩は、NaClよりも腐食性がやや低く、凝固点のくぼみが大きいため、道路で使用するために安価で入手しやすい塩化ナトリウム(「岩塩」)と頻繁に混合されます。 、それらは解離して、塩化ナトリウムのような2つの粒子ではなく、式単位あたり3つの粒子を生成するためです。
これらのイオン性化合物は金属の腐食を促進する傾向があるため、で使用するのは賢明な選択ではありません。車のラジエーターの不凍液、または離陸前に飛行機の氷結を解消します。これらの用途では、エチレンやプロピレングリコールなどの共有結合化合物がよく使用されます。ラジエーター液に使用されているグリコールは、液体の凝固点を下げるだけでなく、沸点を上げるため、冬と夏の両方で有用です。冬の悪天候で離陸する前に、加熱されたグリコールが飛行機の表面に噴霧されて、すでに形成された氷を取り除き、航空機の操縦翼面に形成された場合に特に危険な氷の形成を防ぎます(図5)。

図5.氷点降下を利用して、(a)道路から氷を取り除きます。 (b)航空機の操縦翼面。
ソリューションのフェーズ図
蒸気圧、沸点、および氷点に対する協調効果前のセクションで説明した内容は、純粋な液体とその液体から得られた溶液の位相図を比較することで簡単に要約できます。水と水溶液の状態図を図6に示します。
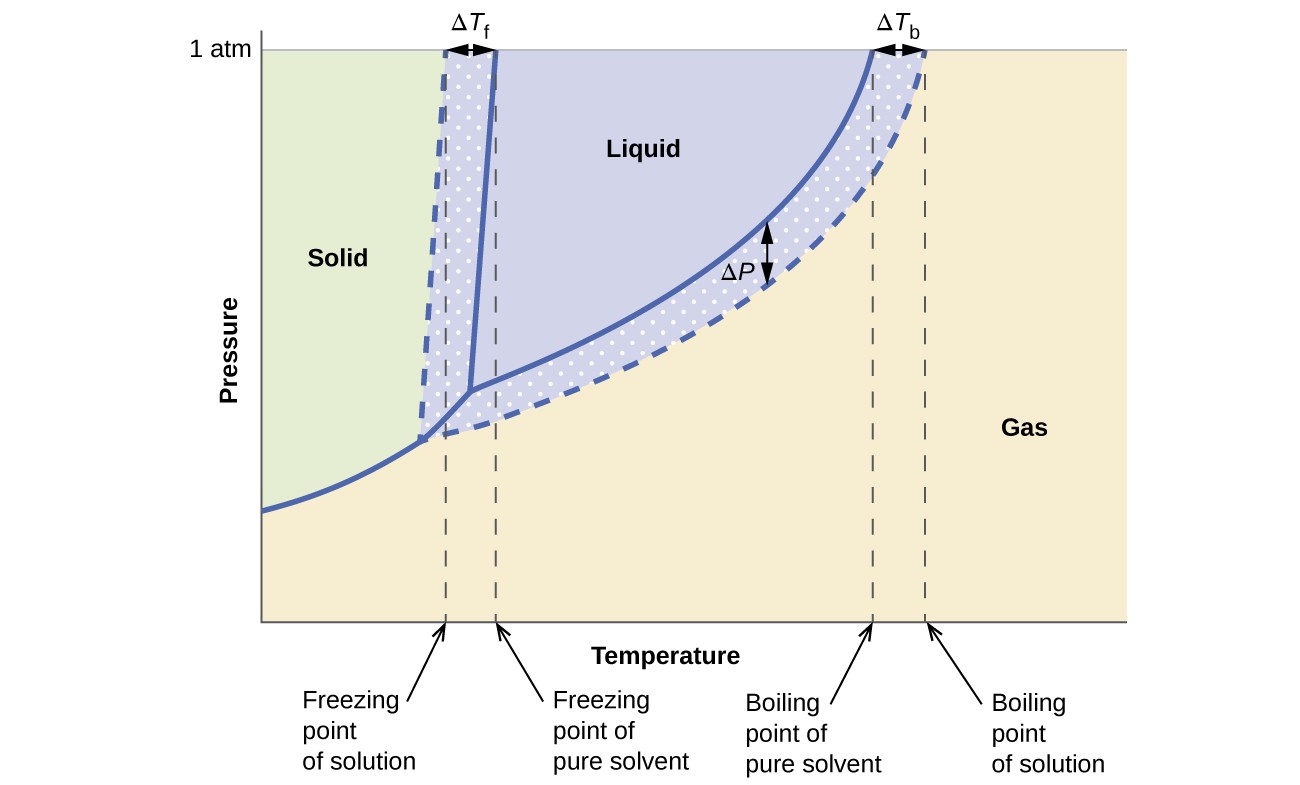
図6.これらの相図は、水(実線の曲線)と非電解質の水溶液(破線の曲線)を示しています。
溶液の気液曲線は、溶媒の対応する曲線の下にあり、蒸気を示しています。不揮発性溶質の溶解に起因する圧力低下ΔP。その結果、任意の圧力で、溶液の沸点は、不揮発性溶質の存在に関連する沸点上昇ΔTbを反映して、純粋な溶媒の沸点よりも高い温度で観察されます。溶液の固液曲線は、純粋な溶媒の固液曲線の左側に移動し、溶液の形成に伴う凝固点降下ΔTbを表します。最後に、溶媒とその溶液の固気曲線が同じであることに注意してください。これは、液体溶媒と不揮発性溶質を含む多くの溶液に当てはまります。気化の場合と同様に、この種の溶液を凍結すると、実際には液体から固体への転移を起こすのは溶媒分子だけであり、溶質種を除いた純粋な固体溶媒を形成します。したがって、固相と気相は溶媒のみで構成されているため、これらの相間の遷移は束一性の影響を受けません。
溶液の浸透圧と浸透圧
多くの自然合成材料は選択的な透過性を示します。つまり、特定のサイズ、形状、極性、電荷などの分子またはイオンのみが材料を通過(透過)できます。生体細胞膜は、自然界における選択的透過のエレガントな例を提供しますが、血液から代謝廃棄物を除去するために使用される透析チューブは、より単純な技術例です。製造方法に関係なく、これらの材料は一般に半透膜と呼ばれます。
図7に示す装置を検討してください。この装置では、純粋な溶媒と溶液のサンプルが、溶媒のみの膜によって分離されています。分子が浸透する可能性があります。溶媒分子は膜を横切って両方向に拡散します。溶媒の濃度は溶液よりも純粋な溶媒の方が高いため、これらの分子は膜の溶媒側から溶液側に逆方向よりも速い速度で拡散します。その結果、純粋な溶媒から溶液への溶媒分子の正味の移動が得られます。半透膜を介した溶媒分子の拡散駆動型移動は、浸透として知られるプロセスです。
図7.(a)溶液と純粋な溶媒は、最初に浸透膜によって分離されます。 (b)溶媒分子の溶液への正味の移動は、浸透圧が両方向に等しい移動速度をもたらすまで発生します。
浸透が図7に示すような装置で実行される場合、溶媒の蓄積によって希釈されると、溶液の体積が増加します。これにより、溶液のレベルが上昇し、静水圧が上昇し(チューブ内の溶液のカラムの重量のため)、溶媒分子が純粋な溶媒側にすばやく移動します。圧力が浸透速度に等しい逆溶媒移動速度をもたらす値に達すると、溶媒のバルク移動は停止します。この圧力は、溶液の浸透圧(Π)と呼ばれます。希薄溶液の浸透圧は、方程式
\ Pi = MRT
に従って、溶質のモル濃度Mと絶対温度Tに関連しています。
ここで、Rはユニバーサルガス定数です。
図8に示すような装置に溶液を入れると、溶液の浸透圧よりも高い圧力を加えると浸透が逆転し、溶媒分子が溶液から純粋な溶媒に押し出されます。この逆浸透技術は、海水の大規模な淡水化と小規模な飲料用の高純度水道水を生成するために使用されます。
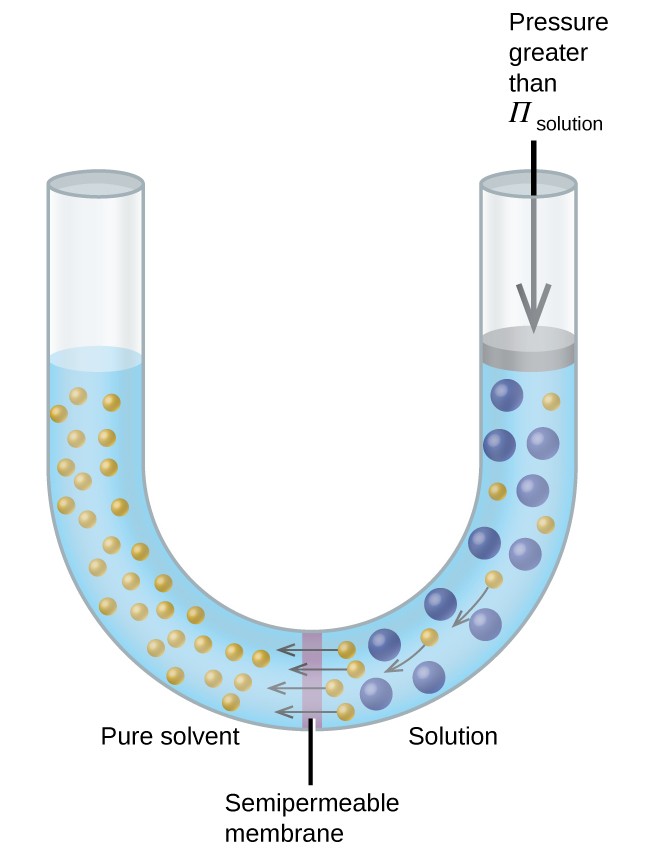
図8.溶液の浸透圧よりも高い圧力を加えると、浸透が逆転します。溶液からの溶媒分子は純粋な溶媒に押し込まれます。
逆浸透水の浄化
浸透の過程で、拡散は水を低濃度の溶液から高濃度の溶液への半透膜。浸透圧は、浸透を停止させるために、より濃縮された溶液に適用しなければならない圧力の量です。より大きな圧力が加えられると、水はより濃度の高い溶液からより濃度の低い(より純粋な)溶液になります。これは逆浸透と呼ばれます。逆浸透(RO)は、沿岸都市の淡水化プラントから食料品店の浄水機(図9)、および小型の逆浸透家庭用ユニットまで、多くの用途で水を浄化するために使用されます。手動ポンプを使用すると、小型のROユニットを第三世界の国々、被災地、救命ボートで使用できます。私たちの軍隊には、車両で遠隔地に輸送できるさまざまな発電機操作のROユニットがあります。

図9.飲料水を浄化するための逆浸透システムを(a)小規模および(b)大規模で示します。 (クレジットa:Jerry Kirkhartによる作業の変更、クレジットb:Willard J. Lathropによる作業の変更)
浸透の例は、細胞が半透膜に囲まれています。水を失ったためにしなやかになったにんじんやセロリは、水に入れることで再びカリカリになります。水は浸透によってニンジンまたはセロリの細胞に移動します。濃厚な塩溶液に入れられたキュウリは、浸透によって水分を失い、塩を吸収して漬物になります。浸透は動物細胞にも影響を与える可能性があります。溶液を体内に注入する場合、溶質濃度は特に重要です。体細胞液および血清中の溶質は、これらの溶液に約7.7気圧の浸透圧を与えます。体内に注入される溶液は、血清と同じ浸透圧を持っている必要があります。つまり、血清と等張である必要があります。低濃度の溶液である低張液を血清を希釈するのに十分な量で注入すると、希釈された血清からの水が浸透によって血球に流れ込み、細胞が膨張して破裂します。このプロセスは溶血と呼ばれます。より濃縮された溶液である高張液が注入されると、細胞はより濃縮された溶液に水分を失い、収縮し、おそらくクレネーションと呼ばれるプロセスで死にます。これらの効果を図10に示します。
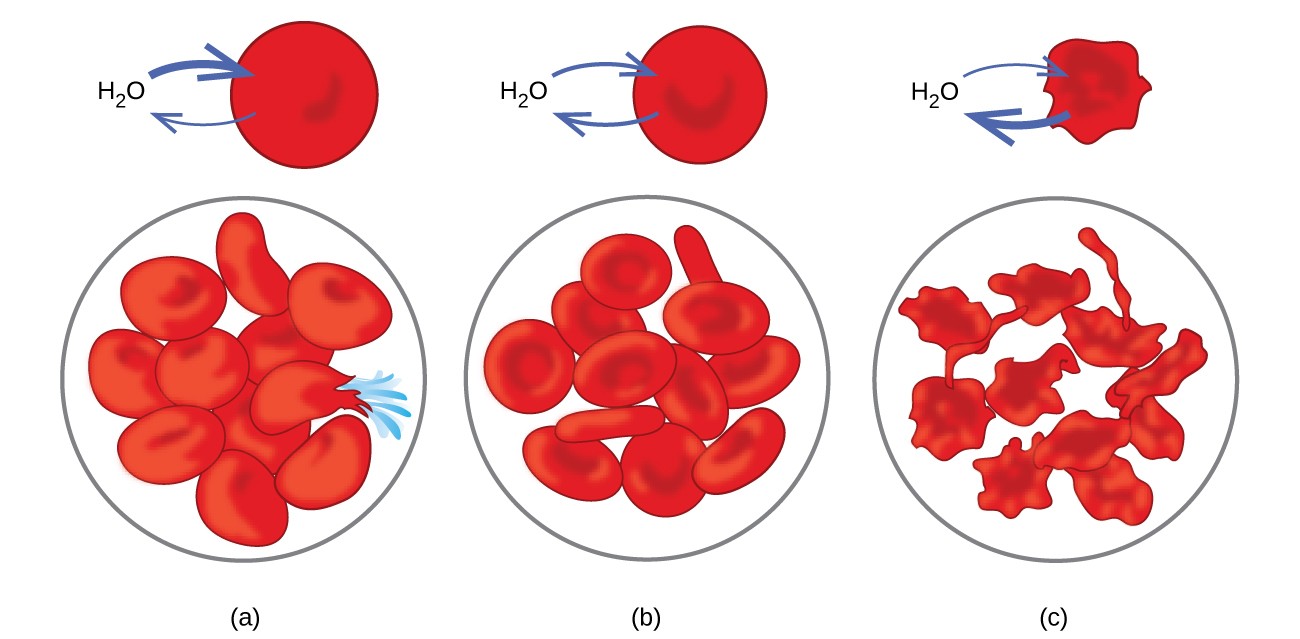
図10.赤血球膜は水透過性であり、 (a)低張液で膨潤し、場合によっては破裂する。 (b)等張液で通常の体積と形状を維持します。 (c)収縮し、高張液で死ぬ可能性があります。 (クレジットa / b / c:「LadyofHats」/ Wikimediacommonsによる作業の変更)
モル質量の決定
浸透圧と凝固点の変化、沸点点、および蒸気圧は、存在する溶質の濃度に正比例します。したがって、これらの特性の1つを測定して、測定値から溶質のモル質量を決定できます。
電解質の凝集特性
このモジュールで前述したように、溶液の凝集特性は、溶解した溶質種の数にのみ依存し、同一性には依存しません。さまざまな凝集特性(凝固点降下)の式の濃度項、沸点上昇、浸透圧)は、溶液中に存在するすべての溶質種に関係します。この章でこれまでに検討した溶液の場合、溶質は非電解質であり、解離やその他の付随するプロセスなしに物理的に溶解します。各モル濃度溶解するファイルは、1つの溶解した溶質分子を生成します。ただし、以下の2つの一般的な例に示すように、電解質の溶解はこれほど単純ではありません。
これらの例の最初の例を考慮し、完全に解離すると仮定すると、NaClの1.0 m水溶液には2.0モルのイオン(1.0モルのNa +と1)が含まれます。水1キログラムあたり0mol Cl-)であり、その凝固点降下は
ただし、この溶液を実際に調製して凝固点降下を測定すると、3.4°Cの値が得られます。他のイオン性化合物についても同様の不一致が観察され、溶質濃度が増加するにつれて、測定された束一性の値と期待される束一性の値の差がより顕著になります。これらの観察結果は、塩化ナトリウム(およびその他の強電解質)のイオンが溶液中で完全に解離していないことを示唆しています。
これを説明し、全解離の仮定に伴うエラーを回避するために、実験的に測定されたパラメータノーベル賞を受賞したドイツの化学者ヤコブスヘンリカスヴァントホフの名誉が使用されます。ファントホッフ係数(i)は、溶解した式単位の数に対する溶液中の溶質粒子の比率として定義されます。
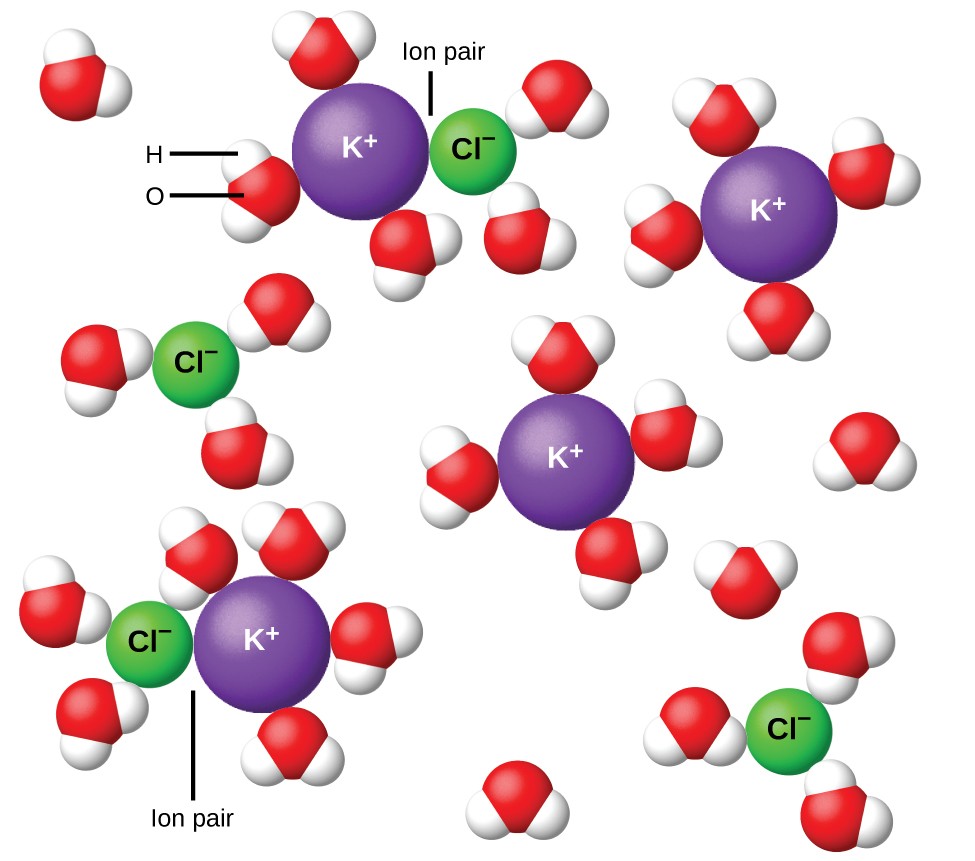
図11.溶液が希釈されるほど、イオンはますます広く分離されます。
1923年、化学者のPeter DebyeとErichHückelは、強力な電解質の明らかな不完全なイオン化を説明する理論を提案しました。彼らは、水溶液中のイオン間引力は、イオンの溶媒和と極性溶媒の絶縁作用によって非常に大幅に減少するが、完全に無効になるわけではないことを示唆した。残りの引力は、イオンが完全に独立した粒子として振る舞うのを防ぎます(図11)。場合によっては、正イオンと負イオンが実際に接触して、イオンペアと呼ばれる溶媒和単位を与えることがあります。したがって、特定の種類のイオンの活性または有効濃度は、実際の濃度で示される濃度よりも低くなります。イオンはますます広く分離され、溶液が希釈されるほど、残留イオン間引力はますます少なくなります。したがって、非常に希薄な溶液では、イオンの有効濃度(それらの活性)は本質的に実際の濃度に等しくなります。表2の電解質のファントホフ係数は0.05mの溶液の場合であり、NaClのiの値は理想的な値の2ではなく1.9です。
例11:電解質溶液の凝固点
海水中のイオン濃度は、125gの水に4.2gのNaClを溶解した溶液の場合とほぼ同じです。 NaCl溶液中の各イオンが非電解質分子と同じように水の凝固点に影響を与えると仮定し、溶液の凍結温度(海水の凍結温度にほぼ等しい)を決定します。
学習内容を確認します
塩化カルシウム、CaCl2、の各イオンが非電解質分子と同じ効果が水の凝固点にあります。 175gの水に0.724gのCaCl2を溶かした溶液の凝固点を計算します。
試してみる
- 肉は-1で保存されていても、新鮮(冷凍ではない)として分類できます°C。なぜこの温度で肉が凍らないのですか?
- 有機化合物の組成は、93.46%Cと6.54%Hです。 1.10gの樟脳に0.090gのこの化合物を溶かした溶液は、158.4°Cで溶けます。純粋な樟脳の融点は178.4°Cです。樟脳のKfは37.7°C / mです。溶質の分子式は何ですか?計算を表示します。
- 塩はアルカリ金属フッ化物であることが知られています。凝固点の簡単な概算は、100gの水に溶解した4gの塩が約-1.4°Cで凍結する溶液を生成することを示しています。塩の式は何ですか?計算を表示します。
用語集
活性:溶液中のイオンの有効濃度。イオン相互作用のため、実際の濃度よりも低くなります。
沸点上昇:溶質の添加による液体の沸点上昇
沸点上昇定数:沸点上昇を溶質モル濃度に関連付ける方程式の比例定数。エブリオスコピック定数とも呼ばれます
凝集特性:溶質種の濃度のみに依存する溶液の特性
生成:水分の損失により生体細胞が収縮するプロセス浸透による
凝固点降下:溶質の添加による液体の凝固点降下
凝固点降下定数:(また、極低温定数)関連する式の比例定数凝固点降下から溶質モル濃度へ
溶血:浸透による過剰な水分の蓄積による赤血球の破裂
高張:より高い浸透圧
低張:浸透圧が低い
イオンペア:中程度の静電引力によって一緒に保持された溶媒和アニオン/カチオンペア
等張性:浸透圧が等しい
モル濃度(m) :溶質のモル数と溶媒の質量のキログラム単位の比率として定義される濃度単位
モル分率(X):すべての溶液成分の総モル数に対する溶液成分のモル量の比率
浸透:半透膜を介した溶媒分子の拡散
浸透圧(Π ):半透膜を介した溶媒分子のバルク移動を防ぐために必要な反対の圧力
ラウルトの法則:溶液成分によって加えられる部分圧力は、溶液中の成分のモル分率とその平衡の積に等しい純粋な状態での蒸気圧
半透膜:特定のイオンまたは分子の通過を選択的に許可する膜
ファントホフ因子(i):モル数の比率溶液に溶解した式単位の分子数に対する溶液中の粒子の割合
- 比較のために示されている非電解質。 ↵

