悪性血管内炎症
敗血症は、悪性血管内炎症のプロセスと呼ばれています。通常、強力で複雑な免疫学的カスケードは、ヒトへの微生物の侵入に対する迅速な防御反応を保証します。免疫防御が不十分な場合、感染が確立される可能性があります。ただし、過剰または不十分に調節された応答は、固有に生成された炎症性化合物の不適応な放出を通じて宿主に害を及ぼす可能性があります(下の画像を参照)。
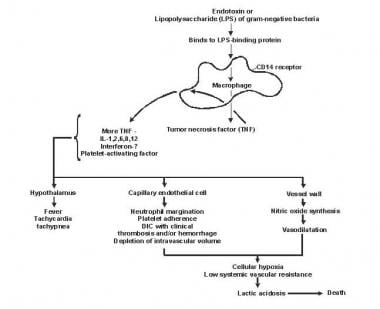 敗血症と多臓器不全の病因。
敗血症と多臓器不全の病因。 リピドAやその他の細菌製品は、敗血症の臨床症状を媒介するサイトカインやその他の免疫調節物質を放出します。インターロイキン、腫瘍壊死因子(TNF)-α、インターフェロンガンマ(IFN-γ)、およびその他のコロニー刺激因子は、単球およびマクロファージと脂質Aとの相互作用後数分または数時間以内に急速に産生されます。
炎症性メディエーターの放出は自己刺激プロセスになり、インターロイキン(IL)-1、血小板活性化因子、IL-2、IL-6、IL-8、IL-10を含む他のそのようなメディエーターの放出、および一酸化窒素(NO)は、サイトカインレベルをさらに増加させます。これにより、多形核白血球(PMN)、マクロファージ、およびリンパ球の継続的な活性化がもたらされます。炎症誘発性メディエーターはこれらの細胞をより多く動員します。これらのプロセスはすべて、破壊的な免疫学的不協和の状態を作り出します。
敗血症は、感染に対する正常な病態生理学的反応の延長を可能にし、そうでなければ正常な組織と結果を伴う自己破壊的プロセスとして説明されます。 MODSで。臓器機能障害または臓器不全は敗血症の最初の臨床的兆候である可能性があり、炎症性の過剰な敗血症の結果から免疫がある臓器系はありません。臓器不全が増加すると死亡率が増加します。
制御されていませんが、MODSが発症すると、炎症誘発性と抗炎症性の両方のアップレギュレーションの全身的証拠が通常存在し、宿主防御の恒常性の失敗を示唆しますは、出血性ショックで発生する可能性のある単純な低血圧誘発性の末端器官損傷ではなく、敗血症からMODSへの最終経路です。 MODSによる重症敗血症からの生存は、通常、炎症誘発性反応と抗炎症反応の両方の一般的な減少と関連しています。
最近、重症敗血症からの生存には以下のことが必要であるという新しい仮説が浮上しました。体の免疫反応、エネルギー機能、および関連する臓器のパフォーマンスの一般的なダウンレギュレーション。したがって、MODSは、圧倒的な炎症に対する宿主の適応反応によって、永続的な末端器官の損傷を引き起こすことなく炎症を解消することができます。以下で説明するように、すべての臓器は、明らかに健康状態が異常であるが、重症敗血症の生存戦略を示す可能性のある一般的な反応低下を示します。
臓器系の機能障害
循環障害
循環の自動調節における重大な障害は、敗血症に典型的です。血管作用性メディエーターは血管拡張を引き起こし、感染部位の微小血管透過性を高めます。 NOは敗血症性ショックの血管拡張において中心的な役割を果たします。また、バソプレシンの分泌障害が発生する可能性があり、これにより血管拡張の持続が可能になる可能性があります。
敗血症では収縮期と拡張期の両方の心室機能の変化が発生します。フランクスターリングメカニズムを使用することにより、全身の血管拡張の存在下で血圧を維持するために心拍出量が増加することがよくあります。既存の心臓病の患者は、心拍出量を適切に増加させることができません。
地域的に、敗血症は臓器系への全身血流の正常な分布を妨げます。その結果、中核臓器は適切な酸素供給を受けない可能性があり、その結果は局所低灌流として知られています。
血管内皮は敗血症であるため、微小循環は敗血症の損傷の主要な標的臓器です。循環する炎症性メディエーターによって普遍的に影響を受ける。微小循環異常が臓器損傷の原因なのか無実の傍観者なのかは不明ですが、明らかな微小血管機能障害が見られます。灌流された毛細血管の数の減少が見られますが、血管拡張療法の適用により、完全な微小血管の動員が起こります。ミトコンドリア機能障害も発生し、酸化的リン酸化を促進するために必要なミトコンドリア膜電位勾配の低下に関連していることがよくあります。最終的な結果は、末端器官が酸素を最大限に抽出することが明らかにできないことです。
このエネルギー代謝の失敗が冬眠に似た適応細胞保護メカニズムであるのか、それとも一次ミトコンドリアの病理を反映しているのかについては議論が続いています。これらは活発な研究分野ですが、現時点では明確な診療ガイドラインに変換されていません。毛細血管内皮透過性の増加は、タンパク質が豊富な組織浮腫の蔓延につながります。
敗血症性ショックとSIRSは、カテコールアミンと輸液に耐性があることが証明される可逆的な心筋抑制を特徴としています。循環する「心筋抑制因子」(おそらくTNF-α、IL-1β、他のサイトカイン、およびNOの相乗効果を表す)は、病因に関係しています。この急性ストレス心筋抑制の2つの特徴は、アドレナリン作動性応答性の障害と拡張機能障害であり、相対的なカテコールアミン耐性と拡張した心臓ではなく小さい心臓。大血管心筋虚血と低灌流が原因である可能性は低いです。
重度の敗血症と敗血症性ショックでは、微小循環機能障害とミトコンドリアうつ病が局所組織の苦痛を引き起こします。したがって、この状態は微小循環および心筋障害症候群(MMDS)と呼ばれます。敗血症によって誘発される炎症性自己調節機能障害は持続し、酸素の必要性は供給と一致せず、MODSにつながります。
動脈血管緊張の低下、静脈ジからの静脈還流の低下に起因する血管内液量の再分布
肺機能障害
肺血管系の内皮損傷は障害を引き起こします毛細血管の血流と微小血管透過性の増強により、間質性および肺胞性浮腫を引き起こします。肺微小循環内の好中球の捕捉は、肺胞毛細血管膜への損傷を開始および増幅します。急性肺損傷および急性呼吸窮迫症候群(ARDS)は、これらの影響の頻繁な症状です。確かに、敗血症と肺炎はARDSの最も一般的な原因です。
胃腸機能障害
胃腸(GI)管は敗血症の損傷を広めるのを助けます。上部消化管での細菌の異常増殖は、肺に吸引され、院内または誤嚥性肺炎を引き起こす可能性があります。腸の正常なバリア機能が影響を受け、細菌、内毒素、および正常な消化プロテアーゼが全身循環に移行し、敗血症性反応が拡大する可能性があります。
敗血症性ショックは原因となる可能性があります経腸栄養の開始を遅らせる可能性のある麻痺性イレウス。過剰なNO産生は、敗血症誘発性イレウスの原因物質であると考えられています。高タンパクと高カロリーの要件に直面して、最適なレベルの栄養摂取が妨げられます。麻薬と筋弛緩薬は、消化管の運動性をさらに悪化させる可能性があります。
肝機能障害
肝臓が果たす役割の結果として、宿主の防御において、肝機能障害によって引き起こされる異常な合成機能は、敗血症の開始と進行の両方に寄与する可能性があります。肝臓の細網内皮系は、バクテリアとその生成物を取り除く際の最初の防衛線として機能します。肝機能障害は、これらの製品の全身循環への波及につながります。
肝不全(「ショックを受けた肝臓」)は、肝酵素とビリルビンの上昇、凝固障害、および脳症の悪化につながるアンモニアなどの毒素の排出の失敗。
腎機能障害
急性腎障害(AKI)多くの場合、敗血症を伴います。AKIのさまざまな病因が報告されており、原因は通常多因子であると考えられています。AKIのメカニズムは複雑ですが、全身性低血圧、直接的な腎血管収縮、サイトカインの放出に起因する有効な血管内容量の減少を伴う可能性があります。それでも、ほとんどの動物実験では、敗血症では、尿細管機能の障害とtuの有意な組織学的証拠の欠如に関連しているものの、腎血流量が減少するのではなく、増加することが示されています。眼球損傷。
中枢神経系の機能障害
敗血症における中枢神経系(CNS)の関与は、脳症と末梢神経障害を引き起こしますニューロパシー。病因は十分に定義されていませんが、おそらく全身性低血圧に関連しており、脳の低灌流につながる可能性があります。
凝固障害
無症候性凝固障害。トロンビン時間(TT)または活性化部分トロンボプラスチン時間(aPTT)の軽度の上昇、または中程度の低下によって示されます。血小板数は非常に一般的です。ただし、明白な播種性血管内凝固症候群(DIC)も発症する可能性があります。プロテアーゼ活性化受容体(PAR)、特にPAR 1は、凝固と炎症の間の分子リンクを形成します。 PAR1は、活性化プロテインCまたは低用量トロンビンによって刺激されると細胞保護効果を発揮しますが、高用量トロンビンによって活性化されると内皮細胞バリア機能に破壊的な効果を発揮します。
臓器機能障害と損傷のメカニズム
敗血症における細胞損傷とその結果としての臓器機能障害の正確なメカニズムは完全には理解されていません。 MODSは、広範な内皮細胞および実質細胞の損傷に関連しており、その一部は、次の4つの提案されたメカニズムによって説明できます。
低酸素性低酸素症
敗血症性循環病変は、組織の酸素化を妨害し、組織の酸素供給の代謝調節を変化させ、臓器機能不全の一因となります。微小血管および内皮の異常は、敗血症における敗血症性微小循環障害の一因となる。活性酸素種、溶解酵素、および血管作用物質(例えば、NOおよび内皮成長因子)は、微小循環障害を引き起こし、これは、赤血球が敗血症性微小循環をナビゲートできないことによって悪化します。
直接的な細胞毒性
エンドトキシン、TNF-α、およびNOは、ミトコンドリアの電子伝達に損傷を与え、エネルギー代謝の障害を引き起こす可能性があります。これは細胞変性または組織毒性無酸素症と呼ばれ、酸素が存在していても酸素を利用することができません。
アポトーシス
アポトーシス(プログラムされた細胞死)は、機能不全の細胞が通常排除される主要なメカニズムです。炎症誘発性サイトカインは、活性化されたマクロファージおよび好中球のアポトーシスを遅らせる可能性がありますが、他の組織(例えば、腸上皮)は、加速されたアポトーシスを受ける可能性があります。したがって、アポトーシスの混乱は敗血症の組織損傷において重要な役割を果たします。
免疫抑制
炎症誘発性と抗炎症メディエーターは、それらの間の不均衡につながる可能性があります。炎症反応または免疫不全が優勢であるか、あるいはその両方が存在する可能性があります。
宿主反応および転帰に影響を与えるその他の要因
重症度に関連する臨床的特徴敗血症の例には、感染に対する宿主の反応、感染の部位と種類、抗菌療法のタイミングと種類、問題のある生物、ショックの発症、基礎疾患、患者の長期的な健康状態、および失敗した数が含まれます臓器。敗血症および敗血症性ショックにつながる要因は、最終的な結果を決定する上で必須ではない場合があります。
敗血症に対する宿主の反応は、炎症誘発性反応と抗炎症性免疫抑制反応の両方によって特徴付けられます。これらの反応の方向、程度、および持続時間は、宿主因子(例えば、遺伝的特徴、年齢、併存する病気、投薬)および病原体因子(例えば、微生物負荷、病原性)の両方によって決定されます。
炎症反応は、病原体によって発現される病原体関連分子パターンと、細胞表面の宿主細胞によって発現されるパターン認識受容体(トール様受容体およびC型)との相互作用によって開始されます。レクチン受容体)、エンドソーム(TLR)、または細胞質(レチノイン酸誘導性遺伝子1様受容体およびヌクレオチド結合オリゴマー化ドメイン様受容体)。
誇張された炎症の結果は、側副組織の損傷と壊死性細胞死であり、損傷関連分子パターン、いわゆる危険分子が放出され、少なくとも炎症を永続させます。一部には、病原体によって引き起こされる同じパターン認識受容体に作用することによって。