- 高濃度の抗体(力価> 1:640)が存在すると、自己免疫疾患が疑われるはずです。現在。このシナリオでは、dsDNA、Sm、RNP、Ro(SS-A)、La(SS-B)、およびおそらくScl-70に対する抗体について血清をテストすることをお勧めします。これらのいずれかに対する抗体の存在は、患者がSLE、MCTD、シェーグレン、または強皮症を患っている可能性を大幅に高めます。一部のラボでは、ANAのスクリーニングが陽性の場合は常に、これらの抗体を自動的にテストします。しかし、これらの抗体の存在は病気の診断にはなりません。初期診断ができない場合は、ANA関連疾患の発症を注意深く観察し、少なくとも年に2回は患者を診察するのが私の習慣です。
- 低力価の組み合わせ抗体(< 1:80)があり、病気の兆候や症状がないか、ほとんどない場合は、自己免疫疾患の可能性がはるかに低くなります。その結果、ANA力価が低いこれらの患者は、臨床症状が自己免疫疾患を示唆するように進展しない限り、毎年、再評価の頻度を減らす必要があります。
- ANAが陰性の患者は、SLE、MCTDのいずれかを有する可能性はほとんどありません。 、シェーグレン症候群、または強皮症。ただし、全身性自己免疫疾患の強力な臨床的証拠がまだある場合は、二本鎖(ds)DNA、Sm、RNP、Ro、La、またはScl-70に対する特異的抗体をテストできますが、私の経験では、それらは通常負です。それでも、少なくとも年に1回、疑惑の臨床指標が高い患者を見るのは賢明です。ただし、臨床的に適応がある場合はより頻繁に行われます。
- 抗核抗体は、さまざまな染色パターン(均一、びまん性)を生成します。 、末梢、縁、斑点、核小体、抗セントロメアなど)。核染色パターンは、さまざまな自己免疫疾患に対して比較的低い感度と特異性を持っていることが認識されています。通常、特定の核抗原に向けられた抗体の存在がより有用です。 (これらの抗体には、dsDNA、Sm、RNP、Ro、La、またはScl-70が含まれます。)
過去数年間、研究者やバイオテクノロジー企業は固相を開発してきました。 IF ANAテストに代わるイムノアッセイ。4-23この試みの背後にある理論的根拠は、IF技術の性能特性に関連しています。このテストは非常に手間がかかり、技術者による解釈の違いにより変動する可能性があります。また、蛍光顕微鏡で検査される画像の退色もテストを複雑にします。さらに、IF技術は患者の血清の段階希釈を使用するため、線形ではない可能性のある結果が得られます。同じサンプルでの日常のテストでは、力価の2倍の変動が一般的です。 4倍の違いは「重要」と言われています。対照的に、固相イムノアッセイは自動化されており、再現性が高いです。結果は直線的であり、この手法は労力がかからないため、実行コストが低くなります。
これらの考慮事項により、 ANAを定量化するために固相イムノアッセイを採用しているため、固相ANAイムノアッセイを開発する試みにおいて、より具体的なANAイムノアッセイで通常アッセイされる抗原(例えば、DNA、 Sm、RNP、Ro / SSA、La / SSB、ヌクレオプロテイン、細胞抽出物など)公表された報告では、ANA力価とこれらの固相アッセイとの相関係数は非常に良好であるため、多くの営利企業がANAを切り替えています。ただし、懸念されるのは、既知のSLEおよび関連疾患の患者における偽陰性の結果の頻度/割合が高いこと、および「偽陽性」の頻度が高いことです(例:誰かのポジティブANAこれらの研究では、SLEなし)15-21 SLEおよび関連疾患の患者がこれらの固相免疫測定法によって見逃されないようにするために、これらの固相免疫測定法の感度、特に特異性を改善するためのさらなる作業が必要です。
DNAに対する抗体
DNAに対する抗体は、主に一本鎖(ss)DNAと反応する抗体とdsDNAを認識する抗体に分けられます。24-26
Anti- ssDNA抗体は、SLE、関節リウマチ、薬物関連狼瘡、SLE患者の健康な近親者、そしてまれに他のリウマチ性疾患で報告されています。 (17ページの表2を参照。)したがって、抗ssDNAは、SLEまたは他のリウマチ性疾患の診断に対する有用性が限られています。抗ssDNAは疾患活動性と十分に相関しないため、疾患管理には役立ちません。
dsDNAに対する抗体は、固相イムノアッセイによって最も頻繁に検出されますが、一部のラボではクリチディアIFアッセイまたは時折ファーラジオイムノアッセイ。ほとんどの病院および商業ラボは1つしか実行しません。 Farrアッセイは、SLEの診断のための3つのアッセイの中でおそらく最高の特異性と最低の感度を持っていますが、固相アッセイは最高の感度と最低の特異性を持っています。クリチディアアッセイはその中間にあります。 Farrアッセイには、ほとんどのラボが避けている放射性物質を使用するという欠点もあり、クリチディアテストは非常に労働集約的です。私は日常使用のELISAアッセイを好みます。
抗dsDNAはSLEに特異的(95%)ですが、感度は高くありません(70%)ので、陽性の場合の診断に非常に役立ちます9(表2を参照)。 、p。17。)それらは、リウマチ性関節炎、若年性関節炎、薬物誘発性狼瘡、自己免疫性肝炎、さらには正常な人を含む他の状態で時折見られます。
抗dsDNA抗体のタイトルはしばしば変動します疾患活動性、特にループス腎炎を伴うため、SLEの経過をたどるために多くの患者に有用です。患者の力価が上昇している、または非常に高い力価であるが、臨床的に静止している場合、私は血清学的異常を治療しませんが、臨床的に正当な理由がある場合は、患者をより厳密に追跡して治療する必要があるという警告サインと見なします。治療法の変更。しかし、一部の研究者はこれらの血清学的異常を治療し(特に低補体レベルに関連する場合)、臨床転帰の改善を報告しています。逆に、治療を減らすためのガイドとして、治療のフレア後に良くなっている人の力価の低下を使用します(例、コルチコステロイドおよび/または免疫抑制剤)。
抗dsDNA抗体と他のSLEの病気の症状ははるかに明確ではありません。たとえば、抗dsDNA力価と神経精神医学的SLEの疾患活動性との間に関係はありません。
活動性狼瘡の症状を、感染性合併症や薬物の毒性作用、および無関係の疾患と区別することは常に課題です。抗dsDNA抗体の存在は、この区別をする上で一部の患者に役立つ可能性があります。
抗スミスおよび抗リボ核タンパク質抗体
スミス(Sm)および抗リボ核タンパク質に対する抗体(抗RNP)は固相イムノアッセイによって最も頻繁に検出されます。24,27
抗Sm抗体はSLE患者の10%から40%にしか見られませんが、SLE患者では非常にまれです。他の条件(すなわち、それらは敏感ではありませんが、非常に特異的です)。抗Sm力価の測定は、特に抗DNA抗体が検出できない場合に、診断に役立つ可能性があります。ただし、抗Smの感度が比較的低いことを考えると、負の値はSLEの診断を除外するものではありません。
抗RNP抗体は、SLE患者の約40%から60%に見られますが、 SLEに固有のものではなく、MCTDの定義機能です。これらの抗体は、RAや強皮症などの他のリウマチ性疾患でも低力価および低頻度で発生する可能性があります。 (17ページの表2を参照)
抗Sm抗体も抗RNP抗体の力価(レベル)も臨床活動と相関していません。
Anti-Ro / SSAおよび抗La / SSB抗体
Ro / SSAおよびLa / SSBに対する抗体は、固相イムノアッセイによって最も頻繁に検出されます。28,29抗Ro / SSAおよび抗La / SSBが検出されています。シェーグレン症候群の患者とSLEの患者だけでなく、感光性皮膚炎の患者、および健康な成人の0.1%から0.5%に高頻度で見られます。
Anti-Ro / SSA抗体は約50%に見られます。 SLE患者の。 (17ページの表2を参照。)これらは、光線過敏症、亜急性皮膚ループス、皮膚血管炎(触知可能な紫斑)、間質性肺疾患、新生児ループス、および先天性心臓ブロックに関連しています。抗Ro / SSA抗体は、原発性シェーグレン症候群の患者の約75%に見られ(表2、p。17を参照)、これらの抗体の高力価は、余分な腺の特徴、特に紫斑病や血管炎の発生率の増加と関連しています。対照的に、Ro / SSA抗体は、関節リウマチに関連する続発性シェーグレン症候群の患者の10%から15%にしか存在しません。したがって、原発性シェーグレン症候群が疑われる患者にRo / SSAまたは抗La / SSB抗体が存在することは、診断を強く支持します。
抗Ro抗体を有するSLE患者の約50%は、抗Ro抗体も持っています。 -La抗体、密接に関連するRNA-タンパク質抗原。同様に、シェーグレン症候群のほとんどの患者も抗La(SSB)抗体を持っています。抗Ro抗体のない抗La抗体を持つ患者を見つけることは非常にまれです。
私の意見では、抗Ro / SSAおよび抗La / SSB抗体検査を注文するための適応症は次のとおりです。
- 妊娠中またはSLEの女性将来妊娠する可能性があります。
- 心臓ブロックまたは心筋炎の子供を出産した経験のある女性。
- 原因不明の感光性皮膚発疹の病歴のある患者。
- SLEの疑いが強いが、ANAテストが陰性の患者。または
- 口内乾燥症、乾性角結膜炎、および/または唾液腺および涙腺の肥大の症状がある患者。
抗リボソームPタンパク質抗体
抗-リボソームPタンパク質抗体は、米国のSLE患者の10%から20%、アジアのSLE患者の40%から50%で検出されていますが、他のリウマチ性疾患ではめったに検出されていません30。すべての研究でこれが確認されているわけではありませんが、狼瘡関連精神病に特異的です。ループス患者のうつ病と腎および肝臓の関与も、いくつかの小規模な研究で抗リボソームPタンパク質抗体と関連しています。
感度が低く、臨床的相関が低いため、私を含む多くの研究者は、このテストでは臨床的有用性はほとんどありません。
抗セントロメア抗体
抗セントロメア抗体(ACA)は、皮膚全身性硬化症(lcSSc)が限られている患者、特にCREST.31 ACAは、CREST患者の57%で観察されていますが、レイノー現象のみの一部の患者を含む、他の状態の患者でも観察されています。 ACAは通常、Hep-2細胞の特徴的なIFパターンによって検出されます。
抗Scl-70(トポイソメラーゼ-1)抗体
強皮症患者の約15%から20% 70kdタンパク質(トポイソメラーゼ-1)に対する抗体があり、後にScl-70.31と名付けられます。通常の検出方法はELISAです。これらの抗体の存在は、強皮症患者の肺線維症のリスクを高めるようであり、この疾患に非常に特異的です。
要約
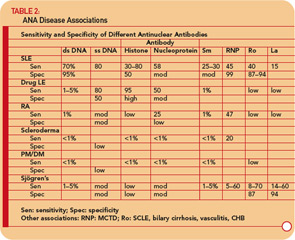
病歴に基づいてSLEが疑われる場合、身体的検査、および全血球計算(例、白血球減少症、血小板減少症)は、ANAテストを要求します。陰性の場合、患者がSLEを患っている可能性は非常に低く、患者は安心することができます。力価が< 1:160の場合、SLEの可能性は低く、SLEの可能性は低いと患者は安心できますが、定期的にフォローする必要があります。 1:160以上の力価は、SLEおよび関連する障害の可能性を高めます。ただし、ANAが陽性の人の85%はSLEを持っていないことを覚えておくことが重要です。 ANAが陽性の場合は、dsDNA、Sm、RNP、Ro / SSA、およびLa / SSBに対する抗体もテストする必要があります。これらの抗体の存在は、患者がSLEおよび関連する障害を持っている可能性を大幅に高め(表2、p。17を参照)、患者をより厳密に追跡する必要があります。抗セントロメアおよび抗Scl-70抗体の検出は、強皮症の診断に非常に役立ちます。 Ro / SSAおよびLa / SSBに対する抗体の検出は、シェーグレン症候群の診断にも役立ちます。
活動を監視するのに役立つこれらのテストの1つは、抗dsDNAだけです。
謝辞:UpToDate in Medicineの多くの著者の業績に感謝します。彼らの業績は、この論文の開発に役立つフレームワークを提供してくれました。ロバート・シュマーリング、デビッド・リー、ドナルド・ブロッホ。私はこの同じテーマについて論文や章を書いています。
博士。 Schurは、ハーバード大学医学部の医学教授であり、ボストンのブリガムアンドウィメンズ病院の医学部のリウマチ学、免疫学、およびアレルギーの部門です。
- ReichlinM。測定と臨床的意義抗核抗体。最新の。 2008年10月。
- 米国リウマチ学会の免疫学的検査ガイドラインに関する臨時委員会。リウマチ性疾患における免疫学的臨床検査のガイドライン:はじめに。関節炎リューム。 2002; 47:429-433。
- Solomon DH、Kavanaugh AJ、Schur PH、etal。免疫学的検査の使用に関するエビデンスに基づくガイドライン:抗核抗体検査。関節炎リューム。 2002; 47:434-444。
- Sinclair D、Saas M、Williams D、Hart M、Goswami R. ELISAは、抗核抗体の検出のために免疫蛍光法に取って代わることができますか?—抗核抗体の日常的な使用-核抗体スクリーニングELISA。クリンラボ2007; 53:183-191。
- Avaniss-Aghajani E、Berzon S、SarkissianA。核抗原に対する自己抗体の検出のための多重化ビーズベースのイムノアッセイの臨床的価値。 ClinVaccineImmunol。 2007; 14:505-509。
- Copple SS、Martins TB、Masterson C、Joly E、HillHR。臨床的に定義された血清を使用して抽出可能な核抗体に対する抗体を検出するための3つのマルチプレックスイムノアッセイの比較。 Ann N Y AcadSci。2007; 1109:464-472。
- Caramaschi P、Ruzzenente O、Pieropan S、etal。インフリキシマブ治療後の高力価でANA陽性の患者における多重蛍光ミクロスフェアイムノアッセイを使用したANA特異性の決定:予備的結果。 RheumatolInt。 2007; 27:649-654。
- Biagini RE、Parks CG、Smith JP、Sammons DL、RobertsonSA。複数のANAが陽性の狼瘡患者の血清におけるAtheNAMultiLyte ANAIIアッセイの分析性能。肛門生物肛門化学。 2007; 388:613-618。
- Gonzalez C、Garcia-Berrocal B、Perez M、etal。臨床的に定義された患者における新しい自動ENAスクリーニングアッセイ(EliA Symphony)による結合組織病の検査室スクリーニング。クリンチムアクタ。 2005; 359:109-114。
- Eissfeller P、Sticherling M、Scholz D、etal。結合組織病における同時自己抗体検出のための異なる試験システムの比較。 Ann N Y AcadSci。 2005; 1050:327-339。
- Smith J、Onley D、Garey C、etal。 UltraPlexプラットフォームを使用したANAの特異性の決定。 Ann N Y AcadSci。 2005; 1050:286-294。
- Martins TB、Burlingame R、von Muhlen CA、etal。核抗原に対する自己抗体を検出するための多重蛍光ミクロスフェアイムノアッセイの評価。 Clin DiagnLabImmunol。 2004; 11:1054-1059。
- Bernardini S、Infantino M、Bellincampi L、etal。抗核抗体のスクリーニング:核ホモジネート、精製または組換え抗原に基づく酵素免疫測定法と免疫蛍光測定法との比較。 Clin Chem LabMed。 2004; 42:1155-1160。
- Nossent H、RekvigOP。この新しい千年紀における抗核抗体スクリーニング:顕微鏡への別れ? JRheumatolをスキャンしました。 2001; 30:123-126;ディスカッション127-128。
- Lopez-Hoyos M、Rodriguez-Valverde V、Martinez-TaboadaV。抗核抗体結合組織病スクリーニングのパフォーマンス。 Ann N Y AcadSci。 2007; 1109:322-329。
- Ghillani P、Rouquette AM、Desgruelles C、etal。自己免疫疾患における抗核抗体検査のためのLIAISONANAスクリーンアッセイの評価。 Ann N Y AcadSci。 2007; 1109:407-413。
- Bonilla E、Francis L、Allam F、etal。免疫蛍光顕微鏡法は、全身性エリテマトーデス患者の抗核抗体反応性の検出において、蛍光ビーズよりも優れています。 ClinImmunol。 2007; 124:18-21。
- Nifli AP、Notas G、Mamoulaki M、etal。ヒト血清中のANAおよびANCA自己抗体を検出するためのマルチプレックスビーズベースの蛍光アッセイと免疫蛍光法の比較。 J免疫法。 2006; 311:189-197。
- Shovman O、Gilburd B、Zandman-Goddard G、etal。自己免疫疾患におけるANAスクリーニングのための多重化AtheNAマルチライトイムノアッセイ。自己免疫。 2005; 38:105-109。
- Ulvestad E.ANAの検出のためのハイブリッドELISAの性能特性と臨床的有用性。アプミス。 2001; 109:217-222。
- Olaussen E、RekvigOP。抗核抗体(ANA)のスクリーニング検査:ELISAによるスクリーニングの合理的な基礎としての中枢核抗原の選択的使用。 J自己免疫。 1999; 13:95-102。
- Homburger HA、Cahen YD、Griffiths J、JacobGL。抗核抗体の検出:酵素免疫測定法と間接免疫蛍光法の比較評価。 Arch Pathol LabMed。 1998; 122:993-999。
- Gniewek RA、Stites DP、McHugh TM、Hilton JF、Nakagawa M.抗核抗体検査法の比較:免疫蛍光アッセイと酵素免疫アッセイ。 Clin DiagnLabImmunol。 1997; 4:185-188。
- Reichlin M. DNA、SM、およびRNPに対する抗体。最新の。 2008年10月。
- ハーンBH。 DNAに対する抗体。 New Engl JMed。 1998; 338:1359。
- Kavanaugh AF、Solomon DH、米国リウマチ学会アドホック委員会の免疫学的検査ガイドライン。リウマチ性疾患における免疫学的検査のガイドライン:抗DNA抗体検査。関節炎リューム。 2002; 47:546-555。
- Benito-Garcia E、Schur PH、Lahita R.リウマチ性疾患における免疫学的検査のガイドライン:抗Smおよび抗RNP抗体検査。関節炎リューム。 2004; 51:1030-1044。
- ReichlinM。抗Ro / SSAおよび抗La / SSB抗体の臨床的重要性。最新の。 2008年10月。
- Reveille JD、Sherrer YRS、Solomon DH、Schur P、Kavanaugh A.免疫学的臨床検査の使用に関する証拠に基づくガイドライン:Anti-Ro(SS-A)およびLa(SS- B):免疫学的検査ガイドラインに関するACRアドホック委員会からの報告。出版のために提出されました。
- ReichlinM。抗リボソームPタンパク質抗体。最新の。 2008年10月。
- デントンCP。強皮症の分類。最新の。 2008年10月。