USPharm。 2013; 38(11)(Oncology suppl):3-6。
概要:貧血は、がんを患う一般的な合併症の入院患者です。それは、腫瘍自体または使用された化学療法レジメンのいずれかによって引き起こされる可能性があります。状態の重症度と有病率は、いくつかの要因によって異なります。治療は、血液の酸素運搬能力を高め、倦怠感を軽減し、患者の全体的な生活の質を向上させることを目的としています。赤血球生成刺激剤、鉄補給、および赤血球輸血はすべて、さまざまな設定で推奨されています。これらは一部の患者に有益であることが証明されていますが、最適な治療法はまだ確立されていません。
貧血は、身体能力の低下、予後、および治療結果に関連する、がん患者の罹患率の主な原因です。1WorldHealthOrganization( WHO)、貧血は、妊娠していない女性では< 12 g / dL、< 13 g / dLのヘモグロビン(Hb)レベルとして定義されます。 15歳以上の男性。2
疫学
貧血は、がんの入院患者で最も頻繁に現れる症状の1つです。実際、すべての癌患者の30%から90%が貧血であることが示されています。これは、癌の種類と使用される貧血の定義に依存します3。貧血の発生率と重症度は多くの要因に依存します。表1.4,5にリストされています

病因
がん患者の貧血の主な原因は、がん自体とがんの管理に使用される治療法の2つです。骨髄に浸潤するがん細胞は、造血を直接抑制して貧血を引き起こす可能性があります。さらに、癌細胞は鉄の隔離につながる可能性のあるサイトカインを放出し、赤血球(RBC)の産生を減少させます。腫瘍は腫瘍部位からの慢性的な失血を引き起こし、癌や臓器損傷による進行性貧血を引き起こす可能性があります。6
この問題は、失血、栄養不足、溶血、内分泌障害、遺伝性疾患、腎不全、または癌や慢性疾患に関連する炎症性サイトカインの存在。4,6癌患者は食欲を失う傾向があり、栄養不足につながります。胃腸(GI)腫瘍の患者では、栄養素の吸収不良も欠乏症につながります。溶血は、免疫性抗体または凝固能力の変化に起因します。その結果、貧血は最近癌と診断された患者によく見られる併存疾患です。婦人科がんと診断された患者のほぼ半数、および非ホジキンリンパ腫と診断された患者の3分の1は、診断時に貧血を患っています。
さらに、骨髄抑制は化学療法の副作用の1つであり、貧血の重要な要因です。 。特に骨格への放射線療法は、血液毒性、ひいては貧血も引き起こします。6
症状
貧血の最も一般的な症状は、倦怠感、運動困難、発作、うつ病、心不全、認知障害です。機能、めまい、心不全。7,8
診断
癌患者の貧血の問題の大きさは、次善の診断手段、標準的な定義の欠如、および原因は多因子であることが多いという事実。6,9症状の発症までの期間と時間、併存疾患の存在、家族歴、および貧血薬と放射線への曝露の履歴を記録した詳細な履歴を取得する必要があります。失神、労作時呼吸困難、頭痛、めまい、胸痛、倦怠感、女性の生理不順、および蒼白をチェックするための身体検査を実施する必要があります。6
National Cancer Comprehensive Networkは、aCBCをHb < 11 g / dLまたは2g / dLのHbカウントの減少。これは、血球減少症が存在するかどうかを判断するのに役立ちます。 RBCのサイズ、形状、色を確認するために末梢血塗抹標本を視覚的に確認することもお勧めします。6
病態生理学
貧血は、循環赤血球の減少の組み合わせの結果です。 、パックされた細胞の量の減少、およびHbレベルの減少。6これは、過剰な失血、RBCの破壊の増加、赤血球生成の減少など、さまざまな病態生理学的メカニズムによって発生する可能性があります。
エリスロポエチン(EPO)、ビタミンB12、葉酸、および鉄は赤血球生成に不可欠です。エリスロポエチンは、このプロセス中の赤血球細胞の成熟、分化、および生存を制御します。10EPOは主に腎臓によって産生され、骨髄に輸送されます。11
異常な鉄代謝またはマクロファージ内の鉄の保持により、エリスロポエチンに利用できる鉄。鉄の代謝の変化は、主に、腸での鉄の吸収とマクロファージによる鉄の放出を減少させるタンパク質であるヘプシジンによって引き起こされます。ヘプシジンの産生は、腫瘍から放出されるサイトカインによって増加し、それによって循環鉄の量を減少させます。インターロイキン(IL)-6などのサイトカインの産生は、特定の化学療法レジメンによって増加することも示されています5。化学療法を繰り返すと、累積的に赤血球生成の減少が悪化する可能性があります。7
酸素供給が減少すると、体の組織細胞は低酸素状態になり、体が組織の酸素化を獲得または維持しようとすると、一連の生理学的反応を引き起こします。
癌患者の鉄の通常の利用は、腫瘍細胞間の相互作用によって中断される可能性があると考えられていますそして宿主自身の免疫システム。この相互作用は、IL-1、ガンマインターフェロン、腫瘍壊死因子α(TNF-α)などの特定の炎症性サイトカインのアップレギュレーションにつながり、骨髄中の赤芽球前駆体の分化を減少させ、正常な鉄の利用を妨げ、正常な低酸素症を抑制します-ドリブンエリスロポエチン産生。腎毒性化学療法剤は、腎機能障害を引き起こすことによって問題を悪化させる可能性があります。
慢性貧血では、腫瘍が貧血誘発因子、赤血球の寿命を縮める分子を放出することが示されています。これは貧血を悪化させ、赤血球生成がRBCの生存率の低下を補うことができない12
癌における貧血のリスク因子
癌における貧血の以下のリスク因子が特定されている9。
- 骨髄抑制化学療法または放射線療法
- 細胞毒性化学療法の開始時の低Hbレベル(10〜12 g / dL)
- プラチナの投与-レジメンを含むため、輸血サポートの必要性も高まります。
治療
患者の生活の質の全体的な改善は別として、貧血の治療は多くの人にとって不可欠です。貧血は、腫瘍細胞を含むすべての細胞への十分な量の酸素の送達を損なう7。組織の酸素化が少ないと、放射線および他の形態の化学療法に対する腫瘍の感受性が低下するため、貧血ではこれらの治療の有効性が低下する13,14。
治療の目標は、酸素キャリンを増やすことです。 g血液の容量と根本的な原因の治療。栄養不足などの根本的な状態は、潜在的な失血などの他の状態よりも治療が容易です。貧血のがん患者の管理には、さまざまなオプションが利用できます。これらには15が含まれます:
- 栄養不足を修正するための葉酸および/またはビタミンB12による適切な補足療法
- 赤血球生成刺激剤(ESA)
- 鉄補給
- 急性の重度の失血のある患者に適応となる輸血。貧血が慢性の患者には、赤血球生成剤が好ましい。
赤血球生成刺激剤:組換えヒトエリスロポエチンアルファ(rHuEPO; Procrit、Epogen)およびダルベポエチンアルファ(Aranesp)を含むESAが伝統的に慢性腎不全患者の貧血の管理のために開発されました。貧血のがん患者に比類のない用量を使用した場合、同様の有効性と制限が示されました。5ESAの作用機序と免疫学的および血液学的効果は内因性EPOと同様であるため、ESAは内因性EPOレベルが異常に低い患者の管理に適応されます。 rHuEPOで実施された結果は、患者のHblevelsと生活の質を改善し、輸血の必要性を減らすことを示しています15,16。ESAは化学療法を受けている患者の認知機能も改善することが提案されています17
全身レビューAmerican Cancer Societyが実施したところによると、化学療法誘発性貧血の赤血球生成治療による最適な臨床的利益は、早期介入によって達成される可能性があります18。ESAを使用することには明らかに利点があります。ただし、ESA療法を使用する前に、貧血の他のすべての原因を調査して修正する必要があります。
ダルベポエチンとrHuEPOはどちらも、化学療法に関連する貧血の非骨髄性悪性腫瘍患者の貧血の治療に適応されます。米国血液学会(ASH)および米国臨床腫瘍学会(ASCO)は、Hbレベルが10 g / dLを下回ったときに治療を開始し、Hbレベルが1 g / dL以上2増加した場合は投与量を減らすことを推奨しています。治療の目的は、輸血を避けるためにHbを最低濃度に上げることです。 6〜8週間の治療後に1〜2 g / dLのHbの最小増加が達成されない場合は、ESA療法を中止する必要があります。18現在のデータでは、これらの治療に対する患者の反応を予測することは困難ですが、rHuEPOで治療した場合、患者の約50%から60%がHbの2 g / dLの増加を示すことが示されています。9ESA治療は、完了時に中止する必要があります。化学療法コース。20,21
ダルベポエチンアルファの推奨投与量は、毎週2.25 mcg / kgasの皮下(SC)注射です。 6週間後にHbレベルが少なくとも1g / dL上昇しない場合は、投与量を4.5mcg / kgに増やす必要があります。 Hbレベルが2週間で1g / dLを超えて増加する場合、またはHbが12 g / dLを超える場合は、ダルベポエチンの投与量を40%減らす必要があります。20Hbレベルが13 g / dLを超える場合は、ダルベポエチンを中止する必要があります。 9
rHuEPOの推奨投与量は、Hbレベルが10 g / dL未満の入院患者に対して、週1回40,000U投与SCまたは週3回150U / kg投与SCです。 Hbレベルが2週間で> 1 g / dL増加するか、RBC輸血を回避するために必要なレベルに達した場合、rHuEPOの投与量を25%減らす必要があります。21
ESAは、変性するため、振らないでください。20,21バイアルの内容物を希釈したり、プールしたりしないでください。
ESA療法のリスクも考慮に入れられる。 ESAは、有害な心血管イベントを増加させ、静脈血栓塞栓症のリスクを高め、腫瘍の進行までの時間を短縮し、さまざまなメカニズムを通じて貧血の癌患者の生存率を低下させると考えられています22,23。すべてのESAには、死亡、心筋梗塞、脳卒中、静脈血栓塞栓症、血管アクセスの血栓症、腫瘍の進行と再発のリスクの増加に関するブラックボックス警告が付属しています20,21。ESAAPPRISEOncologyProgramはによって設立されました。 FDAは、ESAの安全な使用について患者、介護者、および医療専門家に助言します。25
鉄補給:鉄補給は、好ましくは非経口的に、低レベルのオファーリチン(< 30 ng / mL)、トランスフェリン飽和度(TSAT < 15%)、および低(< 26 pg / cell )網状赤血球Hb含有量t(CHr)。貧血の癌患者では、2種類の鉄欠乏症が認識されています。
- GIまたは婦人科病変、手術による失血、栄養などによる慢性出血で発生する絶対鉄欠乏症(AID)欠乏症、および慢性疾患の貧血(ACD)。これは、< 30 mcg / Lの血清フェリチンレベルと、< 15%のTSATの減少として定義されます。1
- エリスロポエチンの継続使用後に発生する機能性鉄欠乏症(FID)。これは、特に腎不全の患者において、ESA療法に対する不十分な反応の最も一般的な原因です。したがって、ESA療法を受けているほとんどの患者は最終的に鉄補給を必要とします。6
ESA療法だけで化学療法治療を受けた患者の反応率が低いことが示されたときに鉄補給が導入されました。1IVの組み合わせの有効性鉄とESA療法がテストされ、機能的鉄欠乏症における鉄の役割が確立されました。1現在の証拠は、癌の貧血患者のヘモグロビン反応を改善するためのIV鉄補給の使用を支持していますが、IV鉄の長期的な有効性と安全性に関する前向き研究が必要です。さらに、最適な投与計画を確立する必要があります。5
鉄は、経口投与することも、低分子量(LMW)鉄デキストラン、グルコン酸鉄、および鉄スクロースの非経口製剤として投与することもできます。非経口投与された鉄は、経口鉄と比較して優れた反応を示します6。したがって、後者は貧血の癌患者にはめったに使用されないため、この記事では説明しません。鉄デキストランには試験用量が推奨されます。鉄デキストランまたは他のIV鉄製剤に対して以前に感受性を示した患者、または複数の薬物アレルギーを有する患者にも試験用量を投与する必要があります。表2は、IV鉄補給の投与計画を示しています。6
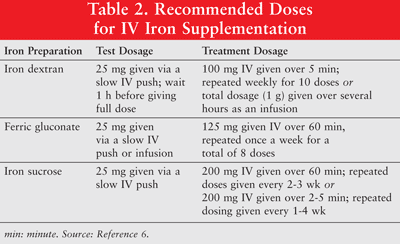
非経口鉄分は、低血圧、吐き気、嘔吐および/または下痢、痛み、高血圧、呼吸困難、そう痒症、頭痛、およびめまいに関連しています。さらに、投与が不便で費用がかかる可能性があります9。高分子量(HMW)鉄デキストランは、LMW鉄デクストランよりも有害事象の発生率が高いため、全体的に後者が好ましい6。
赤輸血:RBCは、出血後の急性貧血の場合に貧血を矯正するための輸血に適した血液製剤です。特定の患者は、サイトメガロウイルス陰性の注入を必要とする場合があります。RBC輸血を使用する目的は、血液の酸素運搬能力の不足を治療または予防することであり、患者のHblevelが10 g / dL以上の場合は通常輸血は適応されません。6
RBC輸血は輸血直後にHbとヘマトクリット値が急速に上昇するという利点。 300 mL(1ユニット)の純粋なRBCを輸血すると、同時に失血することのない正常な成人では、平均して1 g / dLのHbまたは3%のヘマトクリット値が増加すると推定されます。これにより、倦怠感が全体的に急速に改善されます。6
RBCを輸血する前に、患者の血液をABO適合性と交差適合試験する必要があります。患者が繰り返し注入を必要とする場合は、白血球減少血液を使用し、抗ヒスタミン剤またはアセトアミノフェンによる前投薬を行うことで、副作用のリスクを最小限に抑えることができます。輸血のその他のリスクには、うっ血性心不全、血栓性イベントの増加、鉄過剰症などがあります6。ただし、化学療法治療のみに対応する期間にRBC注入を必要とする患者は、そうする可能性が非常に低いことに注意してください。鉄過剰症を経験します。6
将来の展望
癌患者の貧血を管理するための新しい戦略が現在追求されています。人間の血液に代わるものはありませんが、研究者たちはRBCの酸素運搬能力を備えた製品を開発中です。パイプラインには、Hbベースの酸素運搬体とパーフルオロカーボンがあります。5
結論
全体として、腫瘍学の重要な問題としての貧血への最適なアプローチはまだ確立されていません。医療提供者間の一貫性の欠如、癌における貧血の明確な定義、および診断基準はすべて、この問題の原因です。
1。スタインメッツHT。癌患者の貧血の治療における静脈内鉄の役割。 Ther AdvHematol。 2012; 3:177-191。
2。 deBenoist B、McLean E、Egli I、他貧血の世界的な有病率1993–2005:貧血に関するWHOグローバルデータベース。スイス、ジュネーブ:世界保健機関; 2008.
3。 Knight K、Wade S、Balducci L.癌における貧血の有病率と転帰:文献の系統的レビュー。 Jメッドです。 2004; 116(suppl 7A):11S-26S。
4。シュワルツRN。がん患者の貧血:発生率、原因、影響、管理、および治療ガイドラインとプロトコルの使用。 J Health SystPharmです。 2007; 64(3 suppl 2):S5-S13;クイズS28-S30。
5。 Calabrich A、KatzA。癌患者の貧血の管理。将来のOncol。 2011; 7:507-517。
6。ロジャースGM、ベッカーP、ブラインダーM、他癌および化学療法によって誘発された貧血。 J Natl Compr CancNetw。 2012; 10:628-653。
7。 Groopman JE、Itri LM成人における化学療法誘発性貧血:発生率と治療。 J Natl CancerInst。 1999; 91:1616-1634。
8。 Ludwig H、StrasserK。貧血の症状。セミンオンコル。 2001; 28:7-14。
9。ジレスピーTW。がんの貧血。がん看護。 2003; 26:119-128。
10。ケーラーJM。がん関連貧血の治療のための臨床ガイドライン。薬物療法。 1998; 18:156-169。
11。 Cazzola M、Mercuriali F、BrugnaraC。尿毒症の設定外での組換えヒトエリスロポエチンの使用。血液。 1997; 89:424-867。
12。 Nowrousian MR、Kasper C、Oberhoff C、etal。癌関連貧血の病態生理学。 In:Smith JF、Boogaerts MA、Ehmer B、eds。がんの支持療法におけるエリスロポエチン。ニューヨーク州ニューヨーク:マルセルデッカー; 1997:13-34。
13。 Vaupel P、Dunst J、Engert A、他癌誘発性貧血患者の腫瘍制御に対する組換えヒトエリスロポエチン(rHuEPO)の効果。オンコロジー。 2005; 28:216-221。
14。 Zhao KL、Liu G、Jiang GL、他ヘモグロビンレベルと、放射線療法を受けている局所進行食道癌患者の罹患率および死亡率との関連-3つの連続した臨床第III相試験の二次分析。 Clin Oncol(R Coll Radiol)。 2006; 18:621-627。
15。 GlaspyJA。腫瘍学における赤血球生成剤の開発。エキスパートオピンエマーグドラッグ。 2005; 10:553-567。
16。アダムソンJW、スピバクJL外科手術および癌治療における組換えヒトエリスロポエチンの薬理学的使用の生理学的基礎。手術。 1994; 115:7-15。
17。フェラーリE、フェラーリL、ビドリP、他エポエチンアルファによる癌関連貧血の治療:レビュー。 Cancer Treat Rev. 2004; 30:563-575。
18。 Lyman GH、Glaspy J.化学療法誘発性貧血に対する早期の赤血球生成介入による臨床的利益はありますか?体系的なレビュー。癌。 2006; 106:223-233。
19。 Rizzo JD、Brouwers M、Hurley P、他AmericanSociety of Clinical Oncology / American Society of Hematologyの臨床診療ガイドラインは、癌の成人患者におけるエポエチンとダルベポエチンの使用に関する最新情報です。 J ClinOncol。 2010; 28:4996-5010。
20。アラネスプ(ダルベポエチンアルファ)の処方情報。カリフォルニア州サウザンドオークス:Amgen Inc; 2012年5月。
21。 Procrit(エポエチンアルファ)処方情報。 ペンシルベニア州ホーシャム:Janssen Products、LP; 2012年7月。
22。 Beutel G、GanserA。癌管理における赤血球生成刺激剤のリスクと利点。 セミンヘマトール。 2007; 44:157-165。
23。 Fenner MH、GanserA。癌関連貧血におけるエリスロポエチン。 Curr OpinOncol。 2008; 20:685-689。
24。 Smith RE Jr、Aapro MS、Ludwig H、他 化学療法または放射線療法を受けていない活動性癌患者の貧血の治療のためのDarbepoetinalfa:第III相、多施設、無作為化、二重盲検、プラセボ対照試験の結果。 J ClinOncol。 2008; 26:1040-1050。
25。 ESAAPPRISE腫瘍学プログラム。 アムジェンおよびヤンセンプロダクツ、LP。 www.esa-apprise.com。 2013年10月13日にアクセス。