はじめに
何十年もの間、食品と薬物の相互作用(FDI)とハーブと薬物の相互作用が治療の成功を制限することが知られています。遺伝的変異、医療レジーム、および食品やハーブに含まれる多数の生物活性化合物の間で起こりうる膨大な数の相互作用は、圧倒的な複雑さをもたらします。ビッグデータ分析、機械学習、タンパク質とリガンドの相互作用のシミュレーションなどの最新のツールは、一連の質問全体に答えるのに役立つ可能性があります。食品の選択が治療計画の失敗に寄与する可能性がありますか。処方薬を服用する前にどの食品を摂取する必要がありますか?そしておそらく最もエキサイティングな質問:これらのツールを使用して個人のFDIを予測するにはどうすればよいでしょうか。明らかに、多くの答えは、肝臓と消化管でのチトクロームP450 3A4(CYP3A4)による薬物、食品、ハーブの代謝にあります(Galetin et al。、2010; Basheer and Kerem、2015)。
CYP酵素をコードする遺伝子の大部分は多形性です。現在まで、CYP対立遺伝子の詳細を示す最も包括的な情報源はPharmacogene Variation Consortium1であり、CYP3A4の対立遺伝子が100未満しか表されていません。これらのうち、40未満がエキソンSNP(一塩基多型)であり、タンパク質配列が変更されます。 CYP3A4変異に関する以前に発表されたすべての研究における少数の被験者は、集団全体および定義されたグループにおけるCYP3A4変異の真の頻度に関する限られたデータを提供します。
SNPの発生率に関する信頼できる情報が不完全であるだけではありません。 、また、それらの臨床的意義は、ほとんどの場合、まだ不明です(Zanger et al。、2014)。どのSNPがいつ臨床的に重要であるかを理解することは、非常に複雑な作業です。インビトロアッセイは、時間と費用がかかり、大量の突然変異と無限の数の食品と薬物の組み合わせを考慮すると、実質的に関連性が低い。ドッキングや自由エネルギー結合の計算などの分子モデリング手法は、CYP3A4を介した代謝に対するSNPや多くの化合物の潜在的な影響を予測するのに役立つ可能性があります(Lewis et al。、1998)。たとえば、非共有結合、疎水性、静電、およびファンデルワールス相互作用はすべて、化合物の配向に寄与し、したがって酵素の活性部位での結合と反応に寄与します。次に、これらは、さまざまな基質に対する酵素の親和性と特異性、および酵素阻害剤の効力を決定します(Kirchmair et al。、2012; Basheer et al。、2017)。
ここでは、新しいものを提案します。異なる民族グループにおけるCYP3A4突然変異の対立遺伝子頻度を測定するためのアプローチ。この包括的なアプローチには、特定の民族グループに蔓延している突然変異を強調する力があり、相互作用する化学物質のスクリーニングと組み合わせると、たとえば、食品からの阻害剤は、薬物と食品の相互作用に対する特定の突然変異の影響の解明を可能にし、初期の役割を果たします個別化医療と栄養への一歩。この研究は、タンパク質を変化させるCYP3A4 SNPの臨床的重要性の可能性についての認識を高める可能性があり、精密で個別化された医療の促進と応用に必要ないくつかのツールも示唆しています。
材料と方法
データベースのスクリーニングとデータ分析
CYP3A4バリアントデータセットは、gnomADbrowser2からCVSファイルとしてダウンロードされました。データ分析と視覚化には、NumPy、pandas、matplotlibパッケージを備えたPython 2.7を使用しました(補足データシートS1を参照)。凝集型階層的クラスタリングは、Expander 7ソフトウェア(Shamir et al。、2005)を使用して、類似性と完全なリンケージタイプの尺度としてピアソンの順位相関係数を使用して実行されました。 SNPのグループ化には、距離のしきい値0.6が設定されました。
インシリコポリモーフィズムモデリング
Maestro 2017-2リリース(Schrodinger、ニューヨーク、ニューヨーク、米国)が計算モデリング。 CYP3A4ドッキングモデルは、前述のように構築されました(Basheer et al。、2017)。簡単に説明すると、CYP3A4結晶構造(PDBエントリー2V0M)は、タンパク質調製ウィザードの手順に従って処理、変更、および精製されました。結晶構造の元の結合部位にあるケトコナゾールの重心に基づいて、ヘムグループのFe2 +の金属配位制約のあるドッキンググリッドが生成されました。ドッキングシミュレーション用に7つの突然変異が選択され、1つは各民族グループの代表として選択されました(表1、2)。各バリアントタンパク質について、タンパク質調製ステップの前に単一の点突然変異が導入されました。リガンドの3D構造は、PubChem3の2D構造に基づいて生成され、LigPrepタスクを使用してドッキング用に準備されました。ドッキングモデルには、OPLS3力場と標準精度のデフォルトのグライドオプションが適用されました。ただし、金属配位拘束が使用され、含めるポーズの数に30ポーズ、書き込むポーズの数に10ポーズが使用されました。アウト。各リガンドについて、グライドemodelスコアが最も低いドッキング結果が選択されました。

表1.7つの民族グループの選択された代表的なSNP。

表2.民族グループごとに選択された変異の頻度(%)。
結果
Genome Aggregation Database(gnomAD;テキスト脚注2を参照)は、さまざまな大規模シーケンスプロジェクトからのエクソームシーケンスデータとゲノムシーケンスデータの両方を集約します。これには、125,748のエクソームシーケンスからのデータと、7つの民族集団を表す141,456の無関係な個人からの15,708の全ゲノムシーケンスが含まれます(Lek et al。、2016)。 GnomADデータベースはCYP3A4の856の亜種を提示し、そのうち397はイントロンであり、459はエキソンです。エキソンSNPのうち、312はミスセンス変異であり、タンパク質構造に影響を与えることを示しています。 CYP3A4遺伝子の長さは34,205bpです。その13個のエクソンは、504アミノ酸のタンパク質を生成する1,512bpのコード領域を構成します。この遺伝子に固有の位置を持つ412個のエクソンSNPは、272 / kbpのエクソンSNP密度をもたらします(補足表S1)。
民族グループごとの異なる対立遺伝子頻度の計算により、一部の集団がより高い頻度の突然変異を示すことが明らかになりました。 (図1A)。一般的に考えられているように、ヨーロッパの集団におけるCYP3A4変異のほとんどは確かにまれですが、アフリカや東アジアなどの他の集団における変異ははるかに一般的です(補足表S2)。
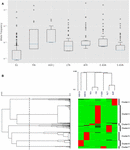
図1.7つの異なる母集団におけるCYP3A4ミスセンスSNPの分析。 (A)対立遺伝子頻度の対数スケール箱ひげ図。ボックスは四分位範囲(IQR)を表し、青い線は中央値を表し、ウィスカーは1.5 IQR内のデータを表し、外れ値は小さな円として示されます。 (B)対立遺伝子頻度の階層的クラスタリング。各行は単一のSNPを表します。各列は、異なる民族集団を表しています。各集団のSNPの対立遺伝子頻度は、マトリックスファイル内の対応するセルの色で表されます。緑と赤はそれぞれ低周波数と高周波数を表します。上の樹状図は、被験者の各グループ間の対立遺伝子頻度パターンの類似性を示しています。左の樹状図は、2つのグループの遺伝子のクラスター化を表しています。破線は、グループへの分割に使用される0.6の距離しきい値を表します。 EU –ヨーロッパ(非フィンランド語; n = 64,603)、FIN –ヨーロッパ(フィンランド語; n = 12,562)、ASH J –アシュケナージユダヤ人(n = 5,185)、LTN –ラテン系(n = 17,720)、AFR –アフリカ(n = 12,487)、E ASN –東アジア(n = 9,977)、S ASN –南アジア(n = 64,603)。
階層的クラスタリングを使用して、類似した頻度パターンを持つバリアントをグループ化しました。データ分析により、7つの異なるクラスターが得られました(図1B)。さらに、各クラスターの高頻度SNPは、1つの特定の集団に特徴的であることが明確に観察されます。民族グループの階層的クラスタリング分析は、南アジアと東アジア、フィンランドと非フィンランドのヨーロッパ人などの関連する民族をグループ化することにより、遺伝的変異と民族性との関連をサポートします。
計算モデルを使用して評価しました。 CYP3A4の点突然変異が基質および阻害剤に結合する能力に及ぼす可能性のある影響。 CYP3A4は、広範囲の内因性および生体異物化合物を酸化することができます。ここでは、ケトコナゾールが代表的な薬剤および非常に効率的な特異的阻害剤として選択されました。アンドロステンジオンとテストステロンが代表的な内因性ホルモンとして選択されました。そして、デメトキシクルクミンとエピガロカテキンが食事の生物活性物質の代表として選ばれました。ドッキングモデルは、CYP3A4結合部位で選択された化合物の結合ポーズを予測するために構築されました。モデルは、元の結晶構造に対して1.52ÅのRMSDで、結合部位のケトコナゾールポーズを正常に復元することによって最初に検証されました。野生型タンパク質の結晶構造に基づいて、7つの変異タンパク質が設計されました(補足図S1)。各民族グループについて、最も頻繁な固有の突然変異が代表として選択されました。基質結合に対する単一変異の影響は、ネイティブタンパク質とバリアントタンパク質へのドッキングポーズの比較に基づいて評価されました。 RMSDに関するドッキングポーズの変更を表3にまとめています。

表3.7つのCYP3A4変異体の結合部位へのドッキングリガンドのWTと比較したRMSD。
CYP3A4 SNPの基質結合への影響は、変異基質特異的であることがわかりました。ほんのわずかなケースで、突然変異が結合ポケット内のリガンドの結合ポーズの変化を引き起こしました。テストステロンドッキングポーズは、テストされた7つのバリアントすべてで同じでした。 E262K、D174H、およびK168Nバリアントは、テストしたどの分子でも結合ポーズの変化を引き起こしませんでした。ただし、L373FおよびT163Aの変異により、アンドロステンジオンの結合ポーズが変化し、WTタンパク質のように、ヘムグループに垂直ではなく平行に配置されました。また、アンドロステンジオンは、WTタンパク質のシクロヘキサノン基の代わりにシクロペンタノン基がヘムの近位に位置するように回転されました。 S222PおよびL293P変異は、アンドロステンジオンの結合ポーズにわずかな回転しか引き起こしませんでした(図2A)。調べたすべての変異のうち、S222Pのみが結合部位でのケトコナゾールとデメトキシクルクミンのドッキングポーズに実質的な変化を引き起こしました(図2B、C)。一方、エピガロカテキンの場合、ポーズを変える変異はL373Fでした(図2D)。
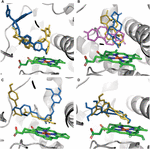
図2.CYP3A4の結合部位にドッキングしたリガンドのモデル。 (A)ケトコナゾール、(B)アンドロステンジオン、(C)デメトキシクルクミン、および(D)エピガロカテキン。タンパク質結合部位は灰色のリボンで表されています。ヘムは緑色の棒で表され、WTタンパク質とS222PおよびL373F変異体のドッキングポーズは、それぞれオレンジ、青、および紫の棒で示されます。 L293PおよびT136Aバリアントのアンドロステンジオンドッキングポーズは、それぞれS222PおよびL373Fバリアントのポーズと重複しています。
ディスカッション
シトクロムP4503A4は、食品と薬物の相互作用に関与する主要な酵素です。 CYP3A4の突然変異に関する現在の研究は、指定された研究で見つかった数十のSNPに焦点を合わせています(Sata et al。、2000; Dai et al。、2001; Eiselt et al。、2001; Hsieh et al。、2001; Lamba et al。 。、2002; Murayama et al。、2002)。ここに示されているように、それらはCYP3A4変異の有病率と潜在的な結果を考慮した氷山の一角を表しています。大規模なゲノムおよびエクソームシーケンシングプロジェクトの豊富さは、多くの未知の突然変異を特定するための新しい道を開きました。ここでは、CYP3A4に存在する856の変異を示し、その3分の1がタンパク質構造を変更することにより、以前に提示された変異が氷山の一角にすぎないことを示します。 141,456人の無関係な個人のコホートを使用して、CYP3A4突然変異の正確な対立遺伝子頻度が7つの別々の民族について計算されました。私たちの知る限り、これはCYP3A4エキソニック変異と、これまでに発表されたさまざまな集団におけるそれらの対立遺伝子頻度に関する最大かつ最も包括的な大規模データ研究です。
多型CYP3A4酵素は説明において非常に重要である可能性があります異なる個人間の薬効と毒性の違い。 CYP3A4遺伝子の変異は、酵素活性の廃止、減少、変化、または増加につながる可能性があります。選択された基質を用いたいくつかの臨床研究で実証されているように、エクソン変異は酵素活性を変化させる可能性があります。 CYP3A4のSNPによる代謝変化のいくつかの症例は、すでに文献に記載されています(Eiselt et al。、2001; Miyazaki et al。、2008)。 CYP3A4におけるSNPの機能的重要性と臨床的関連性にもかかわらず、そしておそらく一般集団におけるそれらの比較的低い同定頻度のために、CYP3A4の多型はそれに値する注目を受けていません。
ここで、7つの突然変異が予測に役立ちました基質および阻害剤の結合配向に対するSNPの影響。文献では、CYP3A4多型は、構造ではなく発現レベルを変更するイントロンSNPに基づいて、一般集団を3つのグループに分けています。貧弱な代謝、正常な代謝、急速な代謝です(Zanger and Schwab、2013)。私たちの計算は、追加の分類を示唆しています:変更された代謝者。私たちの仮想モデルによって提案されたいくつかの突然変異は、個々のリガンドの結合方向の変化を引き起こすでしょう。これらの変化は、ヘムからの距離の増加による酵素的酸化の可能性を減少させるか、または医薬品開発プロセスの一部として実行される毒性試験中に明らかにならない製品につながると予想されます。しかし、私たちのモデルが予測するように、ほとんどの基質ではCYP3A4変異は良性です。
タンパク質の構造変化による結合ポケット内の基質の位置の変更は、変異がタンパク質の活性を変化させる可能性のあるメカニズムの1つにすぎません。 。タンパク質の膜への固定障害、基質誘導チャネルの損傷、および生成物の出口の障害は、タンパク質の活性の変異変化の追加のメカニズムを示します。ここに示されているように、すべての変異の影響は基質特異的です。従来のinvitro法を使用して、基質と変異のどの組み合わせが酵素活性を変化させる可能性があるかを判断するのは骨の折れる作業であり、この複雑なパズルを解決するための予測仮想ツールの必要性を強調しています。
個人および精密医療に対する公的および専門的な関心急速に成長しています。 CYP3A4の個々の多型に基づく修飾された薬物代謝の予測は時間の問題のようです。ここでは、異なる民族グループがCYP3A4SNPの固有のセットを持っていることを提案します。確かに、民族性は、すべての人に個別のDNAスクリーニングを実施する前に、個別化医療の最初の実行可能なステップとして役立つ可能性があります。興味深いことに、民族性はCYP3A4の薬物代謝にもう一つの影響を及ぼし、食物の選択と食生活を決定する主要な要因です。少なくともCYP3A4によって高度に代謝される薬物については、治療レジームを各民族グループ向けに特別に設計する必要があることが示唆される場合があります。これは、データベースとディープラーニングを活用および統合して、SNP、民族性、食事性化合物、および薬物がCYP3A4の活動と医療体制の成功をどのように変更するかを特定する機会を浮き彫りにします。
データの可用性
この研究では、公開されているデータセットを分析しました。このデータは次の場所にあります:http://gnomad.broadinstitute.org/gene/ENSG00000160868。
著者の貢献
リストされているすべての著者は、実質的で直接的かつ知的に貢献しています。
利益相反に関する声明
著者は、潜在的な可能性があると解釈される可能性のある商業的または金銭的関係がない状態で調査が行われたことを宣言します。利益相反。
補足資料
図S1 | CYP3A4の3Dリボンモデルとドッキング用に設計された7つのバリアントタンパク質の変異アミノ酸の位置。ヘムは緑色の棒で表され、Fe2 +は赤い球で表され、インシリコ分析で使用されるSNPはリボンの赤い領域で表され、バリアントモデルの変異アミノ酸のRグループは明るい灰色の棒で明示的に示されます。
表S1 | CYP3A4 SNPは、7つの民族集団を表す141、456の無関係な個人の集団に含まれます。
表S2 |民族グループ別のCYP3A4SNP。
脚注
- ^ www.pharmvar.org
- ^ https://gnomad.broadinstitute.org
- ^ https://pubchem.ncbi.nlm.nih.gov