このコースは2016年3月号で公開され、19年3月31日に有効期限が切れます。著者は、開示すべき商業的利益相反はありません。この2クレジット時間の自習活動は電子的に仲介されます。
目的
このコースを読んだ後、参加者は次のことができるようになります。
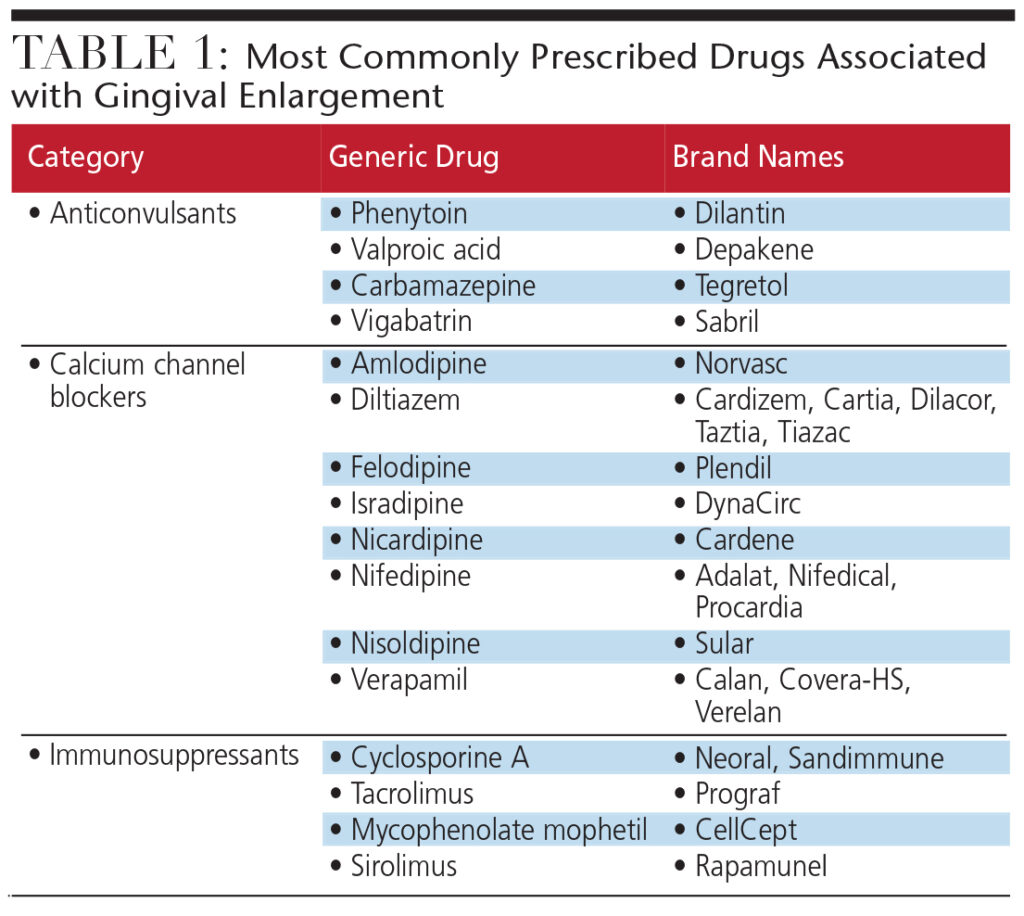
- さまざまな種類について話し合う歯肉増殖症を引き起こす可能性のある薬物。
- 歯肉増殖症の臨床的特徴を特定します。
- 薬物誘発性歯肉増殖症の病因と危険因子を説明します。
- この状態を治療するために利用可能なオプションをリストします。
細菌、ウイルス、新生物、および特定の薬は、歯肉の健康に悪影響を与える可能性があります。歯肉増殖症は、感染症、虫歯、歯周病のリスクを高め、笑顔の審美性に悪影響を及ぼします。全身性と炎症性の両方の要因によって開始される歯肉増殖症は、一般的な処方薬によって引き起こされることがよくあります。これらの薬剤(抗けいれん薬、カルシウムチャネル遮断薬(CCB)、免疫抑制薬)は、線維芽細胞機能の変化を促進し、歯肉結合組織の細胞外マトリックスの増加をもたらします(表1)。正常な線維芽細胞の機能と歯肉の健康を回復するために、問題のある薬の代わりに別の薬を使用する必要があるかもしれません。置換が不可能な場合、歯肉組織の外科的切除は、薬物誘発性歯肉増殖症の影響を受けた患者に一時的な救済を提供する可能性があります。
メリットとパトナムによる1938年のフェニトインの発見は、しかし、導入直後に、フェニトインと歯肉増殖症との関連性が明らかになり始めました2。良性増殖症の有病率は人口サブセットによって異なるため、この薬剤に対する感受性は普遍的ではありません。抗けいれん薬によって誘発される歯肉増殖症は、子供と施設に収容された患者の間で有意に高いです。施設に収容されていない患者の場合、フェニトインによって引き起こされる歯肉増殖症の有病率は約50%であり、この状態は上顎前歯に最も頻繁に影響します(図1)。3歯肉増殖症は通常、フェニトインの初回投与後2か月から3か月で現れます。 、約12か月から18か月後に最大の重症度に達します。
1938年以来、フェニトインの悪影響を克服するために、バルプロ酸、カルバマゼピン、フェノバルビタール、ビガバトリンなど、いくつかの抗けいれん薬が導入されています。 。これらの薬剤でも歯肉増殖症の症例が指摘されていますが、そのような報告はまれであり、文書化も不十分です。
けいれん発作障害の制御に有効であるだけでなく、低コストで入手しやすいフェニトインてんかんの治療、特に大発作、側頭葉、精神運動発作の治療に最適な薬剤です。多くの患者は、新しいクラスの抗けいれん薬に置き換えることを躊躇しているため、口腔衛生の専門家はリスクの増大を認識し、これらの患者集団におけるフェニトイン誘発性の歯肉増殖症に対処する準備ができている必要があります。
カルシウムチャネル遮断薬
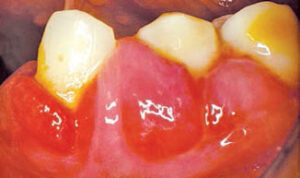
このクラスの薬剤は、高血圧、狭心症、上室性心不整脈の管理に広く使用されています。これらの薬は、細胞膜を介したカルシウムイオンの流入を防ぐことにより、主な治療効果を引き出します。ただし、すべてのCCBが同じように歯肉に影響を与えるわけではありません。ニフェジピンは、薬物誘発性歯肉増殖症に最も頻繁に関与するCCBです(図2から図4)。4Ledermanらは、1984年に最初にその負の経口効果を報告し、その後の研究では、副作用の有病率が14%から83%.5–7
歯肉増殖症の負の影響の有病率は、ベラパミルとアムロジピンで有意に低くなっています(それぞれ4.2%と3.3%)。8,9歯肉増殖症は、フェロジピン、ニカルジピン、マニジピン、ジルチアゼムなどの新世代のCCBにも関連しているとの報告が多数あります。
免疫抑制剤
免疫抑制剤は、主要な臓器(肝臓、膵臓、心臓、肺など)の移植後の同種移植片拒絶反応の発生率と重症度を軽減し、関節リウマチなどの自己免疫状態を管理します。
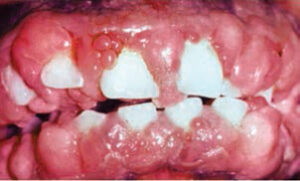
1977年にBorelらによって発見されて以来、シクロスポリンAは、臓器拒絶反応を予防するための最も一般的に処方される薬剤になりました10。残念ながら、シクロスポリンAは、腎毒性、糖尿病状態の誘発など、深刻な副作用を引き起こす可能性があります。 、慢性的な頭痛および外観を損なう歯肉増殖症(図5)。歯肉増殖症の最初の発表は、最初の投与から4週間から6週間後の腎移植患者で報告されました11。歯肉の唇側で拡大がより顕著であり、重大な出血と関連していました。しかし、外科的に抜歯した場合、拡大は永久に解消されました。シクロスポリンA関連の歯肉増殖症の有病率は8%から81%の範囲であり、子供と青年が最大のリスクにさらされています12,13
タクロリムス、ミコフェノール酸モフェチル、シロリムスなどの新しい免疫抑制薬が提供されています歯肉増殖症のリスクなしに臓器移植患者を管理するための代替オプション。14
臨床的特徴
各タイプの薬物誘発性歯肉増殖症の口腔症状は類似しており、診断要因ではありません。詳細な患者の病歴を保持することは、歯科専門家が正確な診断を達成するのに役立ちます。初期段階では、病変は歯間乳頭の固い結節性拡大として現れることがあり、口腔全体に現れることがあります。歯肉の異常増殖は、より一般的に前部に影響を及ぼし、口蓋/舌の表面よりも顔面/頬の表面でより顕著になります15。拡大は、隣接歯間歯肉乳頭の軽度の増加から、辺縁組織と乳頭組織の両方の重度の拡大にまで及びます。重症の場合、乳頭全体と周囲の組織が肥大し、歯肉組織に小葉状の外観を与えます(図6)。
肥大は冠状に広がり、咀嚼と発話を妨げる可能性があります。さらに、前歯が関与する場合、審美的な問題を引き起こす可能性があります。生い茂った組織は、歯ブラシやデンタルフロスの届かないところに病原性微生物を宿すことができるポケットを作ります。
これらの薬は下にある歯槽骨に直接影響を与えませんが、歯肉増殖症は既存の歯周炎の患者の間で重なる可能性があります。または患者はそれを同時に獲得するかもしれません。歯肉増殖症は、炎症を起こしていない、硬くて線維性の歯肉から、浮腫、紅斑、出血が支配的な歯肉組織まで、さまざまな形態で現れる可能性があります。
鑑別診断
薬物誘発性の歯肉増殖症には、口腔保健専門家が正確な診断に到達するのを助けるための独特の臨床マーカー。これらの病変は、同様に現れるいくつかの病的状態を模倣しています。拡大は局所的または一般化され得る。局所的な歯肉増殖症は、歯周膿瘍、線維腫、または化膿性肉芽腫(妊娠中に経験するような刺激、外傷、またはホルモンの変動によって引き起こされる組織の異常増殖)によって引き起こされる可能性があります。これらの病変の局所的な性質は、臨床的兆候と症状、および患者の病歴と歯科歴とともに、薬剤の使用によって引き起こされる歯肉増殖症と区別するのに役立ちます。
一般的な歯肉肥大一部の患者では診断が困難です。歯肉増殖症の大部分に関与する最も一般的な要因は、口腔バイオフィルムです。これは、適切なセルフケアと組み合わせて、スケーリングとルートプレーニングを伴うプラーク誘発性の歯肉増殖として治療する必要があります。病変が治療後3週間から4週間続く場合、原因となる要因として全身性疾患を除外するために、患者は医療提供者に紹介されるべきです。診断されていない、または管理が不十分な糖尿病が主な原因であり、全身性の炎症性歯肉増殖症と重大な歯周破壊を引き起こします。
歯肉増殖症を引き起こす可能性のあるその他の全身性疾患には、急性白血病、ウェゲナー肉芽腫症、壊血病などがあります。出血を伴う急速な歯肉増殖症は、急性骨髄芽球性白血病、慢性骨髄性白血病、急性リンパ性白血病、または慢性リンパ性白血病の存在を示している可能性があります。急性骨髄性白血病と診断された患者のうち、5%が最初の合併症として歯肉増殖症を経験します16,17。白血病は悪性疾患であり、その解決の成功は早期の診断と治療にかかっています。異常増殖の急速な進行が認められた場合、口腔医療専門家は患者を医療専門家に紹介する必要があります。16,17
ウェゲナー肉芽腫症では、歯肉は腫れ、真っ赤に見え、粒状の表面は「イチゴの歯茎」と呼ばれます。 」この特徴的な臨床症状により鑑別診断が疑われますが、生検で確認する必要があります。ビタミンC欠乏症の結果である壊血病は非常にまれですが、この状態に冒された患者は、可動性の歯を伴う重度の歯肉の腫れや出血を経験する可能性があります。臨床医は、この患者グループの歯肉肥大を解決するために、高用量のビタミンCと非外科的歯周療法に依存する場合があります。
さらに、全身性の異常増殖は、遺伝性歯肉線維腫症と呼ばれるまれな遺伝的状態が原因である可能性があります。歯肉の進行性の拡大を特徴とします。これらの症例は通常、過剰な線維性歯肉組織を除去するために外科的介入を必要としますが、病変の再発は予測できません。これらの病変の線維性の性質は、患者の病歴および家族歴とともに、薬物と区別することができます。誘発された歯肉の異常増殖。
病因とリスク要因
薬物誘発性の病因ed歯肉増殖症は完全には理解されていません。これは、コラゲナーゼによるコラーゲン分解の減少、または細胞外の基底物質の過剰産生の結果が原因である可能性があります18,19。他の考えられる経路は、これらの薬剤に遺伝的に感受性のある歯肉線維芽細胞のサブセットの存在です20。この拡大に関与する可能性のある別の要因として、ヒト歯肉線維芽細胞によるコラーゲン合成の増強における炎症誘発性サイトカイン(IL-1bおよびIL-6)の相乗効果。21
バイオフィルムはすべての形態に共通のリスク要因です。炎症性歯周病の原因であり、その存在は薬物誘発性の歯肉肥大を悪化させます。男性は女性よりも歯肉増殖症を発症する可能性が3倍高いため、他の危険因子には性別が含まれる可能性があります22。子供やティーンエイジャーは成人よりもこれらの病変の有病率が高いため、年齢はフェニトインおよびシクロスポリンAによる歯肉増殖症と逆相関します。 .23投与量に関しては、歯肉増殖症の重症度とこれらの薬物クラスのいずれかの毎日の摂取量との関連について矛盾する報告があります。報告の大部分は、薬物投与量と歯肉増殖症の重症度との有意な関係を検出できていません。18
治療
薬物誘発性歯肉増殖症の最も効果的な治療法は、不快な薬物。医療提供者は、CCBをベータ遮断薬、利尿薬、またはアンジオテンシン変換酵素阻害薬に置き換えることができます。これらはいずれも口腔組織に影響を与えません。フェニトインは、カルバマゼピン、エトスクシミド、またはバルプロ酸ナトリウムに置き換えることができます24。シクロスポリンAはタクロリムスに置き換えることができます。これらの選択肢にもかかわらず、医師と患者は、特に病気が十分に管理されている場合や他の選択肢がすでに検討されている場合は、別のレジメンに切り替えることをためらうことがよくあります。投薬の変更が選択肢にない場合、一部の病変は非外科的に管理される可能性があります。 CCB誘発性歯肉増殖症の軽度の病変は、スケーリング、ルートプレーニング、抗菌性マウスリンスに好意的に反応します。
良好な口腔衛生は、さらなる炎症を防ぎ、定期的な非外科的歯周治療を含む専門的なケアで達成される肯定的な結果を維持する上で極めて重要です。フェニトインによって誘発される拡大に関しては、病変内のコラーゲンの含有量が高く、組織の著しい収縮を防ぐため、スケーリングおよびルートプレーニングに対する歯肉の反応はそれほど良好ではありません。
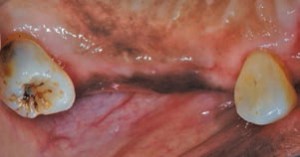
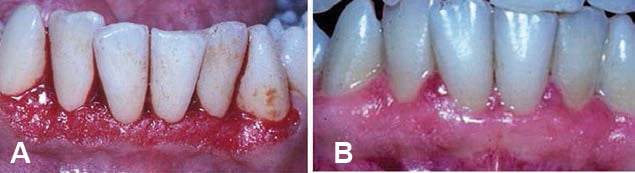
拡大した組織の外科的切除歯肉切除は、偽ポケットを排除し、組織の構造、外観、および機能を回復させることができます。この手順は、ブレード、外科用ナイフ、電気外科ユニット、またはレーザーを使用して実行されます(図7)。薬物誘発性歯肉増殖症の再発は、外科的または非外科的方法のいずれかで治療された症例で報告されています。特に、問題のある薬物の中止が一時的であるか、そもそも選択肢ではなかった場合です。再発は、介入後3〜6か月で発生する可能性があり、患者の40%に影響を及ぼします25。再発は、口腔衛生状態が悪い人や専門的なケアを受けられない人によく見られます(図8)。
薬物による歯肉増殖症は、さまざまな薬物療法によって引き起こされる可能性のある一般的な状態です。これらの病変は、プラーク関連病変と区別できる臨床マーカーを欠いており、診断が難しい場合があります。詳細な病歴は、薬物誘発性の歯肉増殖症を呈する患者の病因、診断、および治療の選択肢に関して臨床医を導くのに役立ちます。
- Merritt HH、PutnamTJ。画期的な記事1938年9月17日:けいれん性障害の治療におけるジフェニルヒダントン酸ナトリウム。ジャマ。 1984; 251:1062-1067。
- キンボールOP。ジフェニルヒダントイン酸ナトリウムによるてんかんの治療。ジャマ。 1939; 112:1244–1245。
- Casetta I、Granieri E、Desidera M、etal。フェニトイン誘発性の歯肉増殖症:イタリアのフェラーラでのコミュニティベースの横断的研究。神経疫学。 1997; 16:296–303。
- バトラーRT、カルクワーフKL、カルダールWB。薬物誘発性歯肉増殖症:フェニトイン、シクロスポリン、およびニフェジピン。 J Am DentAssoc。 1987; 114:56–60。
- Lederman D、Lumerman H、Reuben S、FreedmanPD。ニフェジピン療法に関連する歯肉増殖症。事件の報告。 Oral Surg Oral Med OralPathol。 1984; 57:620–622。
- Barak S、Engelberg IS、HissJ。ニフェジピンによって引き起こされる歯肉増殖症。組織病理学的所見。 JPeriodontol。 1987; 58:639–642。
- Fattore L、Stablein M、Bredfeldt G、Semla T、Moran M、Doherty-GreenbergJM。歯肉増殖症:ニフェジピンとジルチアゼムの副作用。スペックケア歯科医。 1991; 11:107–109。
- Miller CS、DammDD。歯科集団におけるベラパミル誘発性歯肉増殖症の発生率。 JPeriodontol。 1992; 63:453–456。
- JorgensenMG。アムロジピン関連の歯肉増殖症の有病率。 JPeriodontol。 1997; 68:676–678。
- Borel JF、Feurer C、MagnéeC、StähelinH。動物における新しい抗リンパ球ペプチドシクロスポリンAの効果。免疫学。 1977; 32:1017-1025。
- Rateitschak-PlüssEM、Hefti A、LörtscherR、ThielG。シクロスポリン-Aがヒトの歯肉増殖症を誘発するという最初の観察。 JClinPeriodontol。 1983; 10:237–246。
- Friskopp J、KlintmalmG。歯肉増殖症。シクロスポリンとアザチオプリンで治療された腎同種移植レシピエントの比較。 Swed Dent J. 1986; 10:85–96。
- Pernu HE、Pernu LM、Huttunen KR、Nieminen PA、KnuuttilaML。免疫抑制薬および考えられる局所的背景因子に関連する腎移植レシピエント間の歯肉増殖症。 JPeriodontol。 1992; 63:548–553。
- KeownPA。新しい免疫抑制戦略。 Curr Opin NephrolHypertens。 1998; 7:659–663。
- マーシャルRI、バートールドPM。薬物誘発性歯肉増殖症の臨床レビュー。 Aust Dent J. 1999; 44:219–232。
- Demirer S、Ozdemir H、Sencan M、Marakoglu I.急性単球性白血病の早期診断口腔症状としての歯肉増殖症:症例報告。 EurJデント。 2007; 1:111–114。
- Wu J、Fantasia JE、Kaplan R.急性骨髄単球性白血病の口腔症状:症例報告と白血病の分類のレビュー。 JPeriodontol。 2002; 73:664–668。
- Barclay S、Thomason JM、Idle JR、SeymourRA。ニフェジピン誘発性の歯肉増殖症の発生率と重症度。 JClinPeriodontol。 1992; 19:311–314。
- Lucas RM、Howell LP、WallBA。ニフェジピン誘発性歯肉増殖症。組織化学的および超微細構造の研究。 JPeriodontol。 1985; 56:211–215。
- Pernu HE、Knuuttila MLE、Huttenen KRH、TiilikainenASK。薬物誘発性の歯肉増殖症およびクラスI1の主要組織適合抗原。移植。 1994; 57:1811–1813。
- Johnson RB、Zebrowski EJ、DaiX。invitroでニフェジピンとインターロイキン-1-ベータに曝露されたヒト歯肉線維芽細胞によるコラーゲンタンパク質合成の相乗的増強。 J Oral PatholMed。 2000; 29:8–12。
- Ellis JS、Seymour RA、Steele JG、Robertson P、Butler TJ、ThomasonJM。カルシウムチャネル遮断薬によって誘発される歯肉増殖症の有病率:コミュニティベースの研究。 JPeriodontol。 1999; 70:63–67。
- Daley TD、Wysocki GP、DayC。シクロスポリン誘発性歯肉過形成における臨床的および薬理学的相関。 Oral Surg Oral Med OralPathol。 1986; 62:417–421。
- Seymour RA、Smith DG、TurnbullDN。 成人てんかん患者の歯周の健康に対するフェニトインとバルプロ酸ナトリウムの効果。 JClinPeriodontol。 1985; 12:413–419。
- Ilgenli T、Atilla G、BaylasH。薬物誘発性歯肉増殖症の患者における歯周治療の有効性。 長期的な結果。 JPeriodontol。 1999; 70:967–972。