- Das Vorhandensein hoher Antikörperkonzentrationen (Titer > 1: 640) sollte den Verdacht auf eine Autoimmunerkrankung aufkommen lassen vorhanden. In diesem Szenario empfehle ich, die Seren dann auf Antikörper gegen dsDNA, Sm, RNP, Ro (SS-A), La (SS-B) und möglicherweise Scl-70 zu testen. Das Vorhandensein von Antikörpern gegen einen dieser Antikörper erhöht die Wahrscheinlichkeit, dass der Patient an SLE, MCTD, Sjögren oder Sklerodermie leidet, erheblich. Einige Labore testen diese Antikörper automatisch, wenn die Screening-ANA positiv ist. Das Vorhandensein dieser Antikörper ist jedoch keine Diagnose für eine Krankheit. Wenn keine Erstdiagnose gestellt werden kann, ist es meine Praxis, den Patienten im Laufe der Zeit sorgfältig auf die Entwicklung einer ANA-assoziierten Krankheit zu beobachten und den Patienten mindestens zweimal jährlich zu sehen.
- Die Kombination niedriger Titer von Antikörper (< 1:80) und keinen oder wenigen Anzeichen oder Symptomen einer Krankheit deuten auf eine viel geringere Wahrscheinlichkeit einer Autoimmunerkrankung hin. Infolgedessen müssen diese Patienten mit niedrigen ANA-Titern weniger häufig neu bewertet werden – jährlich, es sei denn, klinische Symptome deuten auf eine Autoimmunerkrankung hin.
- Bei einem Patienten mit negativer ANA ist es sehr unwahrscheinlich, dass er an SLE oder MCTD leidet , Sjögren oder Sklerodermie. Wenn es jedoch immer noch starke klinische Hinweise auf eine systemische Autoimmunerkrankung gibt, kann man auf die spezifischen Antikörper gegen doppelsträngige (ds) DNA, Sm, RNP, Ro, La oder Scl-70 testen, obwohl nach meiner Erfahrung Sie sind normalerweise negativ. Dennoch ist es ratsam, solche Patienten zu sehen, bei denen mindestens einmal jährlich ein hoher klinischer Verdachtsindex besteht – wenn klinisch indiziert jedoch häufiger.
- Antinukleäre Antikörper erzeugen eine Vielzahl von Färbungsmustern (homogen, diffus) , peripher, rand, gesprenkelt, nukleolar, antizentromer usw.). Es wurde erkannt, dass das Kernfärbungsmuster eine relativ geringe Empfindlichkeit und Spezifität für verschiedene Autoimmunerkrankungen aufweist. Das Vorhandensein von Antikörpern gegen bestimmte Kernantigene ist normalerweise nützlicher. (Diese Antikörper umfassen Folgendes: dsDNA, Sm, RNP, Ro, La oder Scl-70.)
In den letzten Jahren haben Forscher und Biotech-Unternehmen Festphasen entwickelt Immunoassays als Ersatz für den IF-ANA-Test.4-23 Die Gründe für diesen Versuch beziehen sich auf die Leistungsmerkmale der IF-Technik. Dieser Test ist sehr arbeitsintensiv und kann aufgrund unterschiedlicher Interpretationen durch Techniker variieren. Erschwerend ist auch das Ausbleichen des Bildes, wenn es in einem Fluoreszenzmikroskop untersucht wird. Darüber hinaus verwendet die IF-Technik Reihenverdünnungen von Patientenseren, die Ergebnisse liefern, die möglicherweise nicht linear sind. Bei täglichen Tests an derselben Probe sind zweifache Variationen des Titers üblich. Vierfache Unterschiede sollen „signifikant“ sein. Im Gegensatz dazu sind Festphasen-Immunoassays automatisiert und hoch reproduzierbar. Die Ergebnisse sind linear und die Technik ist weniger arbeitsintensiv und daher billiger durchzuführen.
Aufgrund dieser Überlegungen sollten wirtschaftliche Einsparungen erzielt werden Verwendung eines Festphasen-Immunoassays zur Quantifizierung einer ANA. Bei dem Versuch, Festphasen-ANA-Immunoassays zu entwickeln, haben daher eine Reihe von Gruppen die Festphasen auf die Festphase gebracht, welche Antigene typischerweise in den spezifischeren ANA-Immunoassays (z. B. DNA, Sm, RNP, Ro / SSA, La / SSB, Nukleoprotein, Zellextrakte usw.) In veröffentlichten Berichten ist der Korrelationskoeffizient zwischen ANA-Titern und diesen Festphasentests recht gut. Daher haben viele kommerzielle Unternehmen ihre ANAs gewechselt zu diesen Festphasen-Immunoassays.4-23 Besorgniserregend ist jedoch die hohe Häufigkeit / der Prozentsatz falsch-negativer Ergebnisse bei Patienten mit bekanntem SLE und verwandten Krankheiten sowie die anhaltend hohe Häufigkeit „falsch-positiver“ (z. eine positive ANA bei jemandem ohne SLE) in diesen Studien.15-21 Weitere Arbeiten sind erforderlich, um die Empfindlichkeit und insbesondere die Spezifität dieser Festphasen-Immunoassays zu verbessern und sicherzustellen, dass Patienten mit SLE und verwandten Krankheiten von diesen Festphasen-Immunoassays nicht übersehen werden.
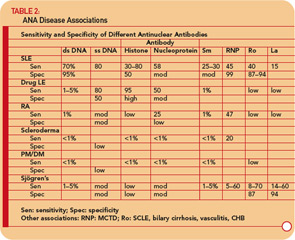
Antikörper gegen DNA
Antikörper gegen DNA können hauptsächlich in solche unterteilt werden, die mit einzelsträngiger (ss) DNA reagieren, und solche, die dsDNA erkennen.24-26
Anti- ssDNA-Antikörper wurden bei SLE, rheumatoider Arthritis, arzneimittelbedingtem Lupus, gesunden Verwandten von Patienten mit SLE und seltener bei anderen rheumatischen Erkrankungen berichtet. (Siehe Tabelle 2, S. 17.) Daher ist Anti-ssDNA für die Diagnose von SLE oder anderen rheumatischen Erkrankungen nur begrenzt geeignet. Anti-ssDNA korreliert nicht gut mit der Krankheitsaktivität und ist daher für das Krankheitsmanagement nicht nützlich.
Antikörper gegen dsDNA werden am häufigsten durch Festphasen-Immunoassays, aber auch in einigen Labors durch den Crithidia-IF-Assay oder nachgewiesen gelegentlich der Farr-Radioimmunoassay.Die meisten Krankenhaus- und kommerziellen Labors machen nur eines. Der Farr-Assay weist wahrscheinlich die höchste Spezifität und die niedrigste Empfindlichkeit der drei Assays für die Diagnose von SLE auf, während Festphasentests die höchste Sensitivität und niedrigste Spezifität aufweisen. Der Crithidia-Assay liegt dazwischen. Der Farr-Assay hat auch den Nachteil, dass radioaktives Material verwendet wird, das die meisten Labors meiden, und der Crithidia-Test ist sehr arbeitsintensiv. Ich bevorzuge den ELISA-Test für den täglichen Gebrauch.
Anti-dsDNA ist spezifisch (95%), jedoch nicht hochempfindlich (70%) für SLE, was sie für die Diagnose sehr positiv macht.9 (siehe Tabelle 2) , S. 17.) Sie treten gelegentlich bei anderen Erkrankungen auf, einschließlich rheumatoider Arthritis, juveniler Arthritis, arzneimittelinduziertem Lupus, Autoimmunhepatitis und sogar bei normalen Personen.
Titer von Anti-dsDNA-Antikörpern schwanken häufig mit Krankheitsaktivität, insbesondere Lupusnephritis, und sind daher bei vielen Patienten nützlich, um den Verlauf von SLE zu verfolgen. Wenn ein Patient einen steigenden Titer oder einen sehr hohen Titer hat, sich aber klinisch im Ruhezustand befindet, behandle ich die serologische Anomalie nicht, sondern betrachte sie als Warnsignal dafür, dass der Patient genauer beobachtet und behandelt werden muss, wenn klinisch etwas passiert, um eine zu rechtfertigen Änderung der Therapie. Einige Forscher haben diese serologischen Anomalien jedoch behandelt (insbesondere wenn sie mit niedrigen Komplementspiegeln verbunden sind) und über verbesserte klinische Ergebnisse berichtet. Umgekehrt verwende ich einen fallenden Titer bei jemandem, der nach einem Aufflackern der Behandlung besser wird, als Leitfaden für die Reduzierung der Behandlung (z. B. Kortikosteroide und / oder Immunsuppressiva).
Die Assoziation zwischen Anti-dsDNA-Antikörpern und anderen Krankheitsmanifestationen von SLE sind weit weniger klar. Zum Beispiel gibt es keine Beziehung zwischen dem Anti-dsDNA-Titer und der Krankheitsaktivität von neuropsychiatrischem SLE.
Die Unterscheidung aktiver Lupusmanifestationen von infektiösen Komplikationen oder toxischen Wirkungen von Arzneimitteln – und von nicht verwandten Krankheiten – ist immer eine Herausforderung. Das Vorhandensein von Anti-dsDNA-Antikörpern kann bei einigen Patienten hilfreich sein, um diese Unterscheidung zu treffen.
Anti-Smith- und Anti-Ribonukleoprotein-Antikörper
Antikörper gegen Smith (Sm) und Anti-Ribonukleoprotein (Anti-RNP) werden am häufigsten durch Festphasen-Immunoassays nachgewiesen.24,27
Anti-Sm-Antikörper werden nur bei 10% bis 40% der Patienten mit SLE gefunden, sind jedoch bei Patienten mit SLE sehr selten andere Bedingungen (dh sie sind nicht empfindlich, aber hochspezifisch). Die Messung von Anti-Sm-Titern kann diagnostisch nützlich sein, insbesondere zu einer Zeit, in der Anti-DNA-Antikörper nicht nachweisbar sind. Angesichts der relativ geringen Empfindlichkeit von Anti-Sm schließt ein negativer Wert jedoch die Diagnose von SLE in keiner Weise aus.
Anti-RNP-Antikörper werden bei etwa 40% bis 60% der Patienten mit SLE gefunden, jedoch sind nicht spezifisch für SLE und ein bestimmendes Merkmal von MCTD. Diese Antikörper können auch bei niedrigen Titern und niedrigen Frequenzen bei anderen rheumatischen Erkrankungen wie RA und Sklerodermie auftreten. (Siehe Tabelle 2, S. 17.)
Weder der Titer (die Spiegel) von Anti-Sm- noch Anti-RNP-Antikörpern korreliert mit einer klinischen Aktivität.
Anti-Ro / SSA und Anti-La / SSB-Antikörper
Antikörper gegen Ro / SSA und La / SSB werden am häufigsten durch Festphasen-Immunoassays nachgewiesen.28,29 Anti-Ro / SSA und Anti-La / SSB wurden nachgewiesen in hoher Häufigkeit bei Patienten mit Sjögren-Syndrom und bei SLE, aber auch bei Patienten mit lichtempfindlicher Dermatitis und bei 0,1% bis 0,5% der gesunden Erwachsenen.
Anti-Ro / SSA-Antikörper werden in etwa 50% gefunden von Patienten mit SLE. (Siehe Tabelle 2, S. 17.) Sie wurden mit Lichtempfindlichkeit, subakutem Hautlupus, Hautvaskulitis (tastbare Purpura), interstitieller Lungenerkrankung, neonatalem Lupus und angeborenem Herzblock in Verbindung gebracht. Anti-Ro / SSA-Antikörper werden bei etwa 75% der Patienten mit primärem Sjögren-Syndrom gefunden (siehe Tabelle 2, S. 17), und hohe Titer dieser Antikörper sind mit einer höheren Inzidenz von zusätzlichen Drüsenmerkmalen, insbesondere Purpura und Vaskulitis, verbunden. Im Gegensatz dazu sind Ro / SSA-Antikörper nur bei 10 bis 15% der Patienten mit sekundärem Sjögren-Syndrom im Zusammenhang mit rheumatoider Arthritis vorhanden. Daher unterstützt das Vorhandensein von Ro / SSA- oder Anti-La / SSB-Antikörpern bei Patienten mit Verdacht auf primäres Sjögren-Syndrom die Diagnose nachdrücklich.
Ungefähr 50% der Patienten mit SLE, die Anti-Ro-Antikörper haben, haben auch Anti -La-Antikörper, ein eng verwandtes RNA-Protein-Antigen. In ähnlicher Weise haben die meisten Patienten mit Sjögren-Syndrom auch Anti-La (SSB) -Antikörper. Es ist äußerst selten, Patienten mit Anti-La-Antikörpern ohne Anti-Ro-Antikörper zu finden.
Meiner Meinung nach lauten die Indikationen für die Bestellung eines Anti-Ro / SSA- und Anti-La / SSB-Antikörpertests wie folgt:
- Frauen mit SLE, die schwanger sind oder kann in Zukunft schwanger werden;
- Frauen, bei denen in der Vergangenheit ein Kind mit Herzblock oder Myokarditis geboren wurde;
- Patienten mit unerklärlichen lichtempfindlichen Hautausschlägen in der Vorgeschichte;
- Patienten mit starkem Verdacht auf SLE, die jedoch einen negativen ANA-Test haben; oder
- Patienten mit Symptomen von Xerostomie, Keratokonjunktivitis sicca und / oder Speichel- und Tränendrüsenvergrößerung.
Antiribosomale P-Protein-Antikörper
Anti- Ribosomale P-Protein-Antikörper wurden bei 10% bis 20% der Patienten mit SLE in den USA und 40% bis 50% der asiatischen Patienten mit SLE nachgewiesen, jedoch selten bei anderen rheumatischen Erkrankungen.30 Anti-ribosomale P-Protein-Antikörper können hoch sein spezifisch für Lupus-assoziierte Psychosen, obwohl nicht alle Studien dies bestätigt haben. Depressionen und Nieren- und Leberbeteiligung bei Patienten mit Lupus wurden in einigen kleinen Studien auch mit antiribosomalen P-Protein-Antikörpern in Verbindung gebracht.
Aufgrund der geringen Empfindlichkeit und der schlechten klinischen Korrelation sehen viele Forscher – einschließlich mir – wenig klinischer Nutzen in diesem Test.
Anti-Centromer-Antikörper
Anti-Centromer-Antikörper (ACAs) werden fast ausschließlich bei Patienten mit begrenzter kutaner systemischer Sklerose (lcSSc) gefunden, insbesondere bei Patienten mit CREST.31 ACAs wurden bei 57% der Patienten mit CREST beobachtet, aber auch bei Patienten mit anderen Erkrankungen, einschließlich bei einigen Patienten mit Raynaud-Phänomen allein. ACAs werden typischerweise durch das charakteristische IF-Muster auf Hep-2-Zellen nachgewiesen.
Anti-Scl-70 (Topoisomerase-1) -Antikörper
Ungefähr 15% bis 20% der Patienten mit Sklerodermie Antikörper gegen ein 70-kd-Protein (Topoisomerase-1) haben, das nachfolgend als Scl-70.31 bezeichnet wird. Das Vorhandensein dieser Antikörper scheint das Risiko für Lungenfibrose bei Patienten mit Sklerodermie zu erhöhen und ist sehr spezifisch für die Krankheit.
Zusammenfassung
Wenn man SLE aufgrund der Vorgeschichte vermutet, physisch Untersuchung und vollständiges Blutbild (z. B. Leukopenie, Thrombozytopenie) fordern einen ANA-Test an. Wenn es negativ ist, ist es sehr unwahrscheinlich, dass der Patient SLE hat, und der Patient kann beruhigt werden. Wenn der Titer < 1: 160 ist, ist SLE unwahrscheinlich, und der Patient kann beruhigt werden, dass SLE unwahrscheinlich ist, aber der Patient sollte regelmäßig überwacht werden. Ein Titer von ≥ 1: 160 erhöht die Wahrscheinlichkeit von SLE und verwandten Störungen. Es ist jedoch wichtig zu bedenken, dass 85% der Personen mit einer positiven ANA keinen SLE haben. Wenn die ANA positiv ist, sollte man auch auf Antikörper gegen dsDNA, Sm, RNP, Ro / SSA und La / SSB testen. Das Vorhandensein dieser Antikörper erhöht die Wahrscheinlichkeit, dass der Patient an SLE und verwandten Störungen leidet (siehe Tabelle 2, S. 17), erheblich, und der Patient muss genauer beobachtet werden. Der Nachweis von Anti-Centromer- und Anti-Scl-70-Antikörpern ist sehr nützlich für die Diagnose von Sklerodermie. Der Nachweis von Antikörpern gegen Ro / SSA und La / SSB ist auch zur Diagnose des Sjögren-Syndroms nützlich.
Der einzige dieser Tests, der zur Überwachung der Aktivität nützlich ist, ist die Anti-dsDNA. P. >
Danksagung: Ich bin der Arbeit vieler Autoren von UpToDate in Medicine zu Dank verpflichtet, deren Arbeit einen nützlichen Rahmen für die Entwicklung dieses Papiers bot, sowie Dr. Robert Shmerling, David Lee und Donald Bloch, mit denen ich Artikel und Kapitel zu demselben Thema geschrieben habe.
Dr. Schur ist Professor für Medizin an der Harvard Medical School und der Abteilung für Rheumatologie, Immunologie und Allergie in der Abteilung für Medizin am Brigham and Women’s Hospital in Boston.
- Reichlin M. Messung und klinische Bedeutung von antinukleäre Antikörper. Auf dem neusten Stand. Oktober 2008.
- Ad-hoc-Ausschuss für immunologische Testrichtlinien des American College of Rheumatology. Richtlinien für immunologische Labortests bei rheumatischen Erkrankungen: Eine Einführung. Arthritis Rheum. 2002; 47: 429-433. Solomon DH, Kavanaugh AJ, Schur PH, et al. Evidenzbasierte Richtlinien für die Verwendung immunologischer Tests: Antinukleäre Antikörpertests. Arthritis Rheum. 2002; 47: 434-444.
- Sinclair D., Saas M., Williams D., Hart M., Goswami R. Kann ein ELISA die Immunfluoreszenz zum Nachweis von Anti-Kern-Antikörpern ersetzen? – Die routinemäßige Verwendung von Anti -nukleare Antikörper-Screening-ELISAs. Clin Lab. 2007; 53: 183-191. Avaniss-Aghajani E., Berzon S., Sarkissian A. Klinischer Wert von Multiplex-Immunoassays auf Perlenbasis zum Nachweis von Autoantikörpern gegen nukleare Antigene. Clin Vaccine Immunol. 2007; 14: 505-509. Copple SS, Martins TB, Masterson C., Joly E., Hill HR. Vergleich von drei Multiplex-Immunoassays zum Nachweis von Antikörpern gegen extrahierbare Kernantikörper unter Verwendung klinisch definierter Seren. Ann N Y Acad Sci.2007; 1109: 464–472. Caramaschi P., Ruzzenente O., Pieropan S. et al. Bestimmung der ANA-Spezifität mittels Multiplex-Fluoreszenz-Mikrokügelchen-Immunoassay bei Patienten mit ANA-Positivität bei hohen Titern nach Infliximab-Behandlung: Vorläufige Ergebnisse. Rheumatol Int. 2007; 27: 649-654.
- Biagini RE, Parks CG, Smith JP, Sammons DL, Robertson SA. Analytische Leistung des AtheNA MultiLyte ANA II-Assays in Seren von Lupus-Patienten mit mehreren positiven ANAs. Anal Bioanal Chem. 2007; 388: 613–618. Gonzalez C., Garcia-Berrocal B., Perez M. et al. Labor-Screening von Bindegewebserkrankungen mit einem neuen automatisierten ENA-Screening-Assay (EliA Symphony) bei klinisch definierten Patienten. Clin Chim Acta. 2005; 359: 109–114.
- Eissfeller P., Sticherling M., Scholz D. et al. Vergleich verschiedener Testsysteme zur gleichzeitigen Autoantikörpererkennung bei Bindegewebserkrankungen. Ann N Y Acad Sci. 2005; 1050: 327-339.
- Smith J., Onley D., Garey C. et al. Bestimmung der ANA-Spezifität mit der UltraPlex-Plattform. Ann N Y Acad Sci. 2005; 1050: 286–294.
- Martins TB, Burlingame R., von Muhlen CA, et al. Bewertung eines Multiplex-Immunoassays mit fluoreszierenden Mikrosphären zum Nachweis von Autoantikörpern gegen Kernantigene. Clin Diagn Lab Immunol. 2004; 11: 1054–1059. Bernardini S., Infantino M., Bellincampi L. et al. Screening von antinukleären Antikörpern: Vergleich zwischen Enzymimmunoassay basierend auf Kernhomogenaten, gereinigten oder rekombinanten Antigenen und Immunfluoreszenztest. Clin Chem Lab Med. 2004; 42: 1155–1160. Nossent H, Rekvig OP. Antinukleäres Antikörperscreening in diesem neuen Jahrtausend: Abschied vom Mikroskop? Scand J Rheumatol. 2001; 30: 123 & ndash; 126; Diskussion 127-128.
- Lopez-Hoyos M., Rodriguez-Valverde V., Martinez-Taboada V. Durchführung eines Screenings auf Bindegewebserkrankungen mit antinukleären Antikörpern. Ann N Y Acad Sci. 2007; 1109: 322–329. Ghillani P., Rouquette AM, Desgruelles C. et al. Evaluierung des LIAISON ANA-Screen-Assays für antinukleäre Antikörpertests bei Autoimmunerkrankungen. Ann N Y Acad Sci. 2007; 1109: 407-413. Bonilla E., Francis L., Allam F. et al. Die Immunfluoreszenzmikroskopie ist fluoreszierenden Kügelchen zum Nachweis der Reaktivität antinukleärer Antikörper bei Patienten mit systemischem Lupus erythematodes überlegen. Clin Immunol. 2007; 124: 18-21. Nifli AP, Notas G., Mamoulaki M. et al. Vergleich eines Multiplex-Fluoreszenzassays auf Perlenbasis und von Immunfluoreszenzmethoden zum Nachweis von ANA- und ANCA-Autoantikörpern in Humanserum. J Immunol-Methoden. 2006; 311: 189-197. Shovman O., Gilburd B., Zandman-Goddard G. et al. Multiplexed AtheNA Multi-Lyte-Immunoassay für das ANA-Screening bei Autoimmunerkrankungen. Autoimmunität. 2005; 38: 105-109.
- Ulvestad E. Leistungsmerkmale und klinischer Nutzen eines Hybrid-ELISA zum Nachweis von ANA. Apmis. 2001; 109: 217-222. Olaussen E, Rekvig OP. Screening-Tests auf antinukleäre Antikörper (ANA): Selektive Verwendung zentraler nuklearer Antigene als rationale Grundlage für das Screening mittels ELISA. J Autoimmun. 1999; 13: 95-102. Homburger HA, Cahen YD, Griffiths J, Jacob GL. Nachweis von antinukleären Antikörpern: Vergleichende Bewertung von Enzymimmunoassays und indirekten Immunfluoreszenzmethoden. Arch Pathol Lab Med. 1998; 122: 993-999. Gniewek RA, Stites DP, McHugh TM, Hilton JF, Nakagawa M. Vergleich der Testmethoden für antinukleäre Antikörper: Immunfluoreszenz-Assay gegen Enzym-Immunoassay. Clin Diagn Lab Immunol. 1997; 4: 185-188. Reichlin M. Antikörper gegen DNA, SM und RNP. Auf dem neusten Stand. Oktober 2008.
- Hahn BH. Antikörper gegen DNA. New Engl J Med. 1998; 338: 1359.
- Kavanaugh AF, Solomon DH, Ad-hoc-Ausschuss für immunologische Testrichtlinien des American College of Rheumatology. Richtlinien für immunologische Labortests bei rheumatischen Erkrankungen: Anti-DNA-Antikörpertests. Arthritis Rheum. 2002; 47: 546-555.
- Benito-Garcia E., Schur PH, Lahita R. Richtlinien für immunologische Labortests bei rheumatischen Erkrankungen: Anti-Sm- und Anti-RNP-Antikörpertests. Arthritis Rheum. 2004; 51: 1030-1044. Reichlin M. Klinische Bedeutung von Anti-Ro / SSA- und Anti-La / SSB-Antikörpern. Auf dem neusten Stand. Oktober 2008.
- Reveille JD, Sherrer YRS, Solomon DH, Schur P, Kavanaugh A. Evidenzbasierte Richtlinien für die Verwendung immunologischer Labortests: Anti-Ro (SS-A) und La (SS- B): Ein Bericht des ACR-Ad-hoc-Ausschusses für Richtlinien für immunologische Tests. Zur Veröffentlichung eingereicht.
- Reichlin M. Antiribosomale P-Protein-Antikörper. Auf dem neusten Stand. Oktober 2008.
- Denton CP. Klassifikation der Sklerodermie. Auf dem neusten Stand. Oktober 2008.