증기 압력 강하
액체와 고체에 대한 장에서 설명했듯이 액체의 평형 증기압은 기체가 가하는 압력입니다. 증발 및 응축이 동일한 속도로 발생하는 단계 :
\ text {liquid} \ rightleftharpoons \ text {gas}
비 휘발성 물질 용해 휘발성 액체에서는 액체의 증기압이 낮아집니다. 이 현상은 액체의 기화 및 응축 과정에서 추가 된 용질 분자의 영향을 고려하여 합리화 할 수 있습니다. 증발하려면 용액 표면에 용매 분자가 있어야합니다. 용질의 존재는 용매 분자가 사용할 수있는 표면적을 감소시켜 용매 증발 속도를 감소시킵니다. 응축 속도는 용질의 존재에 영향을받지 않기 때문에 최종 결과는 증기 상 (즉, 더 낮은 증기압에서)에서 더 적은 용매 분자로 증발-응축 평형이 달성된다는 것입니다 (그림 1). 이 운동 학적 해석은 유용하지만 증기압 강하의 충돌 특성에 대한 몇 가지 중요한 측면을 설명하지 않습니다. 좀 더 엄격한 설명은 열역학에 관한 이후 텍스트 장에서 논의 할 주제 인 엔트로피의 속성과 관련됩니다. 액체의 증기압 저하를 이해하기 위해서는 별도의 용매 및 용질과 비교하여 용액의 엔트로피가 클수록 용매 분자를 효과적으로 안정화하고 기화를 방해한다는 점에 유의하는 것이 적절합니다. 이 모듈의 다음 섹션에 설명 된대로 증기압이 낮아지고 이에 따라 끓는점이 높아집니다.
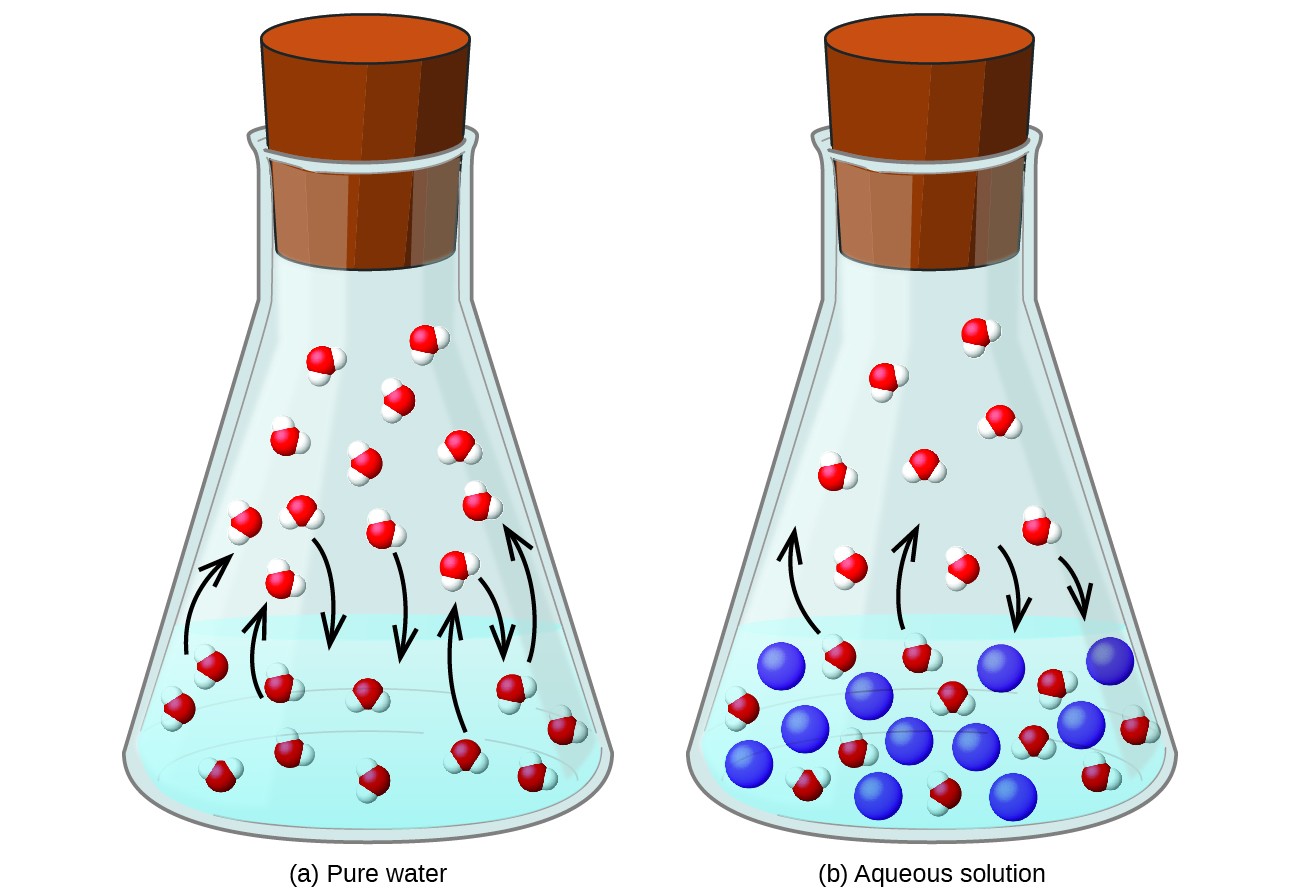
그림 1. 비 휘발성 용질의 존재는 용매 분자의 증발을 방해하여 용액의 증기압을 낮 춥니 다.
용액 성분의 증기압과 농도 사이의 관계 이러한 성분은 Raoult의 법칙에 의해 설명됩니다. 이상적인 솔루션의 모든 성분에 의해 가해지는 부분압은 순수한 성분의 증기압에 용액의 몰 분율을 곱한 것과 같습니다.
{P} _ {\ text {A}} = {X} _ {\ text {A}} {P} _ {\ text {A}} ^ {\ star}
기체 혼합물의 총 압력이 모든 구성 요소 (Dalton의 분압 법칙)에 대한 분압의 합과 같다는 점을 상기하면 i 구성 요소를 포함하는 용액에 의해 가해지는 총 증기압은 다음과 같습니다.
{ P} _ {\ text {솔루션}} = \ sum _ {i} {P} _ {i} = \ sum _ {i} {X} _ {i} {P} _ {i} ^ {\ star}
비 휘발성 물질은 증기압이 무시할 수있는 수준 (P ^ {\ star} ≈ 0)이므로 비 휘발성 용질 만 포함 된 용액 위의 증기압은 용매 때문입니다.
{P} _ {\ text {solution}} = {X} _ {\ text {solvent}} {P} _ {\ text {solvent}} ^ {\ star}
용액 증류
증류는 실험실과 산업 환경 모두에서 광범위하게 적용되는 혼합물의 성분을 분리하는 기술입니다. 석유 정제, 발효 생성물 분리 및 물 정화에 사용됩니다. 이 분리 기술은 하나 이상의 관심 성분을 선택적으로 증발, 응축 및 수집하기 위해 샘플 혼합물의 제어 된 가열을 포함합니다. 실험실 규모 증류를위한 일반적인 장치가 그림 2에 나와 있습니다.

그림 2. 일반적인 실험실 증류 장치는 (a) 사진과 (b) 구성 요소의 개략도에 나와 있습니다. (크레딧 a : “Rifleman82″/ Wikimedia commons에 의한 작업 수정; 크레딧 b : “Slashme”/ Wikipedia에 의한 작업 수정)
정유소는 대규모 분별 증류를 사용하여 원유 성분. 원유는 높은 분별 컬럼의 바닥에서 고온으로 가열되어 컬럼 내에서 상승하는 많은 성분을 증발시킵니다. 기화 된 구성품은 상승하는 동안 적절하게 냉각 영역에 도달하면 응축되어 수집됩니다. 수집 된 액체는 그림 3과 같이 다양한 용도 (예 : 디젤 연료, 등유, 가솔린)에 적합한 조성을 가진 탄화수소 및 기타 석유 화합물의 단순한 혼합물입니다.

그림 3. 원유는 다양한 단순한 혼합물을 분리하기 위해 대규모 분별 증류로 분리되는 복잡한 혼합물입니다.
끓는점 상승
액체 및 고체에 대한 장에서 설명한 것처럼 액체의 끓는점은 증기압이 주변 대기압과 동일한 온도입니다.용액의 증기압은 비 휘발성 용질의 존재로 인해 낮아지기 때문에 용액의 끓는점이 차후에 증가하는 이유가됩니다. 따라서 순수한 용매와 비교할 때 용액은 주변 대기와 동등한 증기압을 포함하여 주어진 증기압을 달성하기 위해 더 높은 온도가 필요합니다. 비 휘발성 용질이 용매에 용해되었을 때 관찰되는 끓는점의 증가 (ΔTb)를 끓는점 상승이라고하며 용질 종의 몰 농도에 정비례합니다.
\ Delta {T} _ {\ text {b}} = {K} _ {\ text {b}} m
여기서 Kb는 끓는점 고도 상수 또는 ebullioscopic 상수이고 m은 모든 용질 종의 몰 농도 (몰 농도).
끓는점 상승 상수는 용매의 특성에 따라 달라지는 특성입니다. 여러 용매에 대한 Kb 값은 표 1에 나열되어 있습니다.
용매의 증기압이 낮아지고 끓는점이 상승하는 정도는 주어진 양에 존재하는 용질 입자의 총 수에 따라 다릅니다. 입자의 질량이나 크기 또는 화학적 정체성이 아닌 용매의. 1m 수 크로스 수용액 (342g / mol)과 1m 에틸렌 글리콜 수용액 (62g / mol)은 각 용액이 용매 1kg 당 1 몰의 용질 입자 (분자)를 갖기 때문에 동일한 비등점을 나타냅니다. .
예 6 : 요오드 용액의 끓는점
800.0 g의 클로로포름, CHCl3에서 92.1 g의 요오드 I2 용액의 끓는점 찾기 , 요오드가 비 휘발성이고 솔루션이 이상적이라고 가정합니다.
학습 확인
1.0g의 용액의 끓는점은 얼마입니까? 글리세린, C3H5 (OH) 3, 물 47.8g에? 이상적인 솔루션이라고 가정합니다.
어는점 강하

그림 4. 암염 ( NaCl), 염화칼슘 (CaCl2) 또는이 둘의 혼합물을 사용하여 얼음을 녹입니다. (출처 : Eddie Welker의 작업 수정)
용액은 순수한 액체보다 낮은 온도에서 동결됩니다. 이 현상은 도로와 보도에서 얼음을 녹이기 위해 소금 (그림 4), 염화칼슘 또는 요소를 사용하는 “제빙”방식과 자동차 라디에이터에서 “부동액”으로 에틸렌 글리콜을 사용하는 방식에서 활용됩니다. 바닷물은 담수보다 낮은 온도에서 얼기 때문에 북극과 남극 바다는 0 ° C 이하의 온도에서도 얼지 않은 상태를 유지합니다 (이 바다에 사는 물고기 및 기타 냉혈 바다 동물의 체액처럼).
순수 용매 ΔTf에 비해 희석 용액의 어는점 감소를 어는점 강하라고하며 용질의 몰 농도에 정비례합니다.
\ Delta {T} _ {\ text {f}} = {K} _ {\ text {f}} m
여기서 m은 용질의 몰 농도입니다. 용매와 Kf를 어는점 강하 상수 (또는 극저온 상수)라고합니다. 끓는점 상승 상수와 마찬가지로 이들은 값이 용매의 화학적 특성에 따라 달라지는 특징적인 특성입니다. 여러 용매에 대한 Kf 값은 표 1에 나열되어 있습니다.
결합 특성 및 탈빙
염화나트륨 및 그 그룹 2 유사체 칼슘 및 염화 마그네슘은 종종 제빙 도로 및 인도는 이러한 염 중 하나의 용액이 순수한 물의 빙점 인 0 ° C 미만의 빙점을 가지기 때문입니다. 2 족 금속염은 NaCl보다 부식성이 덜하고 어는점을 더 많이 내리는 경향이 있기 때문에 도로에서 사용하기 위해 더 저렴하고 쉽게 구할 수있는 염화나트륨 ( “암염”)과 자주 혼합됩니다. , 그들은 분리되어 염화나트륨과 같은 두 개의 입자가 아니라 공식 단위당 세 개의 입자를 생성하기 때문에.
이 이온 화합물은 금속의 부식을 촉진하는 경향이 있기 때문에 사용하기에 현명한 선택이 아닙니다. 차량의 라디에이터 부동액을 사용하거나 이륙 전에 비행기를 제빙하십시오.이러한 응용 분야에서는 에틸렌 또는 프로필렌 글리콜과 같은 공유 화합물이 자주 사용됩니다. 라디에이터 유체에 사용되는 글리콜은 액체의 어는점을 낮출뿐만 아니라 끓는점을 높여서 겨울과 여름 모두에 유용합니다. 이미 형성된 얼음을 제거하고 더 많은 얼음이 형성되는 것을 방지하기 위해 겨울철 혹독한 날씨에 이륙하기 전에 가열 된 글리콜을 항공기 표면에 분사하는 경우가 많습니다. 이는 항공기의 제어 표면에 형성 될 경우 특히 위험 할 수 있습니다 (그림 5).

그림 5. 어는점 함몰을 이용하여 (a) 도로에서 얼음 제거 및 (b) 항공기의 제어 표면.
해결책을위한 위상 다이어그램
증기압, 끓는점 및 빙점에 대한 충돌 효과 이전 섹션에서 설명한 내용은 순수한 액체와 해당 액체에서 파생 된 용액에 대한 상 다이어그램을 비교하여 편리하게 요약됩니다. 물과 수용액의 상 다이어그램은 그림 6에 나와 있습니다.
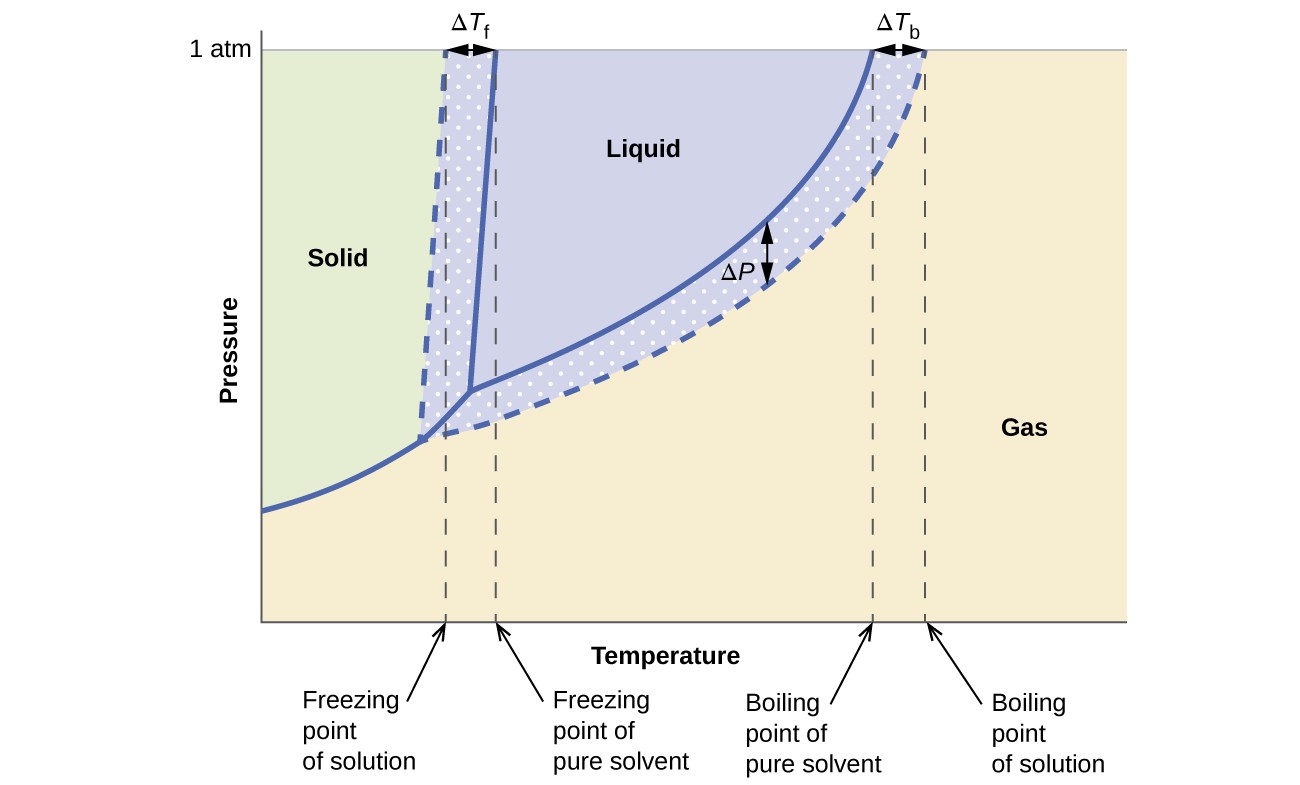
그림 6. 이러한 단계 다이어그램은 물 (실선 곡선)과 비전해질 수용액 (점선 곡선)을 보여줍니다.
용액의 액체-증기 곡선은 용매의 해당 곡선 아래에 있으며 증기를 나타냅니다. 비 휘발성 용질의 용해로 인한 압력 저하, ΔP. 결과적으로, 주어진 압력에서 용액의 끓는점은 비 휘발성 용질의 존재와 관련된 끓는점 상승 ΔTb를 반영하여 순수한 용매보다 높은 온도에서 관찰됩니다. 용액에 대한 고체-액체 곡선은 용액 형성에 수반되는 빙점 강하 ΔTb를 나타내는 순수한 용매에 대한 곡선의 왼쪽으로 이동합니다. 마지막으로 용매와 용액에 대한 고체 가스 곡선이 동일합니다. 이것은 액체 용매와 비 휘발성 용질로 구성된 많은 용액의 경우입니다. 증발과 마찬가지로 이런 종류의 용액이 동결되면 실제로는 액체에서 고체로의 전이를 겪는 용매 분자 일 뿐이며 용질 종을 제외한 순수한 고체 용매를 형성합니다. 따라서 고체상과 기체상은 용매로만 구성되어 있으므로이 상 간의 전이는 충돌 효과의 영향을받지 않습니다.
용액의 삼투압 및 삼투압
다양한 자연 합성 물질은 선택적 투과를 나타내며, 이는 특정 크기, 모양, 극성, 전하 등의 분자 또는 이온 만 물질을 통과 (투과) 할 수 있음을 의미합니다. 생물학적 세포막은 자연에서 선택적 투과의 우아한 예를 제공하는 반면, 혈액에서 대사 폐기물을 제거하는 데 사용되는 투석 튜브는보다 단순한 기술 예입니다. 제조 방법에 관계없이 이러한 재료를 일반적으로 반투과성 멤브레인이라고합니다.
그림 7에 표시된 장치에서 순수한 용매와 용액의 샘플이 용매 만있는 멤브레인으로 분리되는 경우를 생각해보십시오. 분자가 스며들 수 있습니다. 용매 분자는 막을 통해 양방향으로 확산됩니다. 용매의 농도가 용액보다 순수한 용매에서 더 크기 때문에, 이러한 분자는 역방향보다 빠른 속도로 멤브레인의 용매 쪽에서 용액쪽으로 확산됩니다. 그 결과 순수한 용매에서 용액으로 용매 분자가 순전이됩니다. 반투막을 통한 용매 분자의 확산 구동 전달은 삼투로 알려진 과정입니다.
그림 7. (a) 용액과 순수한 용매는 처음에 삼투 막에 의해 분리됩니다. (b) 용액으로의 용매 분자의 순전이는 삼투압이 양방향으로 동일한 전달 속도를 생성 할 때까지 발생합니다.
그림 7과 같은 장치에서 삼투를 수행 할 때 , 용액의 부피는 용매의 축적에 의해 희석됨에 따라 증가합니다. 이로 인해 용액의 수준이 상승하여 정수압이 증가하고 (튜브에있는 용액 컬럼의 무게로 인해) 용매 분자가 순수한 용매 측으로 더 빠르게 이동합니다. 압력이 삼투압과 동일한 역 용매 이동 속도를 생성하는 값에 도달하면 용매의 대량 이동이 중단됩니다. 이 압력을 용액의 삼투압 (Π)이라고합니다. 희석 된 용액의 삼투압은 방정식에 따라 용질 몰 농도 M 및 절대 온도 T와 관련이 있습니다.
\ Pi = MRT
여기서 R은 범용 기체 상수입니다.
그림 8과 같은 장치에 용액을 넣은 경우 용액의 삼투압보다 큰 압력을 가하면 삼투가 역전되고 용액에서 용매 분자가 순수한 용매로 밀려납니다. 이 역삼 투 기술은 해수의 대규모 담수화에 사용되며 음용 용 고순도 수돗물을 생산하기 위해 소규모로 사용됩니다.
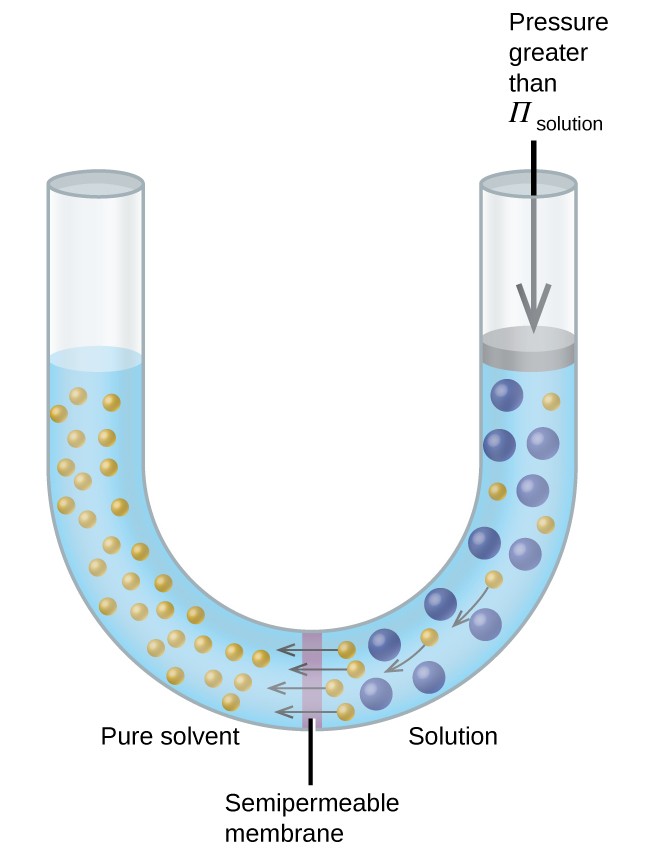
그림 8. 용액의 삼투압보다 큰 압력을 가하면 역삼 투가됩니다. 용액에서 나온 용매 분자는 순수한 용매로 밀어 넣습니다.
역삼 투 정수
삼투 과정에서 확산은 물을 덜 농축 된 용액에서 더 농축 된 용액으로의 반투막. 삼투압은 삼투를 멈추게하기 위해 더 농축 된 용액에 가해 져야하는 압력의 양입니다. 더 큰 압력이 가해지면 물은 더 농축 된 용액에서 덜 농축 된 (더 순수한) 용액으로 이동합니다. 이것을 역삼 투라고합니다. 역 삼투압 (RO)은 해안 도시의 담수화 플랜트에서 식료품 점의 정수기 (그림 9) 및 소규모 역삼 투 가정 장치에 이르기까지 다양한 응용 분야에서 물을 정화하는 데 사용됩니다. 수동 펌프를 사용하면 소형 RO 장치를 제 3 세계 국가, 재난 지역 및 구명정에서 사용할 수 있습니다. 우리 군대에는 차량을 타고 원격지로 이동할 수있는 다양한 발전기 작동 RO 유닛이 있습니다.

그림 9. 식수 정화를위한 역삼 투 시스템은 여기에 (a) 소규모 및 (b) 대규모로 표시됩니다. (크레딧 a : Jerry Kirkhart의 작업 수정; 크레딧 b : Willard J. Lathrop의 작업 수정)
삼투의 예는 세포가 다음과 같은 이유로 많은 생물학적 시스템에서 분명합니다. 반투막으로 둘러싸여 있습니다. 물을 잃어 절뚝 거린 당근과 셀러리는 물에 담그면 다시 바삭 바삭하게 만들 수 있습니다. 물은 삼투에 의해 당근이나 셀러리 세포로 이동합니다. 농축 소금 용액에 넣은 오이는 삼투에 의해 수분을 잃고 약간의 소금을 흡수하여 피클이됩니다. 삼투는 동물 세포에도 영향을 미칠 수 있습니다. 용액이 체내에 주입 될 때 용질 농도가 특히 중요합니다. 체세포 액과 혈청의 용질은이 용액에 약 7.7atm의 삼투압을 제공합니다. 체내에 주입 된 용액은 혈청과 동일한 삼투압을 가져야합니다. 즉, 혈청과 등장 성이어야합니다. 농도가 낮은 용액 인 저장성 용액을 충분한 양으로 주입하여 혈청을 희석하면 희석 된 혈청의 물이 삼투에 의해 혈액 세포로 들어가 세포가 팽창하고 파열됩니다. 이 과정을 용혈이라고합니다. 더 농축 된 용액 인 고혈압 용액이 주입되면 세포는 더 농축 된 용액으로 수분을 잃고 쪼그라 들며 화장이라고하는 과정에서 죽을 수 있습니다. 이러한 효과는 그림 10에 나와 있습니다.
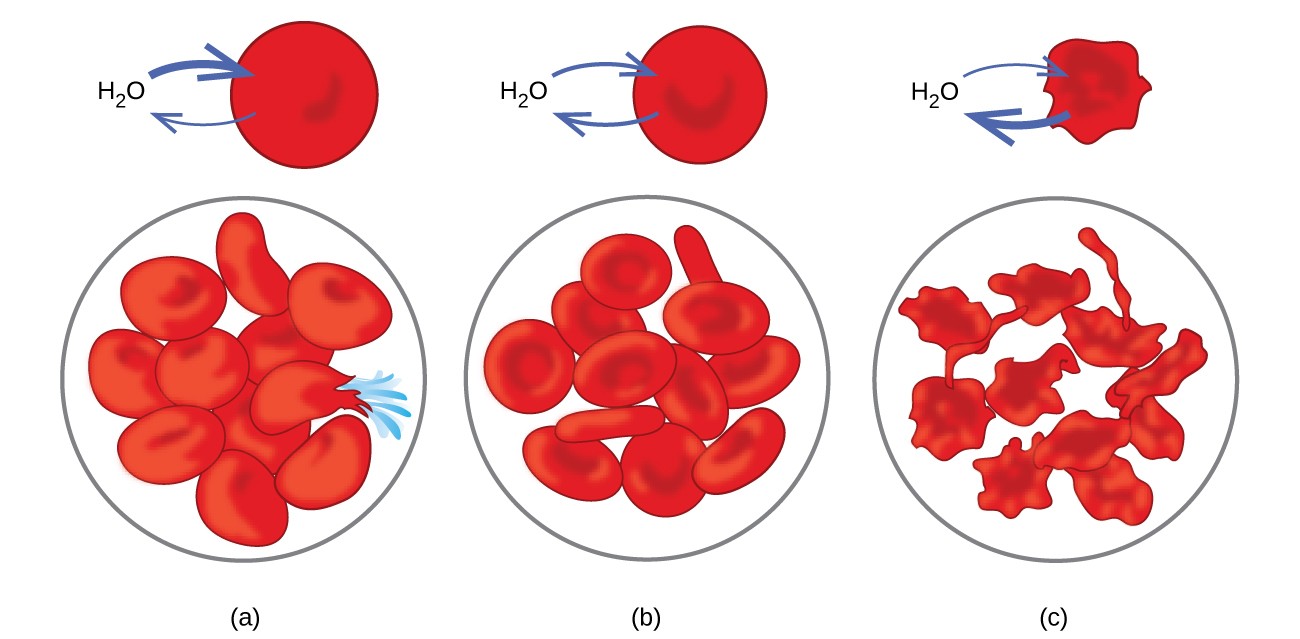
그림 10. 적혈구 막은 물이 투과 할 수 있으며 (a) 저장성 용액에서 부풀어 오르고 파열 될 수 있습니다. (b) 등장 용액에서 정상적인 부피와 모양을 유지합니다. 그리고 (c) 수축하고 고조파 용액에서 죽을 수 있습니다. (크레딧 a / b / c : “LadyofHats”/ Wikimedia commons에 의한 작업 수정)
몰 질량 결정
삼투압 및 빙점의 변화, 끓는점 점 및 증기압은 존재하는 용질의 농도에 정비례합니다. 따라서 이러한 특성 중 하나를 측정하여 측정에서 용질의 몰 질량을 결정할 수 있습니다.
전해질의 집합 적 특성
이 모듈에서 앞서 언급했듯이 용액의 결합 특성은 용해 된 용질 종의 수에 의존하지 않고 다양한 결합 특성에 대한 방정식의 농도 항 (어는점 강하)에 의존합니다. , 끓는점 상승, 삼투압)은 용액에 존재하는 모든 용질 종과 관련됩니다.이 장에서 지금까지 고려한 용액의 경우 용질은 해리 또는 기타 수반되는 과정없이 물리적으로 용해되는 비전해질이었습니다. 용해되는 le는 하나의 용해 된 용질 분자를 생성합니다. 그러나 전해질의 용해는 아래 두 가지 일반적인 예에서 설명하는 것처럼 간단하지 않습니다.
첫 번째 예를 고려하고 완전한 해리를 가정하면 1.0m NaCl 수용액은 2.0 몰의 이온 (1.0 몰 Na + 및 1)을 포함합니다.물 1kg 당 0 mol Cl−)이며 빙점 강하율은 다음과 같을 것으로 예상됩니다.
이 용액을 실제로 준비하고 빙점 강하를 측정하면 3.4 ° C의 값이 얻어진다. 다른 이온 화합물에 대해서도 유사한 불일치가 관찰되며, 측정 된 것과 예상되는 colligative 속성 값 간의 차이는 일반적으로 용질 농도가 증가함에 따라 더욱 중요해집니다. 이러한 관찰은 염화나트륨 (및 기타 강한 전해질)의 이온이 용액에서 완전히 해리되지 않음을 시사합니다.
이를 설명하고 전체 해리 가정에 수반되는 오류를 방지하기 위해 실험적으로 측정 된 매개 변수는 노벨상을 수상한 독일 화학자 Jacobus Henricus van’t Hoff의 영예가 사용됩니다. van’t Hoff 계수 (i)는 용해 된 공식 단위 수에 대한 용액 내 용질 입자의 비율로 정의됩니다.
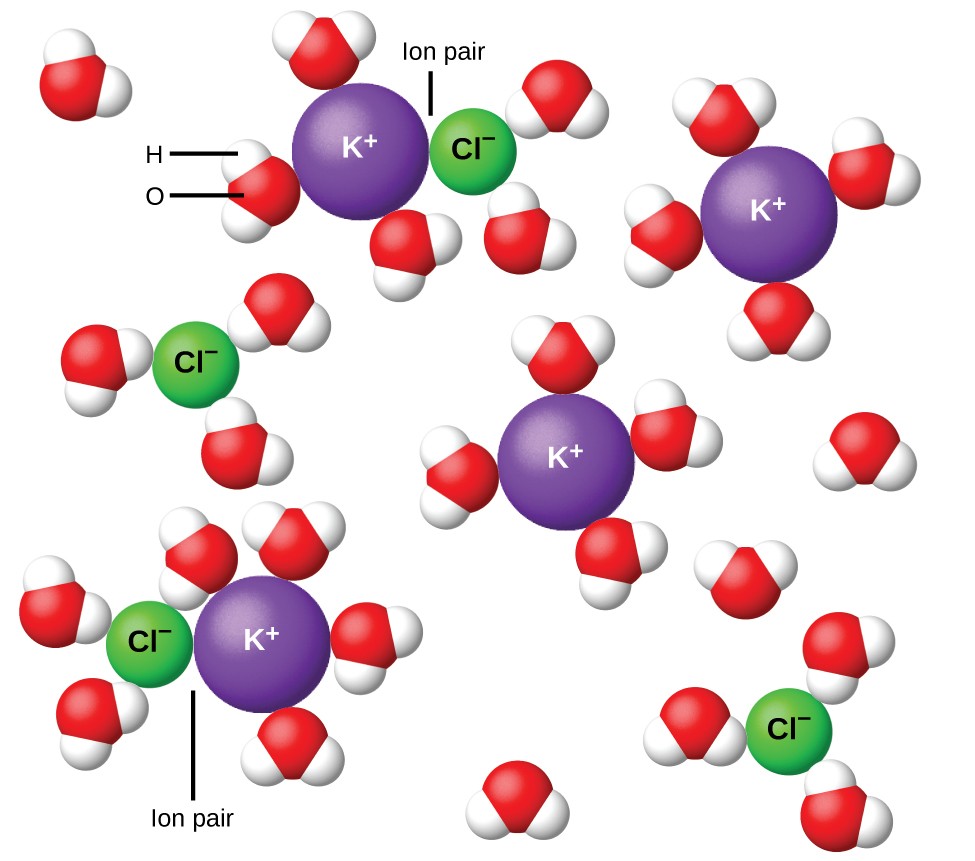
그림 11. 용액이 희석 될수록 이온은 점점 더 넓게 분리됩니다. 잔류 이온 결합력은 줄어 듭니다.
1923 년에 화학자 Peter Debye와 Erich Hückel은 강한 전해질의 불완전한 이온화를 설명하는 이론을 제안했습니다. 그들은 이온의 용 매화와 극성 용매의 절연 작용에 의해 수용액의 이온 간 인력이 매우 크게 감소하지만 완전히 무효화되지는 않는다고 제안했습니다. 잔류 어트랙션은 이온이 완전히 독립적 인 입자로 행동하는 것을 방지합니다 (그림 11). 어떤 경우에는 양이온과 음이온이 실제로 접촉하여 이온 쌍이라고하는 용 매화 된 단위를 제공 할 수 있습니다. 따라서 특정 종류의 이온의 활성 또는 유효 농도는 실제 농도로 표시된 것보다 적습니다. 용액이 희석 될수록 이온은 점점 더 넓게 분리되고 잔류 이온 결합력은 점점 줄어들게됩니다. 따라서 극도로 희석 된 용액에서 이온의 유효 농도 (활동)는 본질적으로 실제 농도와 동일합니다. 표 2의 전해질에 대한 van’t Hoff 계수는 0.05m 용액에 대한 것이며, 여기서 NaCl의 i 값은 1.9이고 이상적인 값은 2입니다.
예 11 : 전해질 용액의 어는점
바닷물의 이온 농도는 125g의 물에 용해 된 4.2g의 NaCl을 포함하는 용액의 것과 거의 같습니다. NaCl 용액의 각 이온이 물의 어는점에 비전해질 분자와 동일한 영향을 미친다고 가정하고 용액의 어는 온도 (해수의 어는 온도와 거의 동일)를 결정합니다.
학습 확인
염화칼슘의 각 이온 인 CaCl2, 물의 어는점에 비전해질 분자와 동일한 영향을 미칩니다. 물 175g에 CaCl2 0.724g 용액의 어는점을 계산합니다.
사용해보기
- 육류는 −1에 보관하더라도 신선 (냉동 아님)으로 분류 될 수 있습니다. ° C. 이 온도에서 고기가 얼지 않는 이유는 무엇입니까?
- 유기 화합물의 조성은 93.46 % C와 6.54 % H입니다. 이 화합물 0.090g을 녹나무 1.10g에 녹인 용액은 158.4 ° C에서 녹습니다. 순수한 녹나무의 녹는 점은 178.4 ° C입니다. 장뇌의 Kf는 37.7 ° C / m입니다. 용질의 분자식은 무엇입니까? 계산을 보여주세요.
- 염은 알칼리 금속 불화물로 알려져 있습니다. 어는점을 대략적으로 측정하면 물 100g에 4g의 소금이 용해되어 약 -1.4 ° C에서 얼어 붙는 용액이 생성됩니다. 소금의 공식은 무엇입니까? 계산 결과를 보여줍니다.
용어집
활성 : 용액 내 이온의 유효 농도; 이온 상호 작용으로 인해 실제 농도보다 낮습니다.
끓는점 상승 : 용질을 추가하여 액체의 끓는점 상승
끓는점 상승 상수 : 끓는점 상승과 용질 몰 랄리 티와 관련된 방정식의 비례 상수; ebullioscopic 상수라고도 함
colligative property : 용질 종의 농도에만 의존하는 용액의 특성
crenation : 물의 손실로 인해 생물학적 세포가 수축되는 과정 삼투에 의한
어는점 강하 : 용질을 추가하여 액체의 어는점을 낮 춥니 다.
어는점 강하 상수 : (또한, 극저온 상수) 관련 방정식의 비례 상수 용질 몰랄에 대한 빙점 강하
용혈 : 삼투에 의한 과도한 수분 축적으로 인한 적혈구 파열
고혈압 : 더 큰 삼투압
저혈압 : 낮은 삼투압
이온 쌍 : 적당한 정전기 인력에 의해 결합 된 용 매화 된 음이온 / 양이온 쌍
등장 성 : 동일한 삼투압
몰 농도 (m) : 용매의 질량에 대한 용질의 몰 수의 비율 (kg)로 정의되는 농도 단위
몰 분율 (X) : 모든 용액 성분의 총 몰수에 대한 용액 성분의 몰량 비율
삼투 : 반투막을 통한 용매 분자의 확산
삼투압 (Π ) : 반투과성 막을 통한 용매 분자의 대량 이동을 방지하는 데 필요한 반대 압력
라울 트 법칙 : 용액 성분에 의해 가해지는 부분압은 용액에서 성분의 몰분율과 그 평형의 곱과 같습니다. 순수한 상태의 증기압
반투과성 막 : 특정 이온 또는 분자의 통과를 선택적으로 허용하는 막
van’t Hoff 인자 (i) : 몰 수의 비율 용액에 용해 된 공식 단위의 몰 수에 대한 용액의 입자 수
- 비전해질 비교를 위해 표시됩니다. ↵

