- 항체 농도가 높으면 (역가 > 1 : 640)자가 면역 질환이 선물. 이 시나리오에서는 혈청에 dsDNA, Sm, RNP, Ro (SS-A), La (SS-B) 및 아마도 Scl-70에 대한 항체를 검사하는 것이 좋습니다. 이들 중 하나에 대한 항체의 존재는 환자가 SLE, MCTD, Sjögren ‘s 또는 scleroderma에 걸릴 가능성을 크게 증가시킵니다. 일부 실험실에서는 스크리닝 ANA가 양성일 때마다 이러한 항체를 자동으로 테스트합니다. 그러나 이러한 항체의 존재는 질병의 진단이 아닙니다. 초기 진단을 내릴 수없는 경우 ANA 관련 질병이 발생하는지 시간이 지남에 따라 환자를주의 깊게 관찰하고 적어도 1 년에 두 번 환자를 봅니다.
- 저역가의 조합 항체의 비율 (< 1:80)이고 질병의 징후 나 증상이 없거나 거의 없을 경우자가 면역 질환의 가능성이 훨씬 적습니다. 결과적으로 ANA 역가가 낮은 환자는자가 면역 질환을 암시하는 임상 증상이 발전하지 않는 한 매년 재평가를 덜 받아야합니다.
- ANA 음성 환자는 SLE, MCTD 중 하나를 가질 가능성이 거의 없습니다. , Sjögren ‘s 또는 scleroderma. 그러나 전신성자가 면역 장애에 대한 강력한 임상 증거가 여전히 존재한다면 이중 가닥 (ds) DNA, Sm, RNP, Ro, La 또는 Scl-70에 대한 특정 항체를 테스트 할 수 있습니다. 일반적으로 음수입니다. 그럼에도 불구하고 적어도 1 년에 한 번 임상 적으로 의심되는 높은 임상 지수가있는 환자를 보는 것이 현명합니다. 비록 임상 적으로 표시되는 경우 더 자주 발생합니다.
- 항상 투명 항체는 광범위한 염색 패턴 (균질, 확산)을 생성합니다. , 주변, 테두리, 얼룩, 핵, 반 중심체 등). 핵 염색 패턴은 다양한자가 면역 질환에 대해 상대적으로 낮은 민감도와 특이성을 갖는 것으로 인식되었습니다. 특정 핵 항원에 대한 항체의 존재가 일반적으로 더 유용합니다. (이러한 항체에는 dsDNA, Sm, RNP, Ro, La 또는 Scl-70이 포함됩니다.)
지난 몇 년 동안 조사자와 생명 공학 회사는 고체상을 개발해 왔습니다. IF ANA 테스트를 대체하기위한 면역 분석 4-23이 시도의 근거는 IF 기술의 성능 특성과 관련이 있습니다. 이 테스트는 노동 집약적이며 기술자의 다른 해석으로 인해 변경 될 수 있습니다. 또한 복잡한 테스트는 형광 현미경으로 검사 할 때 이미지가 희미 해지는 것입니다. 또한 IF 기법은 환자 혈청의 연속 희석을 사용하므로 선형이 아닐 수있는 결과를 제공합니다. 동일한 샘플에 대한 일일 테스트에서는 역가의 2 배 변화가 일반적입니다. 4 배 차이는 “중요”하다고합니다. 대조적으로 고체상 면역 분석은 자동화되고 재현성이 높습니다. 결과는 선형 적이며 기술은 노동 집약적이지 않기 때문에 수행 비용이 저렴합니다.
이러한 고려 사항으로 인해 경제적 인 비용 절감이 필요합니다. ANA를 정량하기 위해 고체상 면역 분석법을 사용합니다. 따라서 고체상 ANA 면역 분석법을 개발하려는 시도에서,보다 구체적인 ANA 면역 분석법에서 일반적으로 분석되는 항원이 무엇이든 여러 그룹이 고체상에 배치했습니다 (예 : DNA, Sm, RNP, Ro / SSA, La / SSB, 핵 단백질, 세포 추출물 등). 발표 된 보고서에서 ANA 역가와 이러한 고체상 분석 간의 상관 계수는 상당히 우수합니다. 따라서 많은 상업 회사에서 ANA를 전환했습니다. 그러나 우려되는 것은 알려진 SLE 및 관련 질환을 가진 환자에서 위음성 결과의 높은 빈도 / 백분율뿐 아니라 “위양성”의 지속적인 높은 빈도입니다 (예 : 누군가의 긍정적 인 ANA 15-21 SLE 및 관련 질환이있는 환자가 이러한 고체상 면역 분석에서 누락되지 않도록하기 위해 민감도와 특히 이러한 고체상 면역 분석의 특이성을 개선하기위한 추가 작업이 필요합니다.
DNA에 대한 항체
DNA에 대한 항체는 주로 단일 가닥 (ss) DNA와 반응하는 것과 dsDNA를 인식하는 것으로 나눌 수 있습니다 .24-26
항체 ssDNA 항체는 SLE, 류마티스 관절염, 약물 관련 루푸스, SLE 환자의 건강한 친척, 드물게는 다른 류마티스 질환에서보고되었습니다. (표 2, p. 17 참조) 따라서 anti-ssDNA는 SLE 또는 기타 류마티스 질환의 진단에 제한적인 유용성을 가지고 있습니다. Anti-ssDNA는 질병 활동과 잘 연관되지 않으므로 질병 관리에 유용하지 않습니다.
dsDNA에 대한 항체는 고체상 면역 분석으로 가장 자주 검출되지만 일부 실험실에서는 crithidia IF 분석 또는 때때로 Farr radioimmunoassay.대부분의 병원 및 상업 실험실에서는 하나만 수행합니다. Farr 분석은 SLE 진단을위한 세 가지 분석 중 가장 높은 특이 도와 가장 낮은 민감도를 갖는 반면, 고체상 분석은 가장 높은 민감도와 가장 낮은 특이도를 가지고 있습니다. crithidia 분석은 그 사이에 있습니다. Farr 분석은 또한 대부분의 실험실에서 피하는 방사성 물질을 사용하는 단점이 있으며 crithidia 테스트는 매우 노동 집약적입니다. 매일 사용하는 경우 ELISA 분석을 선호합니다.
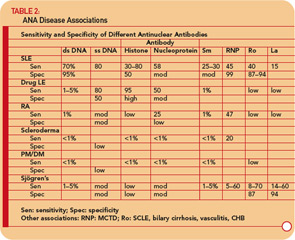
항 dsDNA는 SLE에 대해 민감도가 높지는 않지만 (95 %) 특이적인 (95 %), 양성일 때 진단에 매우 유용합니다 .9 (표 2 참조) , p. 17.) 류마티스 성 관절염, 청소년 관절염, 약물 유발 성 루푸스,자가 면역성 간염, 심지어 정상인과 같은 다른 상태에서도 종종 발견됩니다.
항 -dsDNA 항체의 역가는 종종 변동합니다. 질병 활동, 특히 루푸스 신염 때문에 SLE 과정을 따르는 많은 환자에게 유용합니다. 환자가 역가가 상승하거나 역가가 매우 높지만 임상 적으로 정지 상태 인 경우, 혈청 학적 이상을 치료하지 않지만 환자를 더 면밀히 추적하고 어떤 일이 발생했을 때 치료를 받아야한다는 경고 신호로 간주합니다. 치료의 변화. 그러나 일부 연구자들은 이러한 혈청 학적 이상을 치료했으며 (특히 낮은 보체 수치와 관련된 경우) 개선 된 임상 결과를보고했습니다. 반대로, 나는 치료 중 발적 후 나아지는 사람의 감소 역가를 치료 감소의 지침으로 사용합니다 (예 : 코르티코 스테로이드 및 / 또는 면역 억제제).
항 -dsDNA 항체와 기타 항체 간의 연관성 SLE의 질병 발현은 훨씬 덜 명확합니다. 예를 들어, 항 dsDNA 역가와 신경 정신과 적 SLE의 질병 활동 간에는 관계가 없습니다.
감염성 합병증 또는 약물의 독성 효과와 관련없는 질병으로부터 활성 루푸스 증상을 구별하는 것은 항상 어려운 일입니다. anti-dsDNA 항체의 존재는 일부 환자에서 이러한 구분에 도움이 될 수 있습니다.
Anti-Smith 및 Anti-Ribonucleoprotein Antibodies
Antibodies to Smith (Sm) and anti-ribonucleoprotein (항 -RNP)는 고체상 면역 분석으로 가장 자주 검출됩니다 .24,27
항 Sm 항체는 SLE 환자의 10 ~ 40 %에서만 발견되지만 기타 조건 (즉, 민감하지 않지만 매우 구체적 임). 항 -Sm 역가의 측정은 특히 항 -DNA 항체를 검출 할 수없는 경우 진 단적으로 유용 할 수 있습니다. 그러나 항 Sm의 상대적으로 낮은 민감도를 감안할 때 음의 값은 SLE 진단을 배제하지 않습니다.
항 -RNP 항체는 SLE 환자의 약 40 ~ 60 %에서 발견되지만 MCTD의 정의 기능인 SLE에만 국한되지 않습니다. 이러한 항체는 RA 및 경피증을 포함한 다른 류마티스 질환에서 낮은 역가 및 낮은 빈도로 발생할 수도 있습니다. (표 2, p. 17 참조)
항 -Sm 항체와 항 -RNP 항체의 역가 (수준)는 임상 활동과 관련이 없습니다.
Anti-Ro / SSA 및 Anti-La / SSB 항체
Ro / SSA 및 La / SSB에 대한 항체는 고체상 면역 분석으로 가장 자주 검출됩니다 .28,29 Anti-Ro / SSA 및 anti-La / SSB가 검출되었습니다. Sjögren 증후군 환자와 SLE 환자, 감광성 피부염 환자, 건강한 성인의 0.1 % ~ 0.5 %에서 높은 빈도로 나타납니다.
Anti-Ro / SSA 항체는 약 50 %에서 발견됩니다. SLE 환자의. (표 2, p. 17 참조.) 이들은 광과민성, 아 급성 피부 루푸스, 피부 혈관염 (만지는 자반병), 간질 성 폐 질환, 신생아 루푸스 및 선천성 심장 차단과 관련이 있습니다. Anti-Ro / SSA 항체는 원발성 쇼그렌 증후군 환자의 약 75 %에서 발견되며 (표 2, p. 17 참조) 이러한 항체의 높은 역가는 특히 자반과 혈관염과 같은 추가 선 기능의 발생률과 관련이 있습니다. 대조적으로 Ro / SSA 항체는 류마티스 관절염과 관련된 이차성 쇼그렌 증후군 환자의 10 ~ 15 %에서만 존재합니다. 따라서 원발성 쇼그렌 증후군이 의심되는 환자의 Ro / SSA 또는 anti-La / SSB 항체의 존재는 진단을 강력하게 뒷받침합니다.
항 -Ro 항체를 보유한 SLE 환자의 약 50 %도 항 -La 항체, 밀접하게 관련된 RNA 단백질 항원. 마찬가지로 쇼그렌 증후군 환자 대부분은 항 La (SSB) 항체를 가지고 있습니다. anti-Ro 항체가없는 anti-La 항체를 가진 환자를 찾는 것은 매우 드뭅니다.
제 생각에 anti-Ro / SSA 및 anti-La / SSB 항체 검사를 주문하는 적응증은 다음과 같습니다.
- 임신 중이거나 SLE가있는 여성 미래에 임신 할 수 있습니다.
- 심장 차단 또는 심근염이있는 아이를 낳은 이력이있는 여성
- 설명 할 수없는 광과민성 피부 발진의 병력이있는 환자
- li>
- SLE에 걸렸다 고 강하게 의심되지만 ANA 검사가 음성 인 환자; 또는
- 건조 혈압, 건성 각 결막염 및 / 또는 타액선 및 눈물샘 비대 증상이있는 환자.
항 리보솜 P 단백질 항체
항- 리보 소말 P 단백질 항체는 미국에서 SLE 환자의 10 ~ 20 %, 아시아 인 SLE 환자의 40 ~ 50 %에서 검출되었지만 다른 류마티스 질환에서는 드물게 검출되었습니다 .30 항-리보솜 P 단백질 항체는 매우 높을 수 있습니다. 모든 연구에서이를 확인한 것은 아니지만 루푸스 관련 정신병에 특화되어 있습니다. 루푸스 환자의 우울증과 신장 및 간 관련은 일부 소규모 연구에서 항-리보솜 P 단백질 항체와 관련이 있습니다.
낮은 민감도와 낮은 임상 상관 관계로 인해 저를 포함한 많은 연구자들은 다음을 참조하십시오. 이 검사에서는 임상 적 유용성이 거의 없습니다.
항 중심체 항체
항 중심체 항체 (ACA)는 특히 제한된 피부 전신 경화증 (lcSSc) 환자에게서 거의 독점적으로 발견됩니다. CREST.31 ACA는 CREST 환자의 57 %에서 관찰되었지만 Raynaud 현상 만있는 일부 환자를 포함하여 다른 상태의 환자에서도 관찰되었습니다. ACA는 일반적으로 Hep-2 세포의 특징적인 IF 패턴에 의해 검출됩니다.
항 -Scl-70 (토포 이소 머라 제 -1) 항체
경피증 환자의 약 15 ~ 20 % 70kd 단백질 (토포 이소 머라 제 -1)에 대한 항체가 있으며, 이후에 Scl-70.31로 명명됩니다. 일반적인 검출 방법은 ELISA에 의한 것입니다. 이러한 항체의 존재는 경피증 환자의 폐 섬유증 위험을 증가시키는 것으로 보이며 질병에 매우 특이 적입니다.
요약
이력을 기반으로 SLE를 의심한다면 신체적 검사 및 전체 혈구 수 (예 : 백혈구 감소증, 혈소판 감소증)는 ANA 검사를 요청합니다. 음성이면 환자가 SLE에 걸렸을 가능성이 거의 없으며 환자를 안심시킬 수 있습니다. 역가가 < 1 : 160이면 SLE 가능성이 낮으며 환자는 SLE 가능성이 낮다는 것을 확신 할 수 있지만 환자는 주기적으로 추적해야합니다. 역가가 ≥1 : 160이면 SLE 및 관련 장애의 가능성이 높아집니다. 그러나 ANA 양성 반응을 보인 개인의 85 %가 SLE가 없다는 것을 기억하는 것이 중요합니다. ANA가 양성이면 dsDNA, Sm, RNP, Ro / SSA 및 La / SSB에 대한 항체도 검사해야합니다. 이러한 항체의 존재는 환자가 SLE 및 관련 장애를 가질 가능성을 크게 증가 시키며 (표 2, p. 17 참조) 환자를 더 면밀히 추적해야합니다. anti-centromere 및 anti–Scl-70 항체의 검출은 경피증 진단에 매우 유용합니다. Ro / SSA 및 La / SSB에 대한 항체 검출은 Sjögren 증후군 진단에도 유용합니다.
활동을 모니터링하는 데 유용한 이러한 검사 중 단 하나는 anti-dsDNA입니다.
감사합니다 : 저는 UpToDate in Medicine의 많은 저자들과이 논문의 개발에 유용한 프레임 워크를 제공 한 많은 저자들과 Drs. Robert Shmerling, David Lee, Donald Bloch와 함께이 주제에 대한 논문과 장을 작성했습니다.
Dr. Schur는 하버드 의과 대학의 의학 교수이자 보스턴에있는 Brigham and Women ‘s Hospital의 의학과에서 류머티즘, 면역학, 알레르기 부서를 담당하고 있습니다.
- Reichlin M. 측정 및 임상 적 중요성 항핵 항체. 최신 정보. 2008 년 10 월.
- American College of Rheumatology Ad Hoc 면역 검사 지침 특별위원회. 류마티스 질환의 면역 학적 실험실 검사 지침 : 소개. 류마티스 관절염. 2002; 47 : 429-433.
- Solomon DH, Kavanaugh AJ, Schur PH, et al. 면역 학적 검사 사용에 대한 증거 기반 지침 : 항핵 항체 검사. 류마티스 관절염. 2002; 47 : 434-444.
- Sinclair D, Saas M, Williams D, Hart M, Goswami R. ELISA가 항핵 항체 검출을 위해 면역 형광을 대체 할 수 있습니까? — 항의 일상적인 사용 -핵 항체 스크리닝 ELISA. Clin Lab. 2007; 53 : 183-191.
- Avaniss-Aghajani E, Berzon S, Sarkissian A. 핵 항원에 대한자가 항체 검출을위한 다중 비드 기반 면역 검정의 임상 적 가치. Clin Vaccine Immunol. 2007; 14 : 505-509.
- Copple SS, Martins TB, Masterson C, Joly E, Hill HR. 임상 적으로 정의 된 혈청을 사용하여 추출 가능한 핵 항체에 대한 항체 검출을위한 3 가지 다중 면역 분석법의 비교. Ann N Y Acad Sci.2007; 1109 : 464-472.
- Caramaschi P, Ruzzenente O, Pieropan S, et al. 인플 릭시 맙 치료 후 높은 역가에서 ANA 양성인 환자에서 다중 형광 마이크로 스피어 면역 분석법을 사용한 ANA 특이성 결정 : 예비 결과. Rheumatol Int. 2007; 27 : 649-654.
- Biagini RE, Parks CG, Smith JP, Sammons DL, Robertson SA. 다중 양성 ANA가있는 루푸스 환자의 혈청에서 AtheNA MultiLyte ANA II 분석의 분석 성능. Anal Bioanal Chem. 2007; 388 : 613-618.
- Gonzalez C, Garcia-Berrocal B, Perez M, et al. 임상 적으로 정의 된 환자에서 새로운 자동 ENA 스크리닝 분석 (EliA Symphony)을 통한 결합 조직 질환의 실험실 스크리닝. Clin Chim Acta. 2005; 359 : 109-114.
- Eissfeller P, Sticherling M, Scholz D, et al. 결합 조직 질환에서 동시자가 항체 검출을위한 다양한 테스트 시스템 비교. Ann N Y Acad Sci. 2005; 1050 : 327-339.
- Smith J, Onley D, Garey C, et al. UltraPlex 플랫폼을 사용한 ANA 특이성 결정. Ann N Y Acad Sci. 2005; 1050 : 286-294.
- Martins TB, Burlingame R, von Muhlen CA, et al. 핵 항원에 대한자가 항체 검출을위한 다중 형광 마이크로 스피어 면역 분석의 평가. Clin Diagn Lab Immunol. 2004; 11 : 1054-1059.
- Bernardini S, Infantino M, Bellincampi L, et al. 항핵 항체의 스크리닝 : 핵 균질 물, 정제 또는 재조합 항원 및 면역 형광 분석을 기반으로 한 효소 면역 분석 간의 비교. Clin Chem Lab Med. 2004; 42 : 1155-1160.
- Nossent H, Rekvig OP. 새로운 천년기의 항핵 항체 스크리닝 : 현미경에 안녕하십니까? Scand J Rheumatol. 2001; 30 : 123-126; 토론 127-128.
- Lopez-Hoyos M, Rodriguez-Valverde V, Martinez-Taboada V. 항핵 항체 결합 조직 질환 검사 성능. Ann N Y Acad Sci. 2007; 1109 : 322-329.
- Ghillani P, Rouquette AM, Desgruelles C, et al. 자가 면역 질환에서 항핵 항체 검사를위한 LIAISON ANA 스크린 분석 평가. Ann N Y Acad Sci. 2007; 1109 : 407-413.
- Bonilla E, Francis L, Allam F, et al. 면역 형광 현미경은 전신 홍 반성 루푸스 환자에서 항핵 항체 반응성을 검출하기 위해 형광 구슬보다 우수합니다. Clin Immunol. 2007; 124 : 18-21.
- Nifli AP, Notas G, Mamoulaki M, et al. 인간 혈청에서 ANA 및 ANCA자가 항체 검출을위한 다중, 비드 기반 형광 분석 및 면역 형광 방법의 비교. J Immunol 방법. 2006; 311 : 189-197.
- Shovman O, Gilburd B, Zandman-Goddard G, et al. 자가 면역 질환에서 ANA 스크리닝을위한 Multiplexed AtheNA multi-lyte immunoassay. 자가 면역. 2005; 38 : 105-109.
- Ulvestad E. ANA 검출을위한 하이브리드 ELISA의 성능 특성 및 임상 적 유용성. Apmis. 2001; 109 : 217-222.
- Olaussen E, Rekvig OP. 항핵 항체 (ANA) 스크리닝 테스트 : ELISA에 의한 스크리닝을위한 합리적인 기준으로 중앙 핵 항원의 선택적 사용. J자가 면역. 1999; 13 : 95-102.
- Homburger HA, Cahen YD, Griffiths J, Jacob GL. 항핵 항체 검출 : 효소 면역 분석법과 간접 면역 형광법의 비교 평가. Arch Pathol Lab Med. 1998; 122 : 993-999.
- Gniewek RA, Stites DP, McHugh TM, Hilton JF, Nakagawa M. 항핵 항체 검사 방법 비교 : 면역 형광 분석과 효소 면역 분석. Clin Diagn Lab Immunol. 1997; 4 : 185-188.
- Reichlin M. DNA, SM 및 RNP에 대한 항체. 최신 정보. 2008 년 10 월.
- Hahn BH. DNA에 대한 항체. New Engl J Med. 1998; 338 : 1359.
- Kavanaugh AF, Solomon DH, 면역 검사 지침에 관한 미국 류마티스 대학 특별위원회. 류마티스 질환에 대한 면역 학적 실험실 검사 지침 : 항 DNA 항체 검사. 류마티스 관절염. 2002; 47 : 546-555.
- Benito-Garcia E, Schur PH, Lahita R. 류마티스 질환에 대한 면역학 실험실 검사 지침 : Anti-Sm 및 Anti-RNP 항체 검사. 류마티스 관절염. 2004; 51 : 1030-1044.
- Reichlin M. anti-Ro / SSA 및 anti-La / SSB 항체의 임상 적 중요성. 최신 정보. 2008 년 10 월.
- Reveille JD, Sherrer YRS, Solomon DH, Schur P, Kavanaugh A. 면역 학적 실험실 검사 사용에 대한 근거 기반 지침 : Anti-Ro (SS-A) 및 La (SS- B) : 면역 테스트 지침에 관한 ACR 특별위원회의 보고서. 출판을 위해 제출되었습니다.
- Reichlin M. Antiribosomal P 단백질 항체. 최신 정보. 2008 년 10 월.
- Denton CP. 경피증의 분류. 최신 정보. 2008 년 10 월.