US Pharm. 2013; 38 (11) (Oncology suppl) : 3-6.
ABSTRACT : 빈혈은 암 입원 환자에게 흔한 합병증입니다. 종양 자체 또는 사용 된 화학 요법에 의해 발생할 수 있습니다. 상태의 심각성과 유병률은 여러 요인에 따라 다릅니다. 치료는 혈액의 산소 운반 능력을 높이고 피로를 줄이고 환자의 전반적인 삶의 질을 높이는 데 목적이 있습니다. 적혈구 생성 촉진제, 철분 보충제 및 적혈구 수혈은 모두 다른 환경에서 권장되었습니다. 이러한 방법이 일부 환자에게 유익한 것으로 입증되었지만 최적의 치료 방식은 아직 확립되지 않았습니다.
빈혈은 신체 기능 저하, 예후 및 치료 결과와 관련하여 암 환자의 이환율의 주요 원인입니다 .1 World Health Organization에 따르면 ( WHO), 빈혈은 임신하지 않은 여성에서 < 12g / dL, < 13g / dL의 헤모글로빈 (Hb) 수준으로 정의됩니다. 15 세 이상의 남성에서 .2
역학
빈혈은 암 입원 환자에게 가장 빈번한 증상 중 하나입니다. 실제로 모든 암 환자의 30 ~ 90 %가 빈혈이며, 이는 암의 유형과 사용 된 빈혈의 정의에 따라 달라집니다 .3 빈혈의 발생률과 중증도는 여러 요인에 따라 달라집니다. 표 1.4,5

병인 h2에 나열되어 있습니다. >
암 환자의 빈혈의 주요 원인은 암 자체와 암 관리에 사용되는 치료법, 골수에 침투하는 암세포가 직접 조혈을 억제하여 빈혈을 유발할 수 있다는 것입니다. 또한 암세포는 철분 격리로 이어질 수있는 사이토 카인을 방출하여 적혈구 (RBC) 생산을 감소시킵니다. 종양은 종양 부위에서 만성 혈액 손실을 초래하여 암과 장기 손상으로 인한 진행성 빈혈로 이어질 수 있습니다 .6
이 문제는 혈액 손실, 영양 결핍, 용혈, 내분비 장애, 유전성 질환, 레 날린 부족 또는 암 및 만성 질환과 관련된 염증성 사이토 카인의 존재 .4,6 암 환자는 식욕을 잃고 영양 결핍으로 이어지는 경향이 있습니다. 위장 (GI) 종양이있는 환자의 경우 영양소 흡수 장애는 또한 결핍으로 이어집니다. 용혈은 면역 매개 항체 또는 응고 능력의 변화로 인해 발생합니다. 결과적으로 빈혈은 최근 암 진단을받은 환자들에게 흔한 동반 질환입니다. 부인 암 진단을받은 환자의 거의 절반과 비호 지킨 림프종 진단을받은 환자의 1/3이 진단시 빈혈을 앓고 있습니다.
또한 골수 억제는 화학 요법의 부작용 중 하나이며 빈혈에 중요한 기여 요인입니다. . 특히 골격에 대한 방사선 요법은 혈액 독성을 유발하여 빈혈을 유발합니다 .6
증상
빈혈의 가장 흔한 증상은 피로, 정신 이상, 두근 거림, 우울증, 심부전,인지 장애입니다. 기능, 현기증 및 심부전 .7,8
진단
암 환자의 빈혈 문제의 정도는 차선의 진단 조치, 표준 정의의 부족 및 원인은 종종 다 인성이라는 사실 .6,9 증상의 발병 기간과 시간, 동반 질환의 존재, 가족력, 항 종양 약물 및 방사선 노출 이력을 기록한 상세한 이력을 기록해야합니다. 실신, 운동 호흡 곤란, 두통, 현기증, 흉통, 피로, 여성의 비정상적인 월경, 창백 등을 확인하기위한 신체 검사를 실시해야합니다 .6
국립 암 종합 네트워크 (National Cancer Comprehensive Network)는 다음과 같은 환자에게 aCBC를 시행 할 것을 권장합니다. Hb < 11g / dL 또는 2g / dL의 Hb 수 감소. 이것은 세포 감소증이 있는지 여부를 결정하는 데 유용합니다. 적혈구의 크기, 모양 및 색을 확인하기 위해 말초 혈액 도말을 육안으로 검토하는 것도 권장됩니다 .6
병태 생리학
빈혈은 순환 적혈구 감소의 결과입니다. 과잉 혈액 손실, 적혈구 파괴 증가, 적혈구 생성 감소 등 다양한 병리 생리 학적 메커니즘을 통해 발생할 수 있습니다.
에리스로포이에틴 (EPO), 비타민 B12, 엽산 및 철분은 적혈구 생성에 필수적입니다. Erythropoietin은이 과정에서 적혈구 생성, 분화 및 적혈구 세포의 생존을 조절합니다 .10 EPO는 주로 신장에서 생성되어 골수로 이동합니다 .11
비정상적인 철 대사 또는 대 식세포에서 철의 유지는 forerythropoiesis에서 사용할 수있는 철.철의 신진 대사 변화는 주로 대 식세포에 의한 철분 방출뿐만 아니라 장에서 철의 흡수를 감소시키는 단백질 인 헵시 딘에 의해 발생합니다. 헵시 딘의 생성은 종양에서 방출되는 사이토 카인에 의해 증가하여 순환하는 철의 양을 감소시킵니다. 또한 인터루킨 (IL) -6과 같은 사이토 카인의 생성이 특정 화학 요법에 의해 증가하는 것으로 나타났습니다 .5 화학 요법을 반복하면 누적 적혈구 생성 감소가 악화 될 수 있습니다 .7
산소 전달이 감소함에 따라, 신체의 조직 세포가 저산소 상태가되어 신체가 조직 산소화를 얻거나 유지하려고 시도 할 때 일련의 생리적 반응을 일으 킵니다.
철암 환자의 정상적인 사용은 종양 세포 간의 상호 작용에 의해 방해를받을 수 있습니다. 그리고 숙주의 면역 체계. 이러한 상호 작용은 IL-1, 감마 인터페론, 종양 괴사 인자 알파 (TNF-α)와 같은 특정 염증성 사이토 카인의 상향 조절을 유도하여 골수에서 적혈구 계 전구체의 분화를 감소시키고 정상적인 철 이용을 방해하며 정상적인 저산소증을 억제합니다. 구동 에리트로 포이 에틴 생산. 신 독성 화학 요법 제는 신장 장애를 유발하여 문제를 악화시킬 수 있습니다.
만성 빈혈에서 종양은 적혈구의 수명을 줄이는 분자 인 빈혈 유발 인자를 방출하는 것으로 나타났습니다. 이는 적혈구 생성이 적혈구의 열등한 생존을 보상 할 수 없을 정도로 빈혈을 악화시킵니다 .12
암의 빈혈에 대한 위험 요인
암의 빈혈에 대해 다음과 같은 위험 요인이 확인되었습니다 9 :
- 골수 억제 화학 요법 또는 방사선 요법
- 세포 독성 화학 요법 시작시 낮은 Hb 수준 (10-12g / dL)
- 백금 투여- 수혈 지원의 필요성을 증가시키는 요법이 포함되어 있습니다.
치료
환자의 삶의 질이 전반적으로 개선되는 것 외에도 빈혈 치료는 여러 사람에게 필수적입니다. 빈혈은 종양 세포를 포함한 모든 세포에 충분한 양의 산소를 전달하는 것을 손상시킵니다 .7 낮은 조직 산소화는 방사선 및 다른 형태의 화학 요법에 대한 종양의 민감도 감소와 관련이 있기 때문에 이러한 치료의 효과는 빈혈에서 감소합니다 .13,14
치료의 목표는 산소 운반체를 증가시키는 것이어야합니다. 영양 결핍과 같은 기저 질환은 잠혈 손실과 같은 다른 질환보다 치료가 더 쉽습니다. 빈혈이있는 암 환자의 관리를 위해 다양한 옵션을 사용할 수 있습니다. 15 :
- 영양 결핍을 교정하기위한 엽산 및 / 또는 비타민 B12를 사용한 적절한 보충 요법
- 적혈구 생성 자극제 (ESA)
- 철 보충
- 급성 중증 출혈이있는 환자에게 표시되는 수혈. 빈혈이 만성 인 환자의 경우 적혈구 생성 작용 제가 선호됩니다.
적혈구 생성 자극제 : 재조합 인간 적혈구 생성 인자 알파 (rHuEPO; Procrit, Epogen) 및 darbepoetin 알파 (Aranesp)를 포함한 ESA는 다음과 같습니다. 전통적으로 만성 신부전 환자의 빈혈 관리를 위해 개발되었습니다. 그들은 빈혈이있는 암 환자에서 비교할 수없는 용량을 사용했을 때 유사한 효능과 한계를 보여주었습니다 .5 ESA는 ESA 작용 방식과 면역 학적 및 혈액 학적 효과가 내인성 EPO의 것과 유사하기 때문에 내인성 EPO 수준이 비정상적으로 낮은 환자의 관리를위한 것입니다 .9 rHuEPO에서 수행 한 결과 환자의 Hb 수준과 삶의 질이 향상되고 수혈 요구 사항이 감소하는 것으로 나타났습니다 .15,16 ESA가 화학 요법을받는 환자의인지 기능도 향상 시킨다는 제안이있었습니다 .17
A 전신 검토 American Cancer Society에서 실시한 결과, 화학 요법으로 유발 된 빈혈의 적혈구 생성 치료가 조기 개입을 통해 최적의 임상 적 이점을 얻을 수 있음을 보여주었습니다 .18 ESA 사용의 이점이 분명합니다. 그러나 빈혈의 다른 모든 원인은 ESA 요법을 사용하기 전에 조사하고 수정해야합니다.
Darbepoetin과 rHuEPO는 모두 whomanemia가 화학 요법과 관련된 비 골수성 악성 종양 환자의 빈혈 치료에 사용됩니다 .5 미국 혈액 학회 (ASH)와 미국 임상 종양 학회 (ASCO)는 Hb 수준이 10g / dL 미만으로 떨어지면 치료를 시작하고 Hb 수준에서 최소 1g / dL이 2만큼 증가하면 복용량을 줄일 것을 권장합니다. 주 .19 치료의 목적은 수혈을 피하기 위해 Hb를 최저 농도로 높이는 것입니다. 치료 6 ~ 8 주 후에도 최소 1 ~ 2g / dL의 Hb 증가가 이루어지지 않으면 ESA 요법을 중단해야합니다.18 현재 데이터로는 이러한 요법에 대한 환자의 반응을 예측하기 어렵지만 약 50 % ~ 60 %의 환자가 rHuEPO로 치료할 때 Hb가 2g / dL 증가하는 것으로 나타났습니다 .9 ESA 요법은 완료시 중단되어야합니다. 화학 요법 과정 .20,21
darbepoetin alfa의 권장 복용량은 매주 피하 (SC) 주사로 2.25mcg / kgas입니다. Hb 수치가 6 주 후에도 1g / dL 이상 상승하지 않으면 복용량을 4.5mcg / kg으로 늘려야합니다. Hb 수치가 2 주 동안 1g / dL 이상 증가하거나 Hb가 12g / dL를 초과하면 다 베포 에틴 용량을 40 % 줄여야합니다 .20 Hb 수치가 13g / dL 이상으로 상승하면 다 베포 에틴을 중단해야합니다. 9
rHuEPO의 권장 복용량은 Hb 수준이 10g / dL 미만인 입원 환자에게 주 1 회 SC를 투여하는 40,000 U 또는 주 3 회 SC를 투여하는 150 U / kg입니다. Hb 수치가 2 주 동안 > 1g / dL 증가하거나 적혈구 수혈을 피하는 데 필요한 수치에 도달하면 rHuEPO의 용량을 25 % 줄여야합니다 .21
ESA는 변성되기 때문에 흔들어서는 안되는 바이알에 포장되어 있습니다 .20,21 바이알의 내용물을 희석하거나 모아서는 안됩니다.
ESA 요법의 위험도 다음과 같아야합니다. 고려했습니다. ESA는 심혈관 부작용을 증가시키고, 정맥 혈전 색전증의 위험을 높이고, 종양 진행까지의 시간을 단축하고, 다양한 기전을 통해 빈혈 암 환자의 생존을 감소시키는 것으로 생각됩니다 .22,23 이러한 이유로 ESAsis의 사용은 치료를받지 않은 암 환자에서 권장되지 않습니다. 모든 ESA에는 사망, 심근 경색, 뇌졸중, 정맥 혈전 색전증, 혈관 접근 혈전증, 종양 진행 및 재발 위험 증가에 대한 블랙 박스 경고가 함께 제공됩니다 .20,21 ESA APPRISE Oncology 프로그램은 FDA는 ESA의 안전한 사용에 대해 환자, 간병인 및 의료 전문가에게 조언합니다 .25
철 보충 : 비경 구적으로 철 보충제가 낮은 수준의 오퍼 리틴 환자에게 표시됩니다 (< 30ng / mL), 트랜스페린 포화도 (TSAT < 15 %) 및 낮음 (< 26pg / 셀 ) 망상 적혈구 Hb conten t (CHr). 빈혈 암 환자에서 두 가지 유형의 철분 결핍이 확인되었습니다.
- 예를 들어 GI 또는 부인과 병변, 수술로 인한 출혈, 영양 학적으로 인한 만성 출혈과 함께 발생하는 절대 철분 결핍 (AID) 만성 질환의 결핍 및 빈혈 (ACD). 혈청 페리틴 수치 < 30 mcg / L 및 감소 된 TSAT < 15 % .1
- 지속적인 에리스로포이에틴 사용 후 발생하는 기능성 철분 결핍 (FID). 특히 신부전 환자에서 ESA 요법에 대한 부적절한 반응의 가장 흔한 원인입니다. 따라서 ESA 요법을받는 대부분의 환자는 결국 철 보충제가 필요합니다 .6
ESA 요법만으로 화학 요법을받은 환자에서 낮은 반응률을 보였을 때 철 보충제가 도입되었습니다 .1 IV 병용의 효능 철분 및 ESA 요법을 테스트하고 철의 기능성 결핍에서 철의 역할이 확립되었습니다 .1 현재 증거가 IV 철 보충제의 사용을 뒷받침하는 암 빈혈 환자의 헤모글로빈 반응을 뒷받침하지만 IV 철의 장기적인 효능과 안전성에 대한 전향 적 연구가 필요합니다 . 게다가, 최적의 투여 요법을 확립해야합니다 .5
철은 경구로 또는 저 분자량 (LMW) 철 덱스 트란, 글루 콘 산철 및 자당 철의 비경 구 제형으로 투여 할 수 있습니다. 비경 구적으로 투여 된 철분은 경구 철분과 비교할 때 우수한 반응을 보입니다 .6 후자는 따라서 빈혈이있는 암 환자에게 거의 사용되지 않으며이 기사에서는 논의되지 않습니다. 철 덱스 트란의 경우 시험 용량을 권장하며, 철 덱스 트란 또는 기타 IV 철 제제에 이전에 민감성을 보인 환자 또는 여러 약물 알레르기가있는 환자는 시험 용량을 투여해야합니다. 표 2는 IV 철 보충제를위한 투약 요법을 보여줍니다 .6
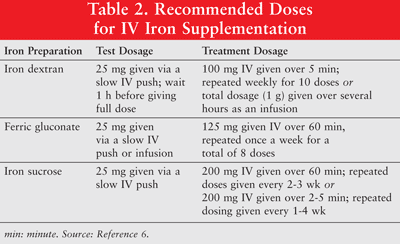
비경 구 철분은 저혈압, 메스꺼움, 구토 및 / 또는 설사, 통증, 고혈압, 호흡 곤란, 가려움증, 두통 및 현기증과 관련이 있습니다. 또한, 투여가 불편하고 비용이 많이들 수 있습니다 .9 고 분자량 (HMW) 철 덱스 트란은 LMW 철 덱스 트란보다 부작용 발생률이 높기 때문에 후자가 전반적으로 선호됩니다 .6
빨간색 혈액 세포 수혈 : 적혈구는 출혈 후 급성 빈혈의 경우 빈혈을 교정하기 위해 수혈에 선호되는 혈액 제품입니다. 특정 환자는 거대 세포 바이러스 음성 인 주입이 필요할 수 있습니다.적혈구 수혈 사용의 목적은 혈액의 산소 운반 능력 결핍을 치료하거나 예방하는 것이며, 환자의 Hb 수준이 ≥10g / dL 인 경우 일반적으로 수혈을 지시하지 않습니다 .6
RBC 수혈이 제공하는 주입 즉시 Hb 및 헤마토크리트 수치가 급격히 증가하는 이점. 순 적혈구 300mL (1 단위) 수혈은 동시 출혈을 경험하지 않는 정상인 성인에서 평균 1g / dL의 Hb 또는 3 %의 헤마토크리트 증가를 초래할 것으로 추정됩니다. 이로 인해 피로가 전반적으로 빠르게 개선됩니다 .6
적혈구를 수혈하기 전에 환자의 혈액이 ABO 호환성을 위해 교차 매칭되어야합니다. 환자에게 반복 주입이 필요한 경우 백혈구 감소 혈액을 사용하고 anantihistamine 또는 acetaminophen과 함께 사전 약물을 사용하여 부작용의 위험을 최소화 할 수 있습니다 .6
RBC 수혈은 수혈로 전달되는 감염 가능성을 포함하여 위험이 없습니다. 약물, 수혈 반응, 동종 면역화 및 면역 억제 .9 수혈의 다른 위험에는 울혈 성 심부전, 혈전증 발생 및 철분 과부하가 포함됩니다 .6 그러나 화학 요법 치료에만 해당하는 기간 동안 적혈구 주입이 필요한 환자는 그럴 가능성이 매우 낮습니다. 철분 과부하를 경험하십시오 .6
미래 전망
암 환자의 빈혈 관리를위한 새로운 전략이 현재 추구되고 있습니다. 인간의 혈액을 대체 할 수있는 것은 없지만 연구자들은 적혈구의 산소 운반 능력을 가진 제품을 개발하고 있습니다. 파이프 라인에는 Hb 기반 산소 운반체와 과불 화탄소가 있습니다 .5
결론
전체적으로 종양학에서 중요한 문제인 빈혈에 대한 최적의 접근 방식은 아직 확립되지 않았습니다. 의료 제공자 간의 일관성 부족, 암의 빈혈에 대한 명확한 정의 및 진단 기준이 모두이 문제에 기여합니다.
1. Steinmetz HT. 암 환자의 빈혈 치료에서 정맥 내 철의 역할. Ther Adv Hematol. 2012; 3 : 177-191.
2. deBenoist B, McLean E, Egli I, et al. 빈혈의 전세계 유병률 1993–2005 : WHO 빈혈에 관한 글로벌 데이터베이스. 스위스 제네바 : 세계 보건기구; 2008.
3. Knight K, Wade S, Balducci L. 암에서 빈혈의 유병률 및 결과 : 문헌에 대한 체계적인 검토. J Med입니다. 2004; 116 (suppl 7A) : 11S-26S.
4. Schwartz RN. 암 환자의 빈혈 : 발생률, 원인, 영향, 관리 및 치료 지침 및 프로토콜의 사용. J Health Syst Pharm입니다. 2007; 64 (3 suppl 2) : S5-S13; 퀴즈 S28-S30.
5. Calabrich A, Katz A. 암 환자의 빈혈 관리. 미래 Oncol. 2011; 7 : 507-517.
6. Rodgers GM, Becker P, Blinder M, 외. 암 및 화학 요법으로 인한 빈혈. J Natl Compr Canc Netw. 2012; 10 : 628-653.
7. Groopman JE, Itri LM. 성인의 화학 요법 유발 빈혈 : 발생률 및 치료. J Natl Cancer Inst. 1999; 91 : 1616-1634.
8. Ludwig H, Strasser K. 빈혈의 Symptomatology. Semin Oncol. 2001; 28 : 7-14.
9. Gillespie TW. 암의 빈혈. 암 간호. 2003; 26 : 119-128.
10. Koeller JM. 암 관련 빈혈 치료를위한 임상 지침. 약물 요법. 1998; 18 : 156-169.
11. Cazzola M, Mercuriali F, Brugnara C. 요 혈증 이외의 재조합 인간 에리스로포이에틴 사용. 피의. 1997; 89 : 424-867.
12. Nowrousian MR, Kasper C, Oberhoff C, 외. 암 관련 빈혈의 병태 생리학. 에서 : Smith JF, Boogaerts MA, Ehmer B, eds. 암 지원 치료에서의 에리트로 포이 에틴. 뉴욕, NY : Marcel Dekker; 1997 : 13-34.
13. Vaupel P, Dunst J, Engert A, et al. 암 유발 빈혈 환자의 종양 조절에 대한 재조합 인간 에리스로포이에틴 (rHuEPO)의 효과. Onkologie. 2005; 28 : 216-221.
14. Zhao KL, Liu G, Jiang GL, et al. 헤모글로빈 수치와 방사선 치료를받는 국소 진행성 식도 암종 환자의 이환율 및 사망률과의 연관성-3 회 연속 임상 3 상 시험에 대한 2 차 분석. Clin Oncol (R Coll Radiol). 2006; 18 : 621-627.
15. Glaspy JA. 종양학에서 적혈구 생성 인자의 개발. Expert Opin Emerg Drugs. 2005; 10 : 553-567.
16. Adamson JW, Spivak JL. 수술 및 암 치료에서 재조합 인간 에리트로 포이 에틴의 약리학 적 사용을위한 생리 학적 근거. 수술. 1994; 115 : 7-15.
17. Ferrario E, Ferrari L, Bidoli P, 외. 에포 에틴 알파를 이용한 암 관련 빈혈 치료 : 리뷰. Cancer Treat Rev. 2004; 30 : 563-575.
18. Lyman GH, Glaspy J. 화학 요법으로 유발 된 빈혈에 대한 조기 적혈구 생성에 대한 임상 적 이점이 있습니까? 비 체계적인 검토. 암. 2006; 106 : 223-233.
19. Rizzo JD, Brouwers M, Hurley P, 외. AmericanSociety of Clinical Oncology / American Society of Hematology 임상 실습 지침 업데이트는 암이있는 성인 환자의 에포 에틴 및 다 베포 에틴 사용에 대한 업데이트입니다. J Clin Oncol. 2010; 28 : 4996-5010.
20. Aranesp (darbepoetin alfa) 처방 정보.캘리포니아 주 사우 전드 옥스 : Amgen Inc; 2012 년 5 월.
21. Procrit (epoetin alfa) 처방 정보. Horsham, PA : Janssen Products, LP; 2012 년 7 월.
22. Beutel G, Ganser A. 암 관리에서 적혈구 생성 자극제의 위험 및 이점. Semin Hematol. 2007; 44 : 157-165.
23. Fenner MH, Ganser A. 암 관련 빈혈에서 Erythropoietin. Curr Opin Oncol. 2008; 20 : 685-689.
24. Smith RE Jr, Aapro MS, Ludwig H, et al. 화학 요법 또는 방사선 요법을받지 않은 활성 암 환자의 빈혈 치료를위한 Darbepoetinalfa : 3 상, 다기관, 무작위 배정, 이중 맹검, 위약 대조 연구 결과. J Clin Oncol. 2008; 26 : 1040-1050.
25. ESA APPRISE 종양학 프로그램. Amgen 및 Janssen Products, LP. www.esa-apprise.com. 2013 년 10 월 13 일에 액세스했습니다.