US Pharm. 2013; 38 (11) (Oncology suppl): 3-6.
SAMMENDRAG: Anemi er en vanlig komplikasjon hos kreftpasienter. Det kan være forårsaket av selve svulsten eller det behandlingsregimet som brukes. Alvorlighetsgraden og utbredelsen av tilstanden varierer basert på en rekke faktorer. Behandlingen tar sikte på å øke blodets oksygenbærende kapasitet, redusere tretthet og forbedre pasientens generelle livskvalitet. Erytropoiesestimulerende midler, jerntilskudd og røde blodcelletransfusjoner har blitt anbefalt i forskjellige omgivelser. Mens disse har vist seg gunstige hos noen pasienter, er den optimale terapeutiske modeniteten ennå ikke klarlagt.
Anemi er en viktig årsak til sykelighet hos pasienter med kreft, knyttet til dårlig fysisk ytelse, prognose og terapeutisk utfall.1 Ifølge World HealthOrganization ( WHO), er anemi definert som et hemoglobin (Hb) nivå på < 12 g / dL hos ikke-gravide og < 13 g / dL hos menn ≥15 år.2
Epidemiologi
Anemi er en av de hyppigste manifestasjonene hos kreftpasienter. Det er faktisk vist at 30% til 90% av kreftpasienter er anemiske, en figur som er avhengig av kreftformen og definisjonen av anemi som brukes.3 Forekomsten og alvorlighetsgraden av anemi avhenger av en rekke faktorer, som er oppført i TABELL 1.4,5

Etiologi
Hovedårsaken til anemi hos kreftpasienter er todelt: selve kreften og behandlingen som brukes til behandling av kreft. Kreftceller som infiltrerer benmargen kan direkte undertrykke hemopoies og forårsake anemi. Videre frigjør kreftcellene cytokiner som kan føre til jernbinding, og reduserer produksjonen av røde blodlegemer (RBC). Svulster kan føre til kronisk blodtap fra svulststedet, noe som fører til progressiv anemi fra kreft og organskader.6
Dette problemet forsterkes av blodtap, ernæringsmangel, hemolyse, endokrine lidelser, arvelig sykdom, nyreinsuffisiens, eller tilstedeværelsen av inflammatoriske cytokiner assosiert med kreft og kronisk sykdom.4,6 Kreftpasienter har en tendens til å miste appetitten, noe som fører til ernæringsmessige mangler. Hos pasienter med gastrointestinale (GI) svulster fører malabsorpsjon av næringsstoffer også til mangler. Hemolyse skyldes immunmedierte antistoffer eller endringer i koagulasjonsevne. Som et resultat er anemi en vanlig komorbiditet hos pasienter som nylig er diagnostisert med kreft. Nesten halvparten av pasientene diagnostisert med gynekologisk kreft, og en tredjedel av pasientene diagnostisert med ikke-Hodgkin-lymfom, har anemi ved diagnosen.
Videre er myelosuppresjon en av bivirkningene av cellegift og en signifikant medvirkende faktor til anemi. . Spesielt strålebehandling til skjelettet forårsaker også hematologisk toksisitet og derav anemi.6
Symptomer
De vanligste symptomene på anemi er tretthet, anstrengelse av dyspneaupon, hjertebank, depresjon, hjertesvikt, svekkelse av kognitiv funksjon, svimmelhet og hjertesvikt.7,8
Diagnose
Omfanget av problemet med anemi hos kreftpasienter forsterkes av suboptimale diagnostiske tiltak, mangel på standarddefinisjon og faktum at årsaken ofte er multifaktoriell. 6,9A detaljert historie som registrerer varigheten og tiden til symptomene, tilstedeværelsen av comorbide forhold, familiehistorie og historien om eksponering for antineoplastiske legemidler og stråling, bør tas. Afysisk undersøkelse for å sjekke om det er synkope, trening i dyspné, hodepine, svimmelhet, brystsmerter, tretthet, unormal menstruasjon hos kvinner og blekhet bør utføres.6
National Cancer Comprehensive Network anbefaler at det utføres aCBC for pasienter med en Hb < 11 g / dL eller en reduksjon i Hb-antall på 2 g / dL. Dette er nyttig for å bestemme om cytopenier er til stede. En visuell gjennomgang av perifert blodutstryk for å bekrefte størrelse, form og farge på RBC anbefales også.6
Patofysiologi
Anemi er resultatet av en kombinasjon av redusert sirkulerende erytrocytter , redusert pakket cellevolum og reduserte Hb-nivåer.6 Dette kan skje gjennom forskjellige patofysiologiske mekanismer, inkludert overdreven tap av blod, økt ødeleggelse av RBC og redusert røde blodlegemer.
Erytropoietin (EPO), vitamin B12, folsyre og jern er avgjørende for erytropoes. Erytropoietin kontrollerer tematurering, differensiering og overlevelse av erytroide celler under denne prosessen.10 EPO produseres primært av nyrene og transporteres til beinmargen.11
Unormal jernmetabolisme eller retensjon av jern i makrofager reduserer mengden av jern som er tilgjengelig forerythropoiesis.Den endrede metabolismen av jern er hovedsakelig forårsaket av hepcidin, et protein som reduserer absorpsjonen av jern i tarmene, samt frigjøring av jern fra makrofager. Produksjonen av hepcidin økes av cytokiner frigjort fra svulster, og reduserer dermed mengden av sirkulerende jern. Det har også blitt vist at produksjonen av cytokiner som interleukin (IL) -6 økes av visse kjemoterapeutiske regimer.5 Gjentatte sykluser av cellegift kan forverre reduksjonen av erytropoies kumulativt.7
Ettersom oksygentilførselen er redusert, kroppens vevsceller blir hypoksiske, noe som resulterer i en rekke fysiologiske responser når kroppen prøver å oppnå eller opprettholde oksygenering av vev.
Det antas at den normale bruken av jernkreftpasienter kan bli avbrutt av en interaksjon mellom tumorcellene og vertsens eget immunsystem. Denne interaksjonen fører til oppregulering av spesifikke inflammatoriske cytokiner som IL-1, gammainterferon og tumornekrosefaktor alfa (TNF-α), som reduserte differensiering av erytroide forløpere i benmargen, forstyrrer normal jernutnyttelse og hemmer normal hypoksi. drivenerythropoietin produksjon. Nefrotoksiske kjemoterapeutiske midler kan forverre problemet ved å forårsake nedsatt nyrefunksjon.
Ved kronisk anemi har svulster vist seg å frigjøre ananemia-inducing factor, et molekyl som reduserer levetiden til eryrocytter. Dette forverrer anemi til et punkt der erytropoies ikke kan kompensere for RBCs dårligere overlevelse. 12
Risikofaktorer for anemi i kreft
Følgende risikofaktorer er identifisert for anemi i kreft9:
- Myelosuppressiv cellegift eller strålebehandling
- Lavt Hb-nivå (10-12 g / dL) ved initiering av cytotoksisk cellegift
- Administrering av platina- inneholder regimer, noe som også øker behovet for transfusjonsstøtte.
Behandling
Bortsett fra en total forbedring i pasientens livskvalitet, er behandling av anemi viktig for et antall av årsaker.Anemi kompromitterer tilførsel av tilstrekkelige mengder oksygen til allceller, inkludert tumorceller.7 Siden lav vevsoksygenering er assosiert med en redusert følsomhet av svulster for stråling og andre former for cellegift, er effekten av disse behandlingene redusert i anemi.13,14
Målet med terapi bør være å øke oksygen-bæringen blodets kapasitet og behandle den underliggende årsaken. Underliggende forhold som ernæringsmessige mangler er lettere å behandle enn andre, for eksempel okkult blodtap. Ulike alternativer er tilgjengelige for behandling av kreftpasienter med anemi. Disse inkluderer15:
- Passende supplerende behandling med folsyre og / eller vitamin B12 for å korrigere ernæringsmangler
- Erytropoiesis-stimulating agents (ESAs)
- Jerntilskudd
- Blodtransfusjoner, som er indikert for pasienter med akutt alvorlig blodtap. For pasienter med kronisk anemi foretrekkes erytropoietiske midler.
Erytropoiesis-Stimulerende midler: ESA, inkludert rekombinant human erytropoietin alfa (rHuEPO; Procrit, Epogen) og darbepoetin alfa (Aranesp), var tradisjonelt utviklet for behandling av anemi hos pasienter med kronisk nyresvikt. De har vist lignende effekt og begrensninger når de ble brukt uforlignelige doser hos kreftpasienter med anemi. 5 ESA er indikert for behandling av pasienter hvis endogene EPO-nivåer er normalt lave, ettersom ESA-virkemåten og immunologiske og hematologiske effekter er lik de endogene EPO. 9 Studier utført på rHuEPO har vist at det forbedrer pasientenes Hblevels og livskvalitet og reduserer transfusjonskravene.15,16 Det er blitt foreslått at ESA også forbedrer den kognitive funksjonen til pasienter som får cellegift.17
En systemisk gjennomgang utført av American Cancer Societyshysed at optimal klinisk nytte av erytropoietisk behandling av cellegiftindusert anemi kan oppnås gjennom tidlig intervensjon.18Det er helt klart en fordel med å bruke ESA; Imidlertid bør alle andre årsaker til anemi undersøkes og korrigeres før bruk av ESAtherapy.
Darbepoetin og rHuEPO er begge indisert for behandling av anemi hos pasienter med ikke-myoide maligniteter i whomanemia er relatert til cellegift. American Society ofHematology (ASH) og American Society of Clinical Oncology (ASCO) anbefaler at behandling startes når Hb-nivåer synker under 10 g / dL og dosen reduseres hvis det er en minimumsøkning på 1 g / dL i Hblevels med 2 uker.19 Målet med behandlingen bør være å styrke Hb til den laveste konsentrasjonen for å unngå transfusjon. Hvis den minimale økningen på 1 til 2 g / dL Hb ikke oppnås etter 6 til 8 ukers behandling, bør ESA-behandlingen stoppes.18 Selv om det er vanskelig å forutsi pasientrespons på disse terapiene med gjeldende data, har det vist seg at omtrent 50% til 60% av pasientene viser en 2 g / dL økning i Hb når de behandles med rHuEPO.9 ESA-behandling bør avbrytes etter fullføring av cellegiftkursen 20,21
Den anbefalte dosen for darbepoetin alfa er 2,25 mcg / kg som en ukentlig subkutan (SC) injeksjon. Hvis Hb-nivåene ikke stiger minst 1 g / dL etter 6 uker, bør dosen økes til 4,5 mcg / kg. Hvis Hb-nivåene øker mer enn 1 g / dL i en 2-ukers periode, overstiger Hb 12 g / dL, bør dosen av darbepoetin reduseres med 40%. 20 Darbepoetin bør stoppes hvis Hb-nivåene stiger over 13 g / dL. 9
Den anbefalte dosen av rHuEPO er 40 000 U administrert SC en gang i uken eller 150 U / kg administrert SC tre ganger i uken inneliggende pasienter med Hb-nivå under 10 g / dL. Dosen av rHuEPO bør reduseres med 25% hvis Hb-nivået øker > 1 g / dL i en hvilken som helst 2-ukers periode eller når et nivå som er nødvendig for å unngå RBC-transfusjon.21
ESA-er er pakket i et hetteglass som ikke skal ristes, da de vil denaturere. 20,21 Innholdet i hetteglasset skal ikke fortynnes eller samles.
Risikoen ved ESA-behandling bør også være tatt intoconsideration. ESA antas å øke ugunstige kardiovaskulære hendelser, øke risikoen for venøs tromboembolisme, forkorte tiden til svulstprogresjon, og redusere overlevelse hos anemiske kreftpasienter gjennom forskjellige mekanismer. 22,23 Av denne grunn motvirkes bruken av ESAs hos kreftpasienter som ikke gjennomgår behandling med cellegift eller strålebehandling.24 Alle ESA-er kommer med en blackbox-advarsel om å øke risikoen for død, hjerteinfarkt, hjerneslag, venøs tromboembolisme, trombose av vaskulær tilgang, og tumorprogresjon og gjentakelse.20,21 ESA APPRISE OncologyProgram er satt opp av FDA å gi pasienter, omsorgspersoner og helsepersonell råd om sikker bruk av ESAs.25
Jerntilskudd: Jerntilskudd, helst parenteralt, er indisert hos pasienter med lave nivåer av offerritin (< 30 ng / ml), transferrinmetning (TSAT < 15%) og lav (< 26 pg / celle ) retikulocytt Hb conten t (CHr). To typer irondeficiency er blitt anerkjent hos anemiske kreftpasienter:
- Absolutt jernmangel (AID) som oppstår ved kronisk blødning på grunn av for eksempel GI eller gynekologiske lesjoner, blodtap fra kirurgi, ernæring mangler og anemi av kronisk sykdom (ACD). Det er definert som et serumferritinnivå på < 30 mcg / L og redusert TSAT på < 15% .1
- Funksjonell jernmangel (FID) som oppstår etter fortsatt erytropoietinbruk. Det er den vanligste årsaken til mangelfull respons på ESA-behandling, spesielt hos pasienter med nyresvikt. Derfor vil de fleste pasienter på ESA-terapi etter hvert kreve jerntilskudd.6
Jerntilskudd ble introdusert da ESA-behandling alene viste dårlige responsrater hos cellegiftbehandlede pasienter.1 Effekten av en kombinasjon av IV jern- og ESA-terapi ble testet og jernens rolle i funksjonell jernmangel ble etablert.1 Mens gjeldende bevis støtter bruken av IV-jerntilskudd for å forbedre hemoglobinresponser hos anemiske pasienter med kreft, er det nødvendig med prospektive undersøkelser av den langsiktige effekten og sikkerheten til IV-jern. Videre må det opprettes optimale doseringsregimer.5 Jern kan administreres oralt eller som parenteralformuleringer av jern-dextran med lavmolekylær vekt (LMW), jernglukonat og jern-sukrose. Parenteralt administrert jern har bedre respons sammenlignet med oralt jern.6 Det siste brukes derfor sjelden til kreftpasienter med anemi og er ikke diskutert i denne artikkelen. Testdoser anbefales for jerndekstran. Pasienter som har hatt tidligere følsomhet overfor jerndekstran eller andre IV-jernpreparater, eller de som har flere legemiddelallergier, bør også få en testdose. TABELL 2 viser doseringsregimet for IV-jerntilskudd.6
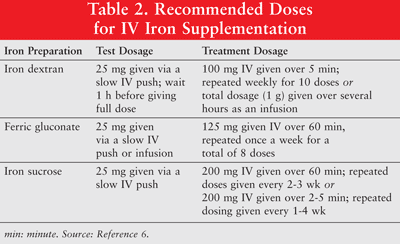
Parenteralt jern er forbundet med hypotensjon, kvalme, oppkast og / eller diaré, smerte, hypertensjon, dyspné, pruritus, hodepine og svimmelhet. Videre kan det være upraktisk å administrere og kostbart.9 Siden høy-molekylvekt (HMW) jerndextran er assosiert med en høyere forekomst av uønskede hendelser enn LMW jerndextran, er sistnevnte foretrukket generelt.6
Rød Blodcelletransfusjon: RBC er det foretrukne blodproduktet for transfusjoner for å korrigere anemi i tilfeller av akutt anemi etter blødning. Enkelte pasienter kan kreve infusjon som er cytomegalovirus negativ.Målet med å bruke en RBC-transfusjon er å behandle eller forhindre mangel på oksygenbæreevnen til blodet, og transfusjon er vanligvis ikke indikert hvis pasientens Hblevel er ≥10 g / dL.6
RBC-transfusjoner tilbyr fordelen med en rask økning i Hb- og hematokritnivåer umiddelbart etter infusjon. Det anslås at en transfusjon på 300 ml (1 enhet) av ren RBC vil resultere i en gjennomsnittlig økning på 1 g / dL Hb eller 3% av hematokrit hos en annen viten voksen voksen som ikke opplever samtidig blodtap. Dette fører til en generell rask forbedring av tretthet.6
Pasientens blod må krysses av ABO-kompatibilitet før RBC kan transfuseres. Hvis pasienten krever gjentatte infusjoner, kan risikoen for bivirkninger minimeres ved bruk av leukocyttreduserende blod og premedisinering med anantihistamin eller paracetamol.6
RBC-transfusjon er ikke uten risiko, inkludert potensialet for transfusjonsoverført smittsom midler, transfusjonsreaksjoner, alloimmunisering og immunsuppresjon.9 Andre risikoer for transfusjon inkluderer kongestiv hjertesvikt, økt trombotiske hendelser og jernoverbelastning.6 Det er imidlertid nyttig å merke seg at pasienter som trenger RBC-infusjoner i løpet av perioden som tilsvarer cellegiftbehandling, er svært usannsynlig opplever jernoverbelastning.6
Fremtidige perspektiver
Nye strategier for å håndtere anemi hos kreftpasienter blir nå forfulgt. Selv om det ikke er noen erstatning for menneskelig blod, er forskere i ferd med å utvikle produkter som har oksygenbæreevne til RBC. I rørledningen er Hb-baserte oksygenbærere og perfluorkarboner.5
Konklusjon
Alt i alt er den optimale tilnærmingen til anemi som en viktig sak i onkologi ennå ikke etablert. Mangel på konsistens mellom helsepersonell, en klar definisjon av anemi i kreft, og diagnostiske kriterier bidrar alle til dette problemet.
1. Steinmetz HT. Rollen til intravenøst jern i behandlingen av anemi hos kreftpasienter. Ther Adv Hematol. 2012; 3: 177-191.
2. deBenoist B, McLean E, Egli I, et al. Verdensomspennende forekomst av anemi 1993–2005: WHOs globale database om anemi. Genève, Sveits: Verdens helseorganisasjon; 2008.
3. Knight K, Wade S, Balducci L. Prevalens og utfall av anemi i kreft: en systematisk gjennomgang av litteraturen. Am J Med. 2004; 116 (suppl 7A): 11S-26S.
4. Schwartz RN. Anemi hos pasienter med kreft: forekomst, årsaker, innvirkning, håndtering og bruk av behandlingsretningslinjer og protokoller. Am J Health Syst Pharm. 2007; 64 (3 suppl 2): S5-S13; quiz S28-S30.
5. Calabrich A, Katz A. Behandling av anemi hos kreftpasienter. Fremtidig Oncol. 2011; 7: 507-517.
6. Rodgers GM, Becker P, Blinder M, et al. Kreft- og cellegiftindusert anemi. J Natl Compr Canc Netw. 2012; 10: 628-653.
7. Groopman JE, Itri LM. Kjemoterapiindusert anemi hos voksne: forekomst og behandling. J Natl Cancer Inst. 1999; 91: 1616-1634.
8. Ludwig H, Strasser K. Symptomatologi av anemi. Semin Oncol. 2001; 28: 7-14.
9. Gillespie TW. Anemi i kreft. Kreft sykepleie. 2003; 26: 119-128.
10. Koeller JM. Kliniske retningslinjer for behandling av kreftrelatert anemi. Farmakoterapi. 1998; 18: 156-169.
11. Cazzola M, Mercuriali F, Brugnara C. Bruk av rekombinant humant erytropoietin utenfor uremia. Blod. 1997; 89: 424-867.
12. Nowrousian MR, Kasper C, Oberhoff C, et al. Patofysiologi av kreftrelatert anemi. I: Smith JF, Boogaerts MA, Ehmer B, red. Erytropoietin i kreftstøttende behandling. New York, NY: Marcel Dekker; 1997: 13-34.
13. Vaupel P, Dunst J, Engert A, et al. Effekter av rekombinant humant erytropoietin (rHuEPO) på svulstkontroll hos pasienter med kreftindusert anemi. Onkologie. 2005; 28: 216-221.
14. Zhao KL, Liu G, Jiang GL, et al. Assosiasjon av hemoglobinnivå med sykelighet og dødelighet hos pasienter med lokalt avansert øsofageal karsinom som gjennomgår strålebehandling – en sekundæranalyse av tre påfølgende kliniske fase III-studier. Clin Oncol (R Coll Radiol). 2006; 18: 621-627.
15. Glaspy JA. Utviklingen av erytropoietiske midler innen onkologi. Ekspert Opin Emerg Drugs. 2005; 10: 553-567.
16. Adamson JW, Spivak JL. Fysiologisk grunnlag for farmakologisk bruk av rekombinant humant erytropoietin i kirurgi og kreftbehandling. Kirurgi. 1994; 115: 7-15.
17. Ferrario E, Ferrari L, Bidoli P, et al. Behandling av kreftrelatert anemi med epoetin alfa: en gjennomgang. 2004, 30: 563-575.
18. Lyman GH, Glaspy J. Er det kliniske fordeler med tidlig erytropoietisk intervensjon for cellegiftindusert anemi? Asystematisk gjennomgang. Kreft. 2006; 106: 223-233.
19. Rizzo JD, Brouwers M, Hurley P, et al. AmericanSociety of Clinical Oncology / American Society of Hematology klinisk praksis retningslinjeoppdatering om bruk av epoetin og darbepoetin hos voksne pasienter med kreft. J Clin Oncol. 2010; 28: 4996-5010.
20. Aranesp (darbepoetin alfa) forskrivningsinformasjon.Thousand Oaks, CA: Amgen Inc; Mai 2012.
21. Procrit (epoetin alfa) forskrivningsinformasjon. Horsham, PA: Janssen Products, LP; Juli 2012.
22. Beutel G, Ganser A. Risiko og fordeler med erytropoiesestimulerende midler i kreftbehandling. Semin Hematol. 2007; 44: 157-165.
23. Fenner MH, Ganser A. Erytropoietin i kreftrelatert anemi. Curr Opin Oncol. 2008; 20: 685-689.
24. Smith RE Jr, Aapro MS, Ludwig H, et al. Darbepoetinalfa for behandling av anemi hos pasienter med aktiv kreft som ikke mottar kjemoterapi eller strålebehandling: resultater fra en fase III, multisenter, randomisert, dobbeltblind, placebokontrollert studie. J Clin Oncol. 2008; 26: 1040-1050.
25. ESA APPRISE Oncology Program. Amgen og Janssen Products, LP. www.esa-apprise.com. Tilgang til 13. oktober 2013.