US Pharm. 2018; 43 (7): 22-26.
SAMMENDRAG: Statiner er en klasse medisiner som er mye brukt for primær og sekundær forebygging av kardiovaskulære hendelser. Med seks statiner tilgjengelig generelt, kan valget av et passende middel bestemmes basert på legemiddelspesifikke faktorer, inkludert doseringshensyn, legemiddelinteraksjoner og bivirkninger. Individualiserte pasientomsorgsplaner kan utvikles basert på data fra viktige kliniske studier, forskjeller i retningslinjer og gjeldende ledelsesanbefalinger for to store bivirkninger knyttet til statinbruk.
Hjørnesteinen i behandling med dyslipidemi innebærer bruk av 3-hydroksy-3-metylglutaryl-koenzym En reduktasehemmere, mer kjent som statiner. Med en rekke generiske alternativer på markedet og sterke bevis som støtter bruken, er statiner noen av de mest foreskrevne medisinene i verden.1 Imidlertid har hyppig bruk av disse midlene ført til kontinuerlig kontroll av deres sikkerhet og pågående debatt om deres rolle i terapi. Denne artikkelen, som fokuserer på generiske statiner, vil belyse debatten om statins rolle i terapi, diskutere riktig bruk og utforske bevis rundt to store bivirkninger.
Av de syv forskjellige statinene på markedet er seks er tilgjengelig generelt (TABELL 1) .2-7 Tre tilgjengelige formuleringer av merkevaren er pitavastatin (Livalo), simvastatin oral suspensjon (FloLipid) og lovastatin forlenget frigjøring (Altoprev) .8-10 Rollen til merkede midler i terapi er begrenset gitt den utbredte tilgjengeligheten av generiske alternativer.
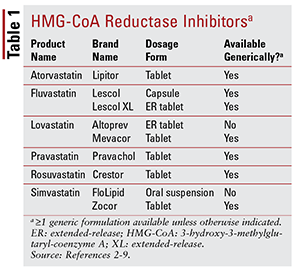
Atorvastatin og simvastatin er også tilgjengelig generelt i flere kombinasjonsprodukter. Disse inkluderer kombinasjonen av atorvastatin og amlodipin, en kalsiumkanalblokker (CCB) indikert for hypertensjon, og kombinasjonen av simvastatin og ezetimib, en tarmkolesterolabsorpsjonshemmere som også er indikert for hyperkolesterolemi.11,12 Koformulert statin og niacinprodukter (niacin / lovastatin og niacin / simvastatin) ble fjernet fra markedet i 2016 basert på mangel på bevis for at tilsetning av niacin hos statinbehandlede pasienter ytterligere reduserer kardiovaskulære (CV) resultater utover det som sees med statiner alene.13
BEHANDLINGSANBEFALINGER
Statiner har gjentatte ganger vist seg å være effektive for å redusere LDL-kolesterol (LDL-C) og triglyseridnivåer mens de øker HDL-kolesterol (HDL-C) nivåer.14 I tillegg har de vist seg å forbedre meningsfylt pasientorienterte utfall, som store CV-hendelser (CVE), i både primær og sekundær forebygging. 15-19
Flere sterkt omdiskuterte behandlingsretningslinjer drøfter statins rolle i behandling av perlipidemia. Disse inkluderer 2013 American College of Cardiology / American Heart Association (ACC / AHA) retningslinje og 2017 American Academy of Clinical Endocrinology (AACE) retningslinje.14,20 Begge retningslinjene antyder at etter implementering av livsstilsendringer, inkludert røykeslutt, overholdelse av et treningsregime, og etter et hjertesunt kosthold, er statiner førstelinjebehandling for både primær og sekundær forebygging av CV-sykdom (CVD). 14,20 Retningslinjene er imidlertid forskjellige i hvordan man skal bestemme hvilke statiner som passer for hvilke pasienter.
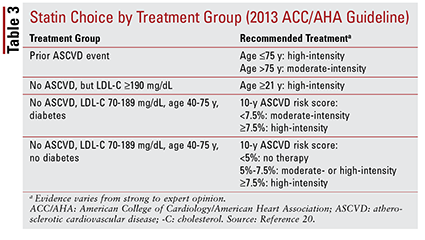
Retningslinjen for ACC / AHA fra 2013 introduserte fire behandlingsgrupper som var rettet mot statinbehandling:
1. Pasienter med tidligere aterosklerotisk CVD (ASCVD), inkludert de med en tidligere hendelse (dvs. akutte koronarsyndrom, historie med hjerteinfarkt, stabil eller ustabil angina, koronar eller annen arteriell revaskularisering, hjerneslag, forbigående iskemisk angrep eller perifer arteriell sykdom av antatt aterosklerotisk opprinnelse).
2. Pasienter uten historie med en ASCVD-hendelse som har et LDL-C-nivå på 190 mg / dL eller høyere. Alder er ikke grunnlag for utelukkelse fra dette kriteriet.
3. Pasienter i alderen 40 til 75 år med diabetes, men ingen historie med en ASCVD-hendelse, og et LDL-C-nivå mellom 70 og 189 mg / dL.
4. Pasienter i alderen 40 til 75 år uten diabetes som ikke tidligere har hatt en ASCVD-hendelse og et LDL-C-nivå mellom 70 og 189 mg / dL.20
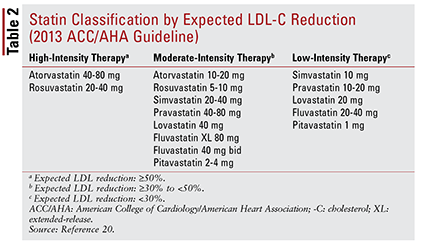
ACC / AHA-retningslinjen introduserte også ideen om å gruppere statiner etter intensitet (dvs. deres forventede LDL-C – senkende evne) (TABELL 2). 20 Basert på behandlingsgruppen (som definert ovenfor), anbefaler retningslinjen spesifikke statinintensiteter for bestemte kliniske situasjoner (TABELL 3) .20 Flere behandlingsgrupper kreve beregning av en ASCVD-risikoscore ved hjelp av en ASCVD-risikovurderer. Dette online verktøyet tar hensyn til pasientens alder, kjønn, rase, systoliske blodtrykk, total kolesterol, HDL-C og tidligere medisinsk historie som er viktig for hypertensjon, diabetes eller røyking.21 Når alle inngangene er lagt inn, er pasientens 10 -årsrisiko for å oppleve en ASCVD-hendelse beregnes.
Disse anbefalingene gjelder ikke automatisk for visse undergrupper av pasienter. For eksempel bør bruk av statiner til eldre voksne behandles forsiktig. Selv om statinbruk for sekundær forebygging hos eldre pasienter gir betydelig fordel, er dets bruk for primær forebygging uklar.22-24 I tillegg har pasienter med hjertesvikt ikke blitt funnet å ha de samme fordelene med statinbehandling som de uten hjertesvikt.25 Basert på disse funnene inkluderer behandlingsanbefalinger å begrense initiering av høyintensitetsstatiner til pasienter under 75 år og muligens å unngå statiner hos pasienter med hjertesvikt.20 Samlet sett er beslutningen om å bruke statiner i disse gruppene ikke klar og bør innebære en pågående samtale mellom leverandør og pasient om potensielle risikoer og fordeler ved behandling.20
I motsetning til 2013 ACC / AHA-anbefaling om å starte behandling i henhold til klassifisering av behandlingsgrupper, anbefaler AACE-retningslinjen for 2017 at individuelle pasienter behandlet basert på laboratoriefunn.14 I henhold til denne retningslinjen bestemmes pasientrisikoen av en rekke større, ekstra, a utradisjonelle risikofaktorer. Enkeltpersoner klassifiseres deretter i en av fem risikogrupper, hver med et tilsvarende LDL-C og ikke-HDL-C mål (TABELL 4). Basert på nåværende nivåer og individualiserte mål, bør statiner alene eller i kombinasjon med andre midler initieres basert på forventet LDL-C– eller ikke – HDL-C – senkende evne.14

Kombinasjonsbehandling som involverer tilsetning av et annet middel til pågående statinbehandling er fortsatt et noe kontroversielt tema. Mens tidligere studier og retningslinjer minimerte tilsetningen av andre stoffer til bakgrunn med statinbehandling, støtter nylige studier og konsensusuttalelser – inkludert en fra ACC / AHA – bruken av ezetimib, evolocumab eller alirocumab, hvorav de to siste er proproteinkonvertase subtilisin. / kexin type 9-hemmere, som tilleggsbehandling for sekundær forebygging. 20,26-31 Når det er sagt, forblir statiner universell førstelinjebehandling i både primær og sekundær forebygging; den definitive rollen til andre spesifikke midler er fortsatt uklar.
VALG AV STATIN
Valget av statinbehandling begynner med klinikerens foretrukne behandlingsmetode, enten det er ACC / AHA-metoden for statinbehandling grupper eller AACE-metoden for LDL-C eller ikke-HDL-C mål. Derfra må egenskapene til hvert statin tas i betraktning for å bestemme det beste alternativet for den enkelte pasient. Ikke alle statiner er like, og det er flere viktige forskjeller som kan påvirke pasientvalg, inkludert doseringshensyn, legemiddelinteraksjoner og bivirkninger (AE).
Dosering
Selv om de fleste statiner kan være tas uten hensyn til måltider, bør lovastatin med øyeblikkelig frigjøring tas sammen med kveldsmåltidet på grunn av økt biotilgjengelighet.4 Det motsatte gjelder imidlertid for lovastatin med utvidet frigivelse, som ikke bør tas sammen med mat på grunn av redusert biotilgjengelighet. .8 Videre, selv om alle statiner kan doseres en gang daglig, kan IR fluvastatin og lovastatin kreve dosering to ganger daglig. 3,4 Til slutt, mens atorvastatin, pravastatin og rosuvastatin kan administreres når som helst på dagen, fluvastatin, lovastatin og Simvastatin bør tas om kvelden. 3,4,7 Spesielt viste Simvastatin seg å ha signifikant forskjellig effekt når det ble tatt om kvelden i motsetning til morgenen.32
Legemiddelinteraksjoner
Hver statin har forskjellige bekymringer angående interaksjoner mellom narkotika og medikamenter på grunn av de spesifikke veiene som hver metaboliseres gjennom (TABELL 5). For mange legemiddelinteraksjoner eksisterer for å diskutere hver i detalj; Derfor er bare noen få utvalgte beskrevet nedenfor.
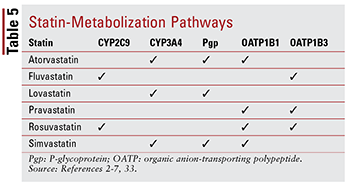
Fibrerer: Selv om kombinasjonen av et fibrat og et statin ikke har vist seg å endre kliniske resultater meningsfylt, kan pasienter fortsatt få forskrevet gemfibrozil, fenofibrat eller fenofibrinsyre sammen med et statin for å målrette alvorlig ukontrollert hypertriglyseridemi.14,20,26,33 Fordi begge disse klassene er assosiert med muskelrelatert toksisitet, kombinasjonsbehandling øker denne risikoen betydelig sammenlignet med begge terapiene alene.33 Denne additiv toksisiteten ses oftere med gemfibrozil enn med andre fibrater.33 Derfor er gemfibrozil bruk kontraindisert med simvastatin og bør unngås med andre statiner.7,20 Hvis et statin og et fibrat skal brukes sammen, foretrekkes fenofibrat eller fenofibrinsyre.20,33 Imidlertid, hvis gemfibrozil må brukes, fluvastatin — eller, med nøye overvåking, atorvastatin eller rosuvastatin (maksimalt 10 mg daglig ) —Er den valgte agenten.33
Amiodaron: Dette antiarytmika som er indikert for ventrikelflimmer er en kjent hemmer av P-glykoprotein (Pgp) og CYP450 enzymsystemet, spesielt CYP3A4 og i mindre grad CYP2C9.33,34 Som en resultat, maksimale anbefalte doser eksisterer for lovastatin (maksimalt 40 mg daglig) og simvastatin (maksimalt 20 mg daglig) når det brukes sammen med amiodaron.4,7,33 Selv om atorvastatin metaboliseres gjennom CYP3A4, er det ikke nødvendig å justere dosen (på samme måte som andre statiner) fordi data ikke antyder alvorlige bivirkninger når atorvastatin og amiodaron brukes samtidig.2,33
CCBs: Både dihydropyridin (amlodipin) og non-dihydropyridin CCB (diltiazem, verapamil) har vist seg å ha meningsfull interaksjon med legemidler . På samme måte som amiodaron, amlodipin, diltiazem og verapamil hemmer CYP3A4.33,35-37 Amlodipin har også en hemmende effekt på Pgp.33,35 Basert på AEs rapportert i litteraturen, anbefales en maksimal daglig dose på 20 mg for lovastatin når brukt sammen med amlodipin, diltiazem eller verapamil.4,33 Det anbefales også at simvastatin ikke overstiger 20 mg når det brukes sammen med amlodipin, men en lavere dose på 10 mg bør gis når det brukes sammen med diltiazem og verapamil. 7,33 Ingen spesifikk dosering Det foreligger anbefalinger med atorvastatin, selv om det bør utvises forsiktighet når det administreres med en av CCB-ene ikke-dihydropyridin.2,33
Bivirkninger
Statiner tolereres generelt godt; seponeringsfrekvensen er imidlertid fortsatt høy.38 Seponering av statinbehandling og manglende gjenopptakelse av statinbehandling etter forekomst av bivirkninger er assosiert med økte frekvenser av CVE.39 Pasientens bekymringer for statinsikkerhet i lys av to store statinrelaterte bivirkninger— myotoksisitet og nyoppstått diabetes – kan føre til seponering av statin.
Myotoksisitet: Statiner har lenge vært assosiert med muskelrelatert toksisitet, inkludert myalgi (muskelsmerter uten forhøyet kreatinkinase), myopati (generell betegnelse for muskler) sykdom) og myositis (muskelbetennelse), hvor de to siste involverer betydelige CK-forhøyninger. 40,41 Alle statiner deler en advarsel for den sjeldne, men alvorlige bivirkningen av rabdomyolyse. 2-7 Ofte er imidlertid myotoksisitet som tilskrives statiner på grunn av nocebo-effekten; det vil si at en person tror at en medisinering vil forårsake skade, og deretter medikamentene forårsaker den forventede skaden.42,43 Derfor, for å sikre det beste resultatet, må farmasøyter være godt kjent med denne ofte rapporterte bivirkningen og riktig håndtering. p>
Det er feil å anta at alle rapporter om muskelsymptomer skyldes nocebo-effekten; riktig vurdering av pasientens tidligere medisinske historie (PMH), beskrivelse av smerte og tilknytning til statinbehandling er viktig.44 For det første er en undersøkelse av PMH for CK-forhøyninger og andre potensielle årsaker til muskelsmerter eller svakhet at klinikeren kan behandle alternative underliggende patofysiologi eller korrekte faktorer som kan endre statins metabolisme. Vanlige årsaker inkluderer alderdom, legemiddelinteraksjoner, nedsatt nyre- eller leverfunksjon, økt fysisk aktivitet og vitamin D-mangel. 20,41
Deretter bør klinikeren sammenligne pasientens presentasjon med vanlig sett statininduserte symptomer . Statin-indusert muskeltoksisitet presenterer vanligvis som smerte, ømhet, kramper og svakhet, vanligvis i benmuskulaturen. 20,41 Disse symptomene er vanligvis verre etter trening og løser seg ikke uten avbrytelse av det krenkende middel.41
Det siste trinnet er å avgjøre om det foreligger en årsakssammenheng mellom symptomer og statinbruk. Når et statin mistenkes som årsak til milde til moderate symptomer, anbefales midlertidig seponering. Hvis symptomene ikke forsvinner etter ca. 2 uker, er sannsynligvis ikke statinen årsaken, og bør startes på nytt med den opprinnelige dosen. Imidlertid, hvis symptomene forsvinner, bør det foretas en ny prøve med samme statin i samme eller lavere dose. Hvis lignende symptomer deretter oppleves, bør statinen antas å være årsaken og avbrytes. Ved symptomoppløsning bør en lav dose av et alternativt statin initieres og titreres til maksimal tolerert dose. 20,41 Pasientens aksept og forståelse av denne prosessen er viktig fordi nocebo-effekten ellers kan føre til ytterligere opplevde reaksjoner.
Flere andre strategier finnes for å håndtere og forebygge disse symptomene. På grunn av en høyere sannsynlighet for symptomer kan klinikeren velge å unngå de mest lipofile statiner (lovastatin og simvastatin) til fordel for mer hydrofile statiner (fluvastatin, pravastatin og rosuvastatin) .44 Simvastatin 80 mg bør aldri startes som nytt terapi hos en hvilken som helst pasient på grunn av en uvanlig høy frekvens av statinassosierte muskelsymptomer. 7,45 Alternative behandlinger, som koenzym Q10, har ikke vist konsekvent nytte, men kan vurderes hos pasienter som opplever psykisk induserte symptomer.41,44,46 Endelig kan dosering med utvidet intervall, som involverer dosering av statinmedisiner flere ganger i uken i stedet for en gang daglig, vurderes. Denne tilnærmingen forbedrer overholdelse og lipidprofiler hos pasienter med tidligere statinintoleranse.47-49
Nybegynnerdiabetes: En viktig AE assosiert med statinbruk er nybegynnerdiabetes. Statiner har vist seg å øke risikoen for diabetesutvikling, selv om det finnes flere viktige advarsler.50 For det første, selv om dette kan betraktes som noe av en klasseeffekt, er den virkelige risikoen for hver spesifikke statin fremdeles ukjent.51,52 I den største meta -analyse til dags dato, pravastatin hadde den laveste risikoen, simvastatin og atorvastatin hadde en moderat risiko, og rosuvastatin hadde den høyeste risikoen for å forårsake nybegynnende diabetes.53 Ingen av disse funnene var imidlertid statistisk signifikante.53 I tillegg var funnet at diabetes risikoen øker da dosen av statinøkninger har vært inkonsekvent.54
Statin-indusert diabetes er mest utbredt hos personer som allerede har høy risiko for å utvikle diabetes.50,54 Dette inkluderer eldre pasienter og de med prediabetes eller metabolsk syndrom.50,55 Et konsekvent funn har vært at for hvert nye tilfelle av diabetes forårsaket av statiner, kan flere CVEer forhindres hos pasienter med høyere risiko.50 Derfor bør farmasøyter rådføre seg med en xious statinbrukere med moderat eller høy risiko for CV-komplikasjoner at risikoen for å utvikle diabetes mer enn oppveies av fordelene med CV-risikoen. Imidlertid er risiko-nytte-forholdet uklart hos pasienter med svært lav risiko for CVEs.50
KONKLUSJON
Selv om statinbehandling ikke er uten risiko, har fordelene ved å redusere CV-utfallet gjorde det til hjørnesteinen i CVE-forebygging. Tilgjengelige retningslinjer er vidt forskjellige, men den konstante er at statiner skal være førstelinjebehandling for primær og sekundær forebygging hos nesten alle pasienter. Den utbredte generiske tilgjengeligheten av statiner har gjort disse midlene stadig mer tilgjengelige. Ved å forstå at ikke alle statiner er like, kan farmasøyten bidra til å sikre best mulig resultat for hver pasient.
1. IMS Institute for Healthcare Informatics. Legemidler og bruk i USA: en gjennomgang av 2015 og utsiktene til 2020. https://morningconsult.com/wp-content/uploads/2016/04/IMS-Institute-US-Drug-Spending-2015.pdf. Tilgang til 18. mars 2018.
2. Lipitor (atorvastatin) pakningsvedlegg. New York, NY: Pfizer, Inc; Juni 2017.
3. Lescol / Lescol XL (fluvastatin) pakningsvedlegg. East Hanover, NJ: Novartis Pharmaceuticals Corp; August 2017.
4. Mevacor (lovastatin) pakningsvedlegg. Whitehouse Station, NJ: Merck & Co, Inc; Februar 2014.
5. Pravachol (pravastatin) pakningsvedlegg. Princeton, NJ: Bristol-Myers Squibb Company; Juli 2016.
6. Pakningsvedlegg til Crestor (rosuvastatin). Wilmington, DE: AstraZeneca Pharmaceuticals LP; August 2017.
7. Zocor (simvastatin) pakningsvedlegg. Whitehouse Station, NJ: Merck & Co, Inc; Februar 2015.
8. Altoprev (lovastatin) pakningsvedlegg. Zug, Sveits: Covis Pharma; April 2017.
9. FloLipid (simvastatin) pakningsvedlegg. Brooksville, FL: Salerno Pharmaceuticals LP; Juli 2017.
10. Livalo (pitavastatin) pakningsvedlegg. Montgomery, AL: Kowa Pharmaceuticals America, Inc; November 2016.
11. Pakningsvedlegg for Caduet (amlodipin / atorvastatin). New York, NY: Pfizer Inc; Oktober 2017.
12. Vytorin (ezetimibe / simvastatin) pakningsvedlegg. Whitehouse Station, NJ: Merck & Co, Inc; Februar 2018.
13. AbbVie Inc .; tilbaketrekning av godkjenning av nye legemiddelsøknader for Advicor og Simcor. www.federalregister.gov/documents/2016/04/18/2016-08894/abbvie-inc-withdrawal-of-approval-of-new-drug-applications-for-advicor-and-simcor. Tilgang til 18. mars 2018.
14. Jellinger PS, Handelsman Y, Rosenblit PD, et al. American Association of Clinical Endocrinologists og American College of Endocrinology guidelines for management of dyslipidemia and prevention of cardiovascular disease. Endocr Pract. 2017; 23 (suppl 2): 1-87.
15. LaRosa JC, Grundy SM, Waters DD, et al. Intensiv lipidsenkning med atorvastatin hos pasienter med stabil koronarsykdom. N Engl J Med. 2005; 352: 1425-1435.
16. Ridker PM, Danielson E, Fonseca FA, et al. Rosuvastatin for å forhindre vaskulære hendelser hos menn og kvinner med forhøyet C-reaktivt protein. N Engl J Med. 2008; 359: 2195-2207.
17. Mihaylova B, Emberson J, Blackwell L, et al. Effektene av å senke LDL-kolesterol med statinbehandling hos personer med lav risiko for vaskulær sykdom: metaanalyse av individuelle data fra 27 randomiserte studier. Lancet. 2012; 380: 581-590.
18. Baigent C, Landray MJ, Reith C, et al. Effektene av å senke LDL-kolesterol med simvastatin pluss ezetimib hos pasienter med kronisk nyresykdom (Study of Heart and Renal Protection): en randomisert placebokontrollert studie. Lancet. 2011; 377: 2181-2192.
19. Cannon CP, Braunwald E, McCabe CH, et al.Intensiv versus moderat lipidsenkning med statiner etter akutte koronarsyndrom. N Engl J Med. 2004; 350: 1495-1504.
20. Stone NJ, Robinson JG, Lichtenstein AH, et al. 2013 ACC / AHA-retningslinje om behandling av kolesterol i blodet for å redusere aterosklerotisk kardiovaskulær risiko hos voksne: en rapport fra American College of Cardiology / American Heart Association Task Force on Practice Guidelines. Sirkulasjon. 2014; 129 (25 suppl 2): S1-S45.
21. American College of Cardiology. ASCVD Risk Estimator Plus. http://tools.acc.org/ASCVD-Risk-Estimator. Tilgang 18. mars 2018.
22. Wenger NK, Lewis SJ, Herrington DM, et al. Resultat av bruk av høy eller lav dose atorvastatin hos pasienter 65 år eller eldre med stabil koronar hjertesykdom. Ann Intern Med. 2007; 147: 1-9.
23. Shepherd J, Blauw GJ, Murphy MB, et al. Pravastatin hos eldre personer med risiko for vaskulær sykdom (PROSPER): en randomisert kontrollert studie. Lancet. 2002; 360: 1623-1630.
24. Teng M, Lin L, Zhao YJ, et al. Statiner for primær forebygging av hjerte- og karsykdommer hos eldre pasienter: systematisk gjennomgang og metaanalyse. Aldring av narkotika. 2015; 32: 649-661.
25. Kjekshus J, Apetrei E, Barrios V, et al. Rosuvastatin hos eldre pasienter med systolisk hjertesvikt. N Engl J Med. 2007; 357: 2248-2261.
26. Ginsberg HN, Elam MB, Lovato LC, et al. Effekter av kombinasjonslipidbehandling ved type 2 diabetes mellitus. N Engl J Med. 2010; 362: 1563-1574.
27. Kastelein JJ, Akdim F, Stroes ES, et al. Simvastatin med eller uten ezetimib i familiær hyperkolesterolemi. N Engl J Med. 2008; 358: 1431-1443.
28. Cannon CP, Blazing MA, Giugliano RP, et al. Ezetimibe ble lagt til statinbehandling etter akutte koronarsyndrom. N Engl J Med. 2015; 372: 2387-2397.
29. Sabatine MS, Giugliano RP, Keech AC, et al. Evolocumab og kliniske resultater hos pasienter med hjerte- og karsykdommer. N Engl J Med. 2017; 376: 1713-1722.
30. Lloyd-Jones DM, Morris PB, Ballantyne CM, et al. 2017 fokusert oppdatering av 2016 ACC Expert Consensus Decision Pathway om rollen som ikke-statinbehandling for LDL-kolesterolsenking i håndteringen av aterosklerotisk kardiovaskulær sykdomsrisiko: en rapport fra American College of Cardiology Task Force on Expert Consensus Decision Pathways. J Am Coll Cardiol. 2017; 70: 1785-1822.
31. ODYSSEY-utfall: Resultatene antyder at bruk av PCSK9-hemmer reduserer CV-hendelser, LDL-C hos ACS-pasienter. American College of Cardiology. www.acc.org/latest-in-cardiology/articles/2018/03/05/15/53/sat-9am-odyssey-outcomes-cv-outcomes-with-alirocumab-after-acs-acc-2018. Tilgang 20. juni 2018.
32. Wallace A, Chinn D, Rubin G. Tar simvastatin om morgenen sammenlignet med om kvelden: randomisert kontrollert studie. BMJ. 2003; 327: 788.
33. Wiggins BS, Saseen JJ, Page RL, et al. Anbefalinger for behandling av klinisk signifikante legemiddelinteraksjoner med statiner og utvalgte midler brukt til pasienter med hjerte- og karsykdommer: en vitenskapelig uttalelse fra American Heart Association. Sirkulasjon. 2016; 134: e468-e495.
34. Pacerone (amiodaron) pakningsvedlegg. Maple Grove, MN: Upsher-Smith Laboratories LLC; Juli 2017.
35. Norvasc (amlodipin) pakningsvedlegg. New York, NY: Pfizer Inc; Oktober 2017.
36. Pakningsvedlegg for Cardizem (diltiazem). Bridgewater, NJ: Valeant Pharmaceuticals; November 2016.
37. Calan (verapamil) pakningsvedlegg. New York, NY: Pfizer Inc; September 2017.
38. Riaz H, Khan AR, Khan MS, et al. Metaanalyse av placebokontrollerte randomiserte kontrollerte studier på prevalensen av statinintoleranse. Er J Cardiol. 2017; 120: 774-781.
39. Zhang H, Plutzky J, Shubina M, Turchin A. Fortsatte statinresepter etter bivirkninger og pasientresultater: en kohortestudie. Ann Intern Med. 2017; 167: 221-227.
40. Tomaszewski M, Stepien KM, Tomaszewska J, Czuczwar SJ. Statin-induserte myopatier. Pharmacol Rep. 2011; 63: 859-866.
41. Stroes ES, Thompson PD, Corsini A, et al. Statinassosierte muskelsymptomer: innvirkning på statinbehandling — European Atherosclerosis Society Consensus Panel Statement on assessment, etiologi and management. Eur Heart J. 2015; 36: 1012-1022.
42. Gupta A, Thompson D, Whitehouse A, et al. Bivirkninger assosiert med ublindet, men ikke med blindet, statinbehandling i den anglo-skandinaviske kardiale utfallsforsøket – lipidsenkende arm (ASCOT-LLA): en randomisert dobbeltblind placebokontrollert studie og dens ikke-randomiserte ikke-blinde forlengelse fase. Lancet. 2017; 389: 2473-2481.
43. Pedro-Botet J, Rubiés-Prat J. Statin-assosierte muskelsymptomer: pass opp for nocebo-effekten. Lancet. 2017; 389: 2445-2446.
44. Laufs U, Filipiak KJ, Gouni-Berthold I, et al. Praktiske aspekter ved håndtering av statinassosierte muskelsymptomer (SAMS). Atheroscler Suppl. 2017; 26: 45-55.
45. Medisinsk sikkerhetskommunikasjon fra FDA: nye restriksjoner, kontraindikasjoner og dosebegrensninger for Zocor (simvastatin) for å redusere risikoen for muskelskader. www.fda.gov/Drugs/DrugSafety/ucm256581.htm. Tilgang 18. mars 2018.
46.Banach M, Serban C, Sahebkar A, et al. Effekter av koenzym Q10 på statin-indusert myopati: en metaanalyse av randomiserte kontrollerte studier. Mayo Clin Proc. 2015; 90: 24-34.
47. Goldberg AS, DeGorter MK, Ban MR, et al. Effekt og plasmakonsentrasjoner med plasma ved ikke-daglig dosering av rosuvastatin. Kan J Cardiol. 2013; 29: 915-919.
48. Matalka MS, Ravnan MC, Deedwania PC. Er alternativ daglig dose atorvastatin effektiv ved behandling av pasienter med hyperlipidemi? Den alternative dagen mot daglig dosering av Atorvastatin-studien (ADDAS). Am Heart J. 2002; 144: 674-677.
49. Copher HR, Stewart RD. Daglig dosering versus dosering av andre dager av simvastatin hos pasienter med hyperkolesterolemi. Farmakoterapi. 2002; 22: 1110-1116.
50. Rochlani Y, Kattoor AJ, Pothineni NV, et al. Balansering av primærforebygging og statin-indusert diabetes mellitusforebygging. Er J Cardiol. 2017; 120: 1122-1128.
51. Corrao G, Ibrahim B, Nicotra F, et al. Statiner og risikoen for diabetes: bevis fra en stor populasjonsbasert kohortestudie. Diabetesomsorg. 2014; 37: 2225-2232.
52. Lim S, Oh PC, Sakuma I, Koh KK. Hvordan balansere kardiorenometabolske fordeler og risiko for statiner. Åreforkalkning. 2014; 235: 644-648.
53. Navarese EP, Buffon A, Andreotti F, et al. Metaanalyse av innvirkning av forskjellige typer og doser av statiner på nybegynnende diabetes mellitus. Er J Cardiol. 2013; 111: 1123-1130.
54. Crandall JP, Mather K, Rajpathak SN, et al. Statinbruk og risiko for å utvikle diabetes: resultater fra Diabetes Prevention Program. BMJ Open Diabetes Res Care. 2017; 5: e000438.
55. Ganda OP. Statin-indusert diabetes: forekomst, mekanismer og implikasjoner. F1000Res. 2016; 5..