Senking av damptrykk
Som beskrevet i kapittelet om væsker og faste stoffer, er likevektsdamptrykket til en væske det trykket som utøves av dets gassformige fase når fordampning og kondens forekommer i like høye hastigheter:
\ text {liquid} \ rightleftharpoons \ text {gas}
Å oppløse et ikke-flyktig stoff i en flyktig væske resulterer i en senking av væskens damptrykk. Dette fenomenet kan rasjonaliseres ved å vurdere effekten av tilsatte oppløste molekyler på væskens fordampnings- og kondensasjonsprosesser. For å fordampe må løsningsmiddelmolekyler være tilstede på overflaten av løsningen. Tilstedeværelsen av løsemiddel reduserer overflatearealet som er tilgjengelig for løsningsmiddelmolekyler og reduserer derved hastigheten av fordampning av løsemiddel. Siden kondensasjonshastigheten ikke påvirkes av tilstedeværelsen av løsemiddel, er nettoresultatet at fordampning-kondensasjonsvekt oppnås med færre løsningsmiddelmolekyler i dampfasen (dvs. ved et lavere damptrykk) (figur 1). Selv om denne kinetiske tolkningen er nyttig, tar den ikke hensyn til flere viktige aspekter av den kolligative naturen til damptrykkssenking. En strengere forklaring innebærer egenskapen til entropi, et diskusjonstema i et senere tekstkapittel om termodynamikk. For å forstå senkning av væskens damptrykk, er det tilstrekkelig å merke seg at den større entropien til en løsning i forhold til dens separate løsningsmiddel og oppløsningsmiddel tjener til å effektivt stabilisere løsningsmidlet og hindre deres fordampning. Et lavere damptrykk resulterer, og et tilsvarende høyere kokepunkt som beskrevet i neste avsnitt av denne modulen.
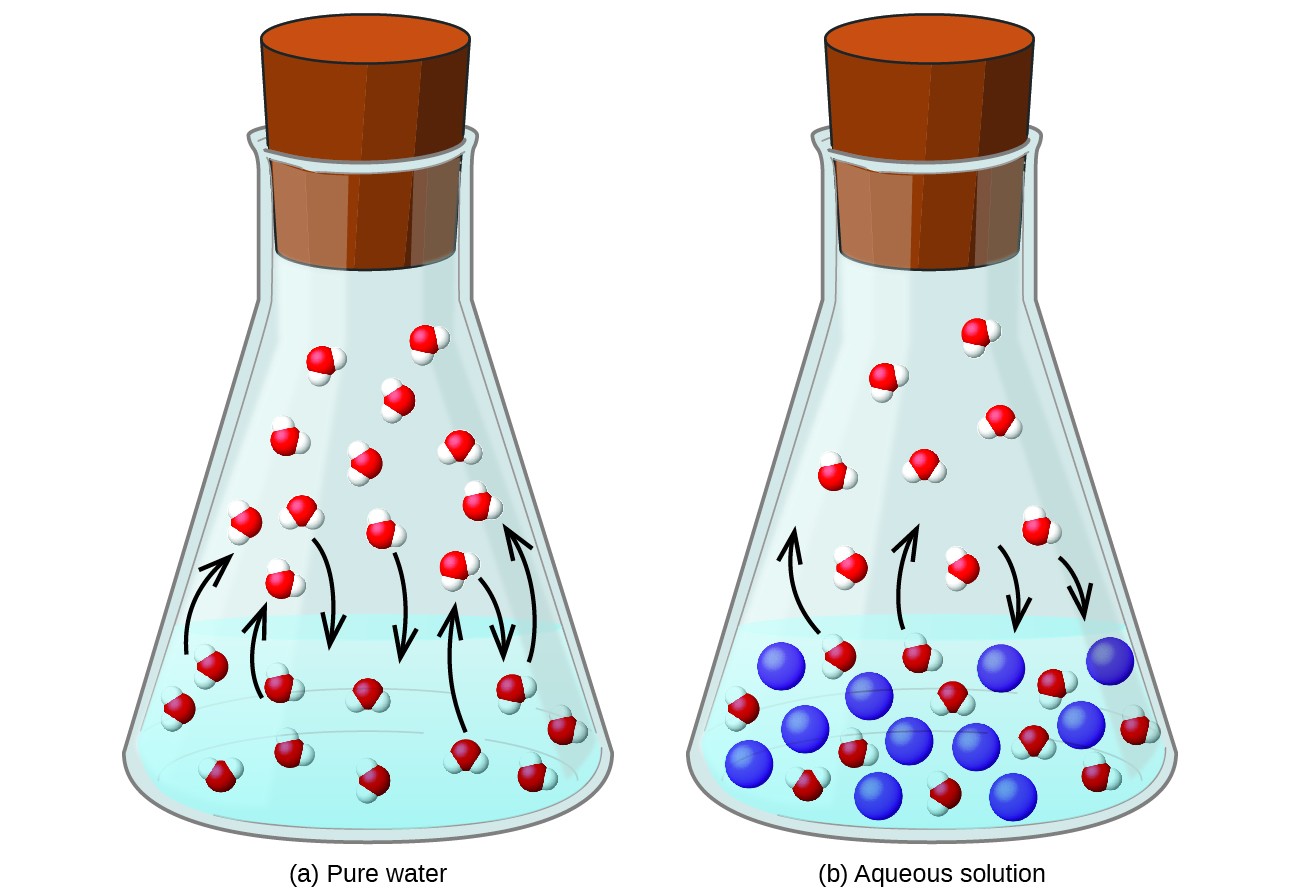
Figur 1. Tilstedeværelsen av ikke-flyktige oppløste stoffer senker damptrykket til en løsning ved å hindre fordampningen av løsemiddelmolekyler.
Forholdet mellom damptrykket til løsningskomponentene og konsentrasjonene av disse komponentene er beskrevet av Raoults lov: Deltrykket som utøves av en hvilken som helst komponent i en ideell løsning er lik damptrykket til den rene komponenten multiplisert med dens molfraksjon i løsningen.
{P} _ {\ text {A}} = {X} _ {\ text {A}} {P} _ {\ text {A}} ^ {\ star}
Når vi minner om at det totale trykket til en gassformig blanding er lik summen av partialtrykk for alle dets komponenter (Daltons lov om deltrykk), er det totale damptrykket som utøves av en løsning som inneholder i komponenter
{ P} _ {\ text {løsning}} = \ sum _ {i} {P} _ {i} = \ sum _ {i} {X} _ {i} {P} _ {i} ^ {\ star}
Et ikke-flyktig stoff er et stoff med damptrykk som er ubetydelig (P ^ {\ star} ≈ 0), og så damptrykket over en løsning som bare inneholder ikke-flyktige oppløste stoffer skyldes bare løsningsmidlet:
{P} _ {\ text {løsning}} = {X} _ {\ text {løsemiddel}} {P} _ {\ tekst {løsemiddel}} ^ {\ stjerne}
Destillasjon av løsninger
Destillasjon er en teknikk for å skille komponentene i blandinger som brukes mye både i laboratoriet og i industrielle omgivelser. Den brukes til å raffinere petroleum, til å isolere gjæringsprodukter og til å rense vann. Denne separasjonsteknikken involverer kontrollert oppvarming av en prøveblanding for å fordampe, kondensere og samle en eller flere komponenter av interesse. Et typisk apparat for destillasjoner på laboratorieskala er vist i figur 2.

Figur 2. En typisk laboratoriedestillasjonsenhet er vist i (a) et fotografi og (b) et skjematisk diagram over komponentene. (kreditt a: modifikasjon av arbeid av «Rifleman82» / Wikimedia commons; kreditt b: modifikasjon av arbeid av «Slashme» / Wikipedia)
Oljeraffinerier bruker storskala brøkdestillasjon for å skille komponenter av råolje. Råoljen oppvarmes til høye temperaturer ved bunnen av en høy fraksjoneringskolonne, og fordamper mange av komponentene som stiger i kolonnen. Ettersom fordampede komponenter når tilstrekkelig kule soner under oppstigningen, kondenserer de og samles opp. De oppsamlede væskene er enklere blandinger av hydrokarboner og andre petroleumsforbindelser som har passende sammensetning for forskjellige anvendelser (f.eks. Diesel, petroleum, bensin), som vist i figur 3.

Figur 3. Råolje er en kompleks blanding som skilles fra fraksjonell destillasjon i stor skala for å isolere forskjellige enklere blandinger.
Kokepunktforhøyning
Som beskrevet i kapittelet om væsker og faste stoffer, er kokepunktet for en væske temperaturen der damptrykket er lik det omgivende atmosfæretrykket.Siden damptrykket til en løsning senkes på grunn av tilstedeværelsen av ikke-flyktige oppløste stoffer, er det grunn til at løsningens kokepunkt senere vil økes. Sammenlignet med rent løsningsmiddel vil en løsning derfor kreve en høyere temperatur for å oppnå et gitt damptrykk, inkludert en ekvivalent med den i den omgivende atmosfæren. Økningen i kokepunktet som observeres når ikke-flyktig løsemiddel oppløses i et løsningsmiddel, ΔTb, kalles kokepunkthøyde og er direkte proporsjonal med molkonsentrasjonen av oppløste arter: \ Delta {T} _ {\ text {b}} = {K} _ {\ text {b}} m
der Kb er kokepunktets høydekonstant, eller ebullioskopisk konstant og m er molal konsentrasjon (molalitet) av alle oppløste arter.
Kokepunktets høydekonstanter er karakteristiske egenskaper som avhenger av identiteten til løsningsmidlet. Verdier av Kb for flere løsningsmidler er oppført i tabell 1.
I hvilken grad damptrykket til et løsningsmiddel senkes og kokepunktet blir forhøyet, avhenger av det totale antall oppløste partikler som er tilstede i en gitt mengde løsningsmiddel, ikke på massen eller størrelsen eller kjemiske identitetene til partiklene. En 1 m vandig løsning av sukrose (342 g / mol) og en 1 m vandig løsning av etylenglykol (62 g / mol) vil utvise det samme kokepunktet fordi hver løsning har ett mol oppløste partikler (molekyler) per kilo løsningsmiddel .
Eksempel 6: Kokepunktet for en jodoppløsning
Finn kokepunktet for en løsning av 92,1 g jod, I2, i 800,0 g kloroform, CHCl3 antar at jodet er ikke-flyktig og at løsningen er ideell.
Sjekk din læring
Hva er kokepunktet for en løsning på 1,0 g glyserin, C3H5 (OH) 3, i 47,8 g vann? Anta en ideell løsning.
Deponering av frysepunkt

Figur 4. Bergsalt ( NaCl), kalsiumklorid (CaCl2) eller en blanding av de to brukes til å smelte is. (kreditt: modifikasjon av arbeid av Eddie Welker)
Løsninger fryser ved lavere temperaturer enn rene væsker. Dette fenomenet blir utnyttet i «avising» -skjemaer som bruker salt (figur 4), kalsiumklorid eller urea for å smelte is på veier og fortau, og i bruken av etylenglykol som et «frostvæske» i bilradiatorer. Sjøvann fryser ved en lavere temperatur enn ferskvann, og derfor forblir de arktiske og antarktiske havene ufrosne selv ved temperaturer under 0 ° C (det samme gjør kroppsvæskene til fisk og andre kaldblodige sjødyr som lever i disse havene).
Reduksjonen i frysepunktet for en fortynnet løsning sammenlignet med den for det rene løsningsmidlet, ATF, kalles frysepunktdepresjonen og er direkte proporsjonal med molalkonsentrasjonen av det oppløste stoffet
\ Delta {T} _ {\ text {f}} = {K} _ {\ text {f}} m
hvor m er den molale konsentrasjonen av det oppløste stoffet i løsningsmidlet og Kf kalles frysepunktet depresjonskonstant (eller kryoskopisk konstant). Akkurat som for høydekonstanter for kokepunkt, er disse karakteristiske egenskaper hvis verdier avhenger av den kjemiske identiteten til løsningsmidlet. Verdier av Kf for flere løsemidler er oppført i tabell 1.
Colligative Properties and De-Icing
Natriumklorid og dets gruppe 2-analoger kalsium og magnesiumklorid brukes ofte til avisveier og fortau, på grunn av det faktum at en løsning av et av disse saltene vil ha et frysepunkt lavere enn 0 ° C, frysepunktet for rent vann. Gruppe 2 metallsalter blandes ofte med billigere og lettere tilgjengelig natriumklorid («bergsalt») for bruk på veier, siden de har en tendens til å være noe mindre etsende enn NaCl, og de gir en større nedsenking av frysepunktet. siden de dissosierer for å gi tre partikler per formelenhet, i stedet for to partikler som natriumklorid.
Fordi disse ioniske forbindelsene har en tendens til å fremskynde korrosjonen av metall, ville de ikke være et klokt valg å frostvæske for radiatoren i bilen din eller for å avisere et fly før start.For disse anvendelser brukes ofte kovalente forbindelser, slik som etylen eller propylenglykol. Glykolene som brukes i radiatorvæske senker ikke bare væskens frysepunkt, men de hever kokepunktet, noe som gjør væsken nyttig både vinter og sommer. Oppvarmede glykoler sprayes ofte på flyets overflate før avgang i dårlig vær om vinteren for å fjerne is som allerede har dannet seg og forhindre dannelse av mer is, noe som vil være spesielt farlig hvis det dannes på flyets kontrollflater (figur 5).

Figur 5. Nedfrysing av frysepunkt utnyttes for å fjerne is fra (a) veibaner og (b) flyets kontrollflater.
Fasediagram for en løsning
De kolligative effektene på damptrykk, kokepunkt og frysepunkt beskrevet i forrige avsnitt er praktisk oppsummert ved å sammenligne fasediagrammene for en ren væske og en løsning avledet fra den væsken. Fasediagrammer for vann og en vandig løsning er vist i figur 6.
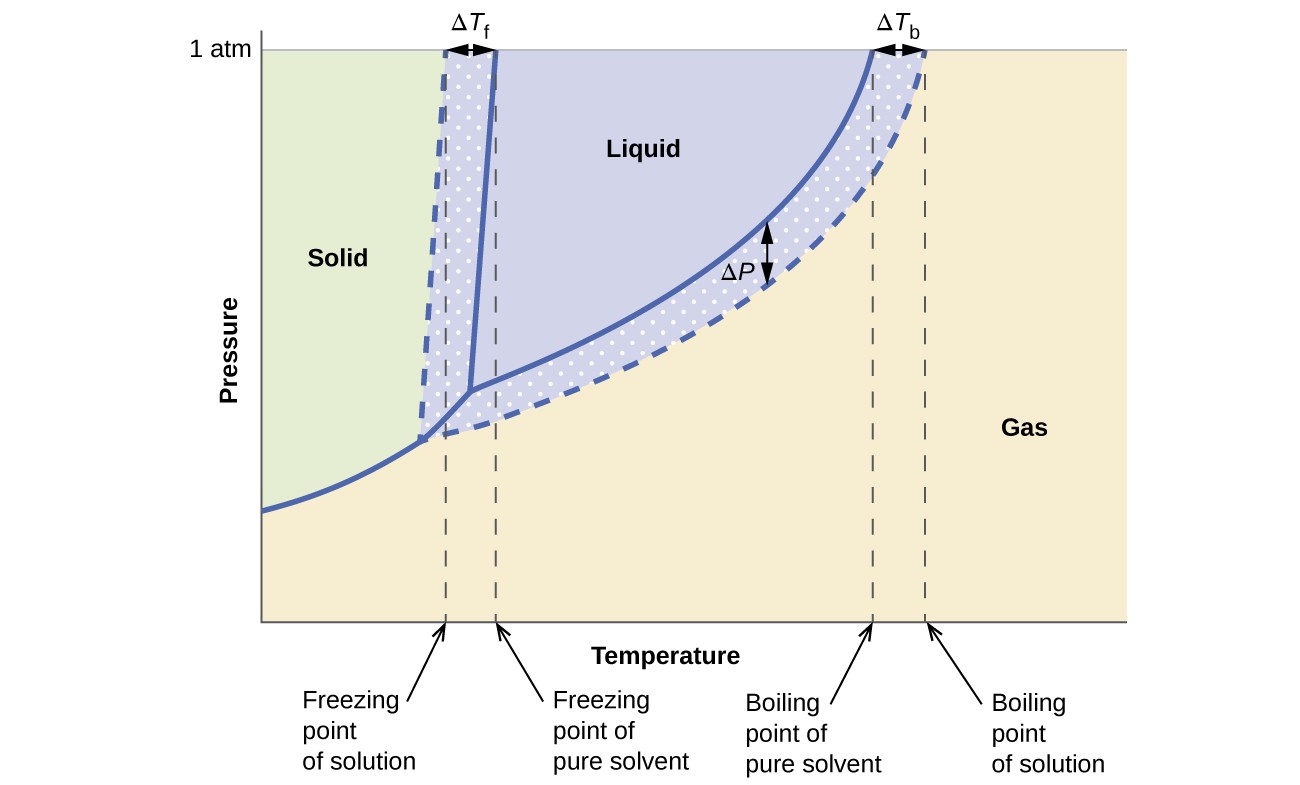
Figur 6. Disse faser diagrammer viser vann (faste kurver) og en vandig løsning av ikke-elektrolytt (stiplede kurver).
Væske-dampkurven for løsningen er plassert under den tilsvarende kurven for løsningsmidlet, som viser dampen trykk senking, ΔP, som skyldes oppløsning av ikke-flyktig løsemiddel. Følgelig, ved et gitt trykk, observeres oppløsningens kokepunkt ved en høyere temperatur enn den for det rene løsningsmidlet, noe som gjenspeiler kokepunktet, ATB, assosiert med tilstedeværelsen av ikke-flyktig løsemiddel. Fast-væske-kurven for løsningen forskyves til venstre for den for det rene løsningsmidlet, som representerer frysepunktsdypet, ATb, som følger med dannelsen av løsningen. Til slutt, legg merke til at faste gasskurver for løsningsmidlet og løsningen er identiske. Dette er tilfelle for mange løsninger som inneholder flytende løsemidler og ikke-flyktige oppløste stoffer. Akkurat som for fordampning, når en løsning av denne typen er frossen, er det faktisk bare løsningsmidlet molekyler som gjennomgår væske-til-fast-overgangen, og danner et rent fast løsningsmiddel som ekskluderer oppløste arter. De faste og gassformige fasene er derfor bare sammensatt løsningsmiddel, og overganger mellom disse fasene er derfor ikke utsatt for kolligative effekter.
Osmose og osmotisk trykk av løsninger
Et antall naturlige og syntetiske materialer utviser selektiv gjennomtrengning, noe som betyr at bare molekyler eller ioner av en viss størrelse, form, polaritet, ladning og så videre, er i stand til å passere gjennom (gjennomsyre) materialet. Biologiske cellemembraner gir elegante eksempler på selektiv gjennomtrengning i naturen, mens dialyseslanger som brukes til å fjerne metabolsk avfall fra blod er et mer forenklet teknologisk eksempel. Uansett hvordan de kan fremstilles, blir disse materialene generelt referert til som semipermeable membraner.
Tenk på apparatet illustrert i figur 7, hvor prøver av rent løsemiddel og en løsning er atskilt med en membran som bare er løsemiddel. molekyler kan gjennomsyre. Løsemiddelmolekyler vil diffundere over membranen i begge retninger. Siden konsentrasjonen av løsemiddel er større i det rene løsningsmidlet enn løsningen, vil disse molekylene diffundere fra løsningsmiddelsiden av membranen til løsningssiden i en raskere hastighet enn de vil i motsatt retning. Resultatet er en nettooverføring av løsemiddelmolekyler fra det rene løsningsmidlet til løsningen. Diffusjonsdrevet overføring av løsningsmiddelmolekyler gjennom en semipermeabel membran er en prosess kjent som osmose.
Figur 7. (a) En oppløsning og et rent løsemiddel blir først separert av en osmotisk membran. (b) Nettoverføring av løsemiddelmolekyler til løsningen skjer til dets osmotiske trykk gir like overføringshastigheter i begge retninger.
Når osmose utføres i et apparat som det som er vist i figur 7 øker volumet av løsningen når den blir fortynnet ved akkumulering av løsningsmiddel. Dette fører til at oppløsningsnivået øker, og øker det hydrostatiske trykket (på grunn av vekten av løsningskolonnen i røret) og resulterer i en raskere overføring av løsningsmiddelmolekyler tilbake til den rene løsningsmiddelsiden. Når trykket når en verdi som gir en omvendt løsemiddeloverføringshastighet lik osmosehastigheten, opphører bulkoverføringen av løsningsmidlet. Dette trykket kalles det osmotiske trykket (Π) av løsningen. Det osmotiske trykket til en fortynnet løsning er relatert til dens oppløste molaritet, M og absolutte temperatur, T, i henhold til ligningen
\ Pi = MRT
der R er den universelle gasskonstanten.
Hvis en løsning plasseres i et apparat som det som er vist i figur 8, reverserer osmosen ved å påføre trykk som er større enn det osmotiske trykket i løsningen, og skyver løsningsmiddelmolekyler fra løsningen inn i det rene løsningsmidlet. Denne teknikken for omvendt osmose brukes til storskala avsaltning av sjøvann og i mindre skalaer for å produsere vann fra springen med høy renhet for drikke.
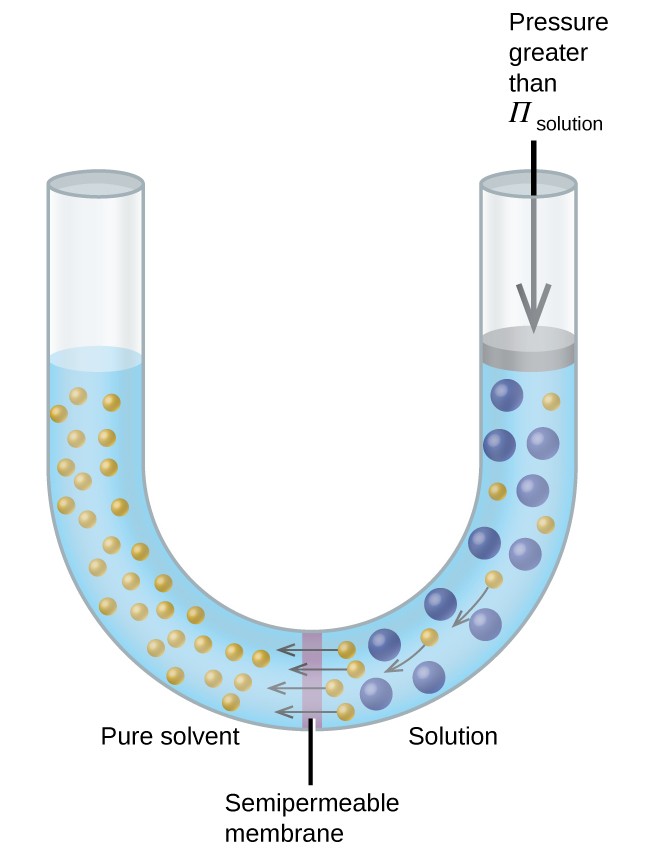
Figur 8. Bruk av et trykk som er større enn det osmotiske trykket til en løsning, vil reversere osmose. Løsemiddelmolekyler fra løsningen skyves inn i det rene løsningsmidlet.
Omvendt osmose Vannrensing
I prosessen med osmose tjener diffusjon til å flytte vann gjennom en semipermeabel membran fra en mindre konsentrert løsning til en mer konsentrert løsning. Osmotisk trykk er mengden trykk som må påføres den mer konsentrerte løsningen for å få osmose til å stoppe. Hvis større trykk påføres, vil vannet gå fra den mer konsentrerte løsningen til en mindre konsentrert (mer ren) løsning. Dette kalles omvendt osmose. Omvendt osmose (RO) brukes til å rense vann i mange bruksområder, fra avsaltingsanlegg i kystbyer, til vannrensende maskiner i dagligvarebutikker (figur 9) og mindre husholdningsenheter med omvendt osmose. Med en hånddrevet pumpe kan små RO-enheter brukes i land i tredje verden, katastrofeområder og i livbåter. Våre militære styrker har en rekke generatorstyrte RO-enheter som kan transporteres i kjøretøy til avsidesliggende steder.

Figur 9. Omvendte osmosesystemer for rensing av drikkevann er vist her på (a) små og (b) store skalaer. (kreditt a: modifikasjon av arbeid av Jerry Kirkhart; kreditt b: modifikasjon av arbeid av Willard J. Lathrop)
Eksempler på osmose er tydelige i mange biologiske systemer fordi celler er omgitt av semipermeable membraner. Gulrøtter og selleri som har blitt slappe fordi de har mistet vann, kan gjøres skarpe igjen ved å plassere dem i vann. Vann beveger seg inn i gulrot eller selleri celler ved osmose. En agurk plassert i en konsentrert saltoppløsning mister vann ved osmose og absorberer litt salt for å bli en sylteagurk. Osmose kan også påvirke dyreceller. Konsentrasjoner av løsemiddel er spesielt viktige når løsninger injiseres i kroppen. Oppløste stoffer i kroppscellevæsker og blodserum gir disse løsningene et osmotisk trykk på ca. 7,7 atm. Løsninger injisert i kroppen må ha samme osmotiske trykk som blodserum; det vil si at de skal være isotoniske med blodserum. Hvis en mindre konsentrert løsning, en hypoton løsning, injiseres i tilstrekkelig mengde for å fortynne blodserumet, passerer vann fra det fortynnede serumet inn i blodcellene ved osmose, noe som får cellene til å ekspandere og sprekke. Denne prosessen kalles hemolyse. Når en mer konsentrert løsning, en hypertonisk løsning, injiseres, mister cellene vann til den mer konsentrerte løsningen, krymper og dør muligens i en prosess som kalles crenering. Disse effektene er illustrert i figur 10.
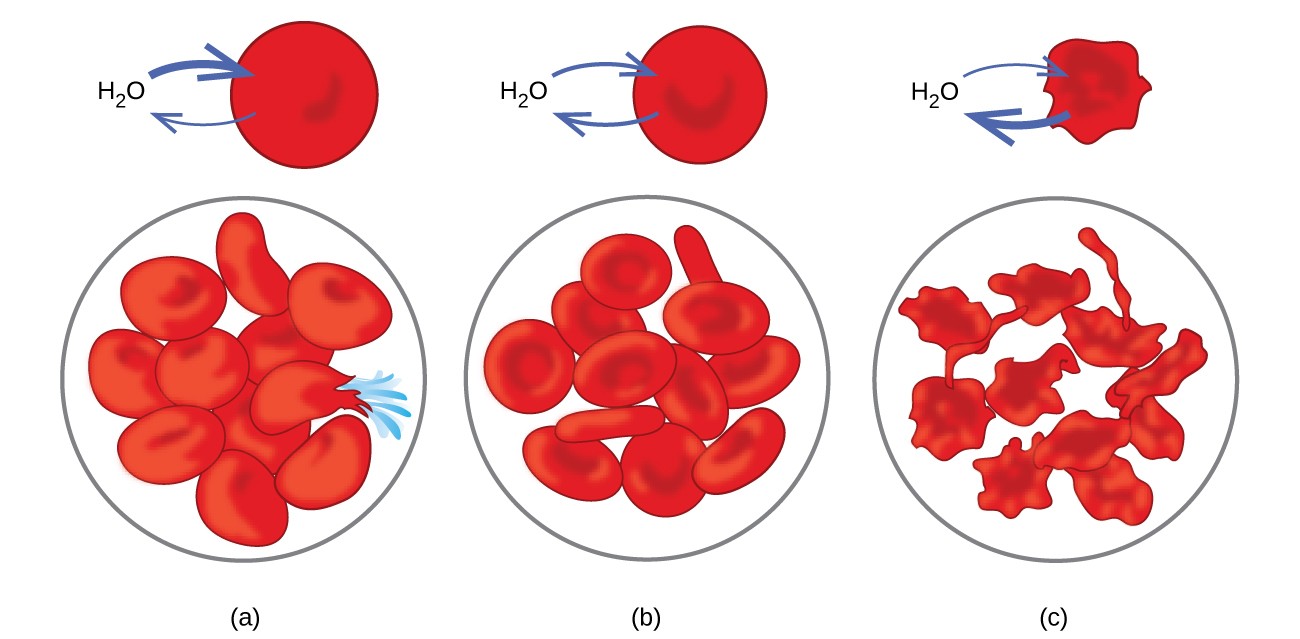
Figur 10. Røde blodlegemer er vanngjennomtrengelige og vil (a) hovne opp og muligens sprekke i en hypoton løsning; (b) opprettholde normalt volum og form i en isoton løsning; og (c) skrumpe sammen og muligens dø i en hypertonisk løsning. (kreditt a / b / c: modifikasjoner av verk av «LadyofHats» / Wikimedia commons)
Bestemmelse av molmasser
Osmotisk trykk og endringer i frysepunkt, kokepunkt punkt, og damptrykk er direkte proporsjonal med konsentrasjonen av løsemiddel som er tilstede. Derfor kan vi bruke en måling av en av disse egenskapene for å bestemme molarmassen av løsemidlet fra målingene.
Kolligative egenskaper til elektrolytter
Som nevnt tidligere i denne modulen, avhenger de kolligative egenskapene til en løsning bare av antallet, ikke av identiteten, av oppløste arter oppløst. Konsentrasjonsbetingelsene i ligningene for forskjellige kolligative egenskaper (frysepunktdepresjon , kokepunktforhøyelse, osmotisk trykk) gjelder alle oppløste arter som er tilstede i løsningen. For løsningene som hittil er vurdert i dette kapittelet, har de oppløste stoffene vært ikke-elektrolytter som oppløses fysisk uten dissosiasjon eller annen tilhørende prosess. le som oppløser gir ett oppløst oppløst molekyl. Oppløsningen av en elektroyte er imidlertid ikke så enkel, som illustrert av de to vanlige eksemplene nedenfor:
Med tanke på det første av disse eksemplene, og antar fullstendig dissosiasjon, inneholder en 1,0 m vandig løsning av NaCl 2,0 mol ioner (1,0 mol Na + og 1.0 mol Cl−) per kilo vann, og frysepunktets depresjon forventes å være
Når denne løsningen faktisk fremstilles og dens nedfrysing måles, oppnås imidlertid en verdi på 3,4 ° C. Lignende avvik er observert for andre ioniske forbindelser, og forskjellene mellom de målte og forventede verdiene for kolligasjonsegenskapene blir vanligvis mer signifikante når konsentrasjonen av løsemiddel øker. Disse observasjonene antyder at ionene av natriumklorid (og andre sterke elektrolytter) ikke er fullstendig dissosiert i løsningen.
For å redegjøre for dette og unngå feilene som følger med antagelsen om total dissosiasjon, er en eksperimentelt målt parameter oppkalt ære for den nobelprisvinnende tyske kjemikeren Jacobus Henricus van’t Hoff brukes. Van’t Hoff-faktoren (i) er definert som forholdet mellom oppløste partikler i oppløsning og antall oppløste formelenheter:
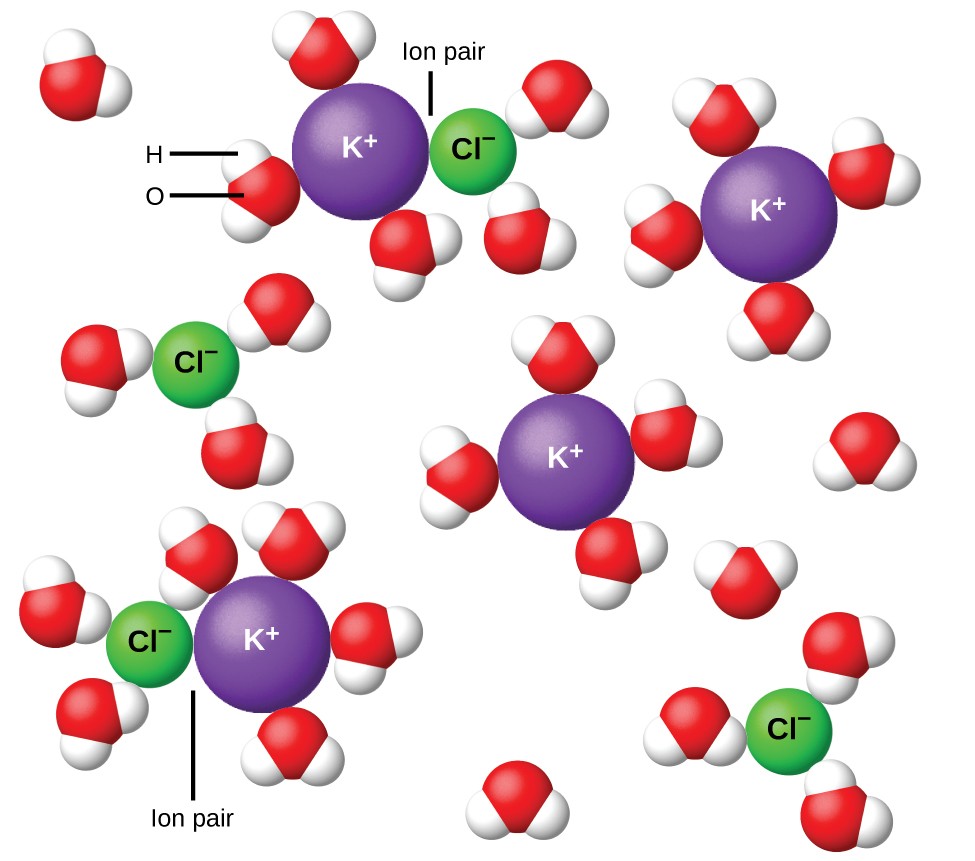
Figur 11. Ioner skilles mer og mer ut, jo mer fortynnet løsningen, og de gjenværende interioniske attraksjonene blir mindre.
I 1923 foreslo kjemikerne Peter Debye og Erich Hückel en teori for å forklare den tilsynelatende ufullstendige ioniseringen av sterke elektrolytter. De antydet at selv om interionisk tiltrekning i en vandig løsning reduseres veldig kraftig ved oppløsningen av ionene og den isolerende virkningen av det polære løsningsmidlet, blir den ikke fullstendig opphevet. De gjenværende attraksjonene hindrer ionene i å oppføre seg som helt uavhengige partikler (figur 11). I noen tilfeller kan et positivt og negativt ion faktisk berøre, noe som gir en solvatisert enhet kalt et ionepar. Dermed er aktiviteten eller den effektive konsentrasjonen av en hvilken som helst spesiell type ion mindre enn den som er angitt av den faktiske konsentrasjonen. Ioner blir mer og mer skilt ut jo mer fortynnet løsningen, og de gjenværende interioniske attraksjonene blir mindre og mindre. I ekstremt fortynnede løsninger er de effektive konsentrasjonene av ionene (deres aktiviteter) i det vesentlige like de faktiske konsentrasjonene. Vær oppmerksom på at van’t Hoff-faktorene for elektrolyttene i tabell 2 er for 0,05 m løsninger, hvor konsentrasjonen verdien av i for NaCl er 1,9, i motsetning til en ideell verdi på 2.
Eksempel 11: Frysepunktet for en løsning av en elektrolytt
Konsentrasjonen av ioner i sjøvann er omtrent den samme som i en løsning som inneholder 4,2 g NaCl oppløst i 125 g vann. Anta at hvert av ionene i NaCl-løsningen har samme effekt på vannets frysepunkt som et ikke-elektrolyttmolekyl, og bestem frysetemperaturen løsningen (som er omtrent lik frysetemperaturen for sjøvann).
Sjekk din læring
Anta at hvert av ionene i kalsiumklorid, CaCl2, har samme effekt på frysepunktet for vann som et ikke-elektrolyttmolekyl. Beregn frysepunktet for en løsning av 0,724 g CaCl2 i 175 g vann.
Prøv det
- Kjøtt kan klassifiseres som ferskt (ikke frossent) selv om det er lagret på −1 ° C. Hvorfor skulle ikke kjøtt fryse ved denne temperaturen?
- En organisk forbindelse har en sammensetning på 93,46% C og 6,54% H i masse. En løsning av 0,090 g av denne forbindelsen i 1,10 g kamfer smelter ved 158,4 ° C. Smeltepunktet for ren kamfer er 178,4 ° C. Kf for kamfer er 37,7 ° C / m. Hva er molekylformelen til det oppløste stoffet? Vis beregningene dine.
- Et salt er kjent for å være et alkalimetallfluorid. En rask tilnærmet bestemmelse av frysepunktet indikerer at 4 g av saltet oppløst i 100 g vann produserer en løsning som fryser ved omtrent -1,4 ° C. Hva er saltformelen? Vis beregningene dine.
Ordliste
aktivitet: effektiv konsentrasjon av ioner i løsning; den er lavere enn den faktiske konsentrasjonen på grunn av ioniske interaksjoner.
Kokepunkthøyde: høyde av kokepunktet til en væske ved tilsetning av en oppløsningsmiddel
Kokepunktets høydekonstant: proporsjonalitetskonstant i ligningen som relaterer kokepunktet til loddet molalitet; også kjent som den ebullioskopiske konstanten
kolligativ egenskap: egenskapen til en løsning som bare avhenger av konsentrasjonen av en løst art
crenering: prosess der biologiske celler blir skrumpet på grunn av tap av vann ved osmose
frysepunktdepresjon: senking av frysepunktet for en væske ved tilsetning av en oppløsningsmiddel
frysepunktet depresjonskonstant: (også kryoskopisk konstant) proporsjonalitetskonstant i ligningen frysepunktdepresjon for å oppløse molalitet
hemolyse: brudd på røde blodlegemer på grunn av akkumulering av overflødig vann ved osmose
hypertonisk: med større osmotisk trykk
hypotonisk : med mindre osmotisk trykk
ionpar: solvatisert anion / kationpar holdt sammen av moderat elektrostatisk tiltrekning
isotonisk: med like osmotisk trykk
molalitet (m) : en konsentrasjonsenhet definert som forholdet mellom antall mol oppløst stoff og massen av løsningsmidlet i kg
molfraksjon (X): forholdet mellom molmengden til en løsningskomponent og det totale antall mol av alle løsningskomponentene
osmose: diffusjon av løsemiddelmolekyler gjennom en semipermeabel membran
osmotisk trykk (Π ): motsatt trykk som kreves for å forhindre bulkoverføring av løsemiddelmolekyler gjennom en semipermeabel membran
Raoults lov: det delvise trykket som utøves av en løsningskomponent er lik produktet av komponentens molfraksjon i løsningen og dens likevekt damptrykk i ren tilstand
semipermeabel membran: en membran som selektivt tillater passering av visse ioner eller molekyler
van’t Hoff-faktor (i): forholdet mellom antall mol av partikler i en løsning til antall mol med formelenheter oppløst i løsningen
- En ikke-elektrolytt vist for sammenligning. ↵

