Denne teknikken ble utviklet på slutten av 1980-tallet og er en kraftig metode for å oppdage translokasjoner (omorganiseringer blant kromosomer).
For utvikling av FISH var det nødvendig å isolere hvert menneskelig kromosom. Deretter ble DNA fra disse kromosomene fragmentert og satt i bakterieceller for å amplifisere det (produsere mange kopier). På denne måten kan det oppnås et stort antall kopier av DNA fra hvert kromosom.
Disse amplifiserte DNA-fragmentene er merket med passende fluorescerende (lysemitterende) fargestoffer og får lov til å hybridisere (feste) til metafasekromosomer . De fluorescerende merkede DNAene vil feste seg til de analoge kromosomene de ble avledet fra. (DNA-fragmenter med samme basesekvenser har karakteristikken for å feste seg til hverandre.)
På denne måten, hvis en del av et malt kromosom (for eksempel gult) hadde gjennomgått en utveksling med et annet, ikke -malte kromosomer (farget rødt), er det mulig å oppdage aberrasjonen (betegnet som en gjensidig translokasjon) fordi det avvikende kromosomet inneholder både gule og røde segmenter. Vanligvis kan et par tofargede kromosomer påvises i en metafase fordi to kromosomer vanligvis utveksler en del av deres DNA.
Gjensidige translokasjoner er vanskelig å oppdage ved enkel farging av hele settet med kromosomer med en enkelt materiale, for eksempel med Giemsa. Tenk deg for eksempel en sak som de to utvekslede segmentene hadde samme lengder med. De to translokerte kromosomene skal virke helt normale, både i form og lengde. Hvis vi bruker FISH, kan en slik translokasjon imidlertid oppdages tydelig.
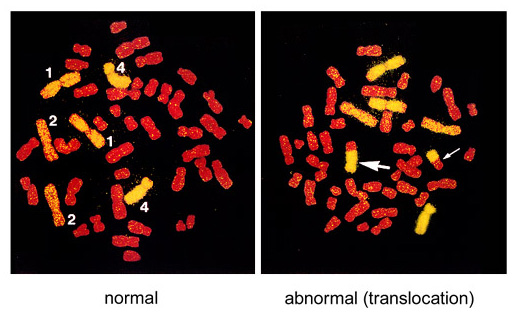
Figur. Et eksempel på FISH-behandlede metafasekromosomer
Her ble kromosomene 1, 2 og 4 merket gule med FISH og de andre kromosomene ble farget rødt. Translokasjoner mellom gule og røde kromosomer oppdages. Det venstre bildet representerer en normal celle (tallene i figuren indikerer kromosomtall) og det høyre bildet er et eksempel på gjensidig translokasjon med to bi-fargede kromosomer (indikert med to piler).