Når du ser det periodiske systemet, hva kommer du til å tenke? Brikkene på et skrapbrett? Kanskje du tenker på kjemiklassen din på videregående skole. Kanskje du tenker på det fargerike bordet pusset på veggen til en forelesningssal på college. Kanskje du husker at favorittlæreren din fyrte på noe foran klasserommet. Jeg er assisterende professor i kjemi ved University of Richmond, og når jeg hører uttrykket «det periodiske systemet», tenker jeg på livet.
Jeg tenker på hvordan molekylene og kjemikaliene som omgir oss og dikterer hverdagen vår. aktiviteter består av elementene på bordet – de opprettholder livet vårt, de gir skjønnhet til verden og de er viktige i medisin.
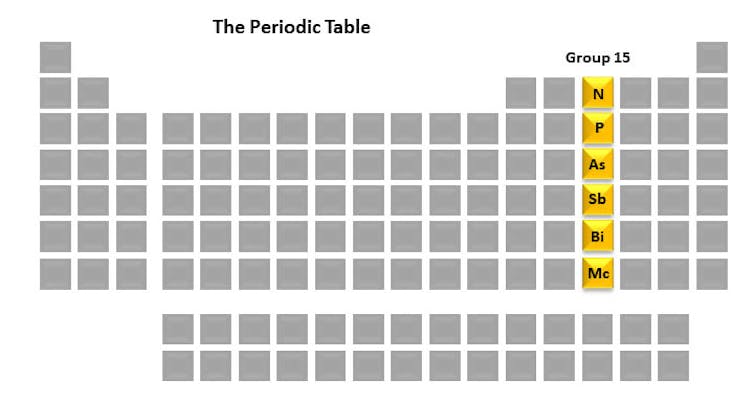
Hver kolonne i det periodiske systemet kalles en gruppe. Hvert medlem av gruppen har et lignende arrangement av elektroner som kan resultere i lignende kjemiske egenskaper. Gruppe 15-elementene – nitrogen, fosfor, arsen, antimon, vismut og moscovium – er interessante for meg på grunn av deres viktigste rolle i livet, så vel som i forskningslaboratoriet mitt. Et element vi studerer er fosfor på grunn av dens integrerte rolle i skjebnen til celler.
Men før vi kommer inn på disse detaljene, la oss ta en kort titt på hver av gruppe 15-elementene. De er et unikt sett i sin historie, bruk og egenskaper.
Gruppe 15 – å gi liv og forårsake død
Nitrogen (N) i sin atmosfæriske form (N₂) utgjør omtrent 78% av luften vi puster inn. Når bakterier som lever i planterøtter omdanner den til en brukbar form gjennom en prosess som kalles nitrogenfiksering, blir denne elementære formen av nitrogen innlemmet i mange forbindelser som er nødvendige for livet – for eksempel proteiner og DNA. Nederst i kolonnen er Moscovium (Mc), som er interessant fordi det ikke egentlig eksisterer i naturen. Det er et radioaktivt element som bare kan genereres i et laboratorium og som overlever i mindre enn et sekund.
Arsen (As) kan være kjent for deg på grunn av dets tilknytning til forgiftninger. I 1494 ble Pico della Mirandola, en italiensk humanistisk filosof under renessansen, forgiftet av arsen, selv om detaljene rundt hans tidlige død fortsatt diskuteres. I lang tid ble det antatt at Napoleon Bonaparte døde av arseneksponering i 1821, men etter omfattende sammenligninger av konserverte hårprøver fra forskjellige stadier i livet, konkluderte forskerne med at de økte nivåene av arsen mest sannsynlig skyldtes bevaringsteknikker fra den tiden. Mer nylig estimerte Verdens helseorganisasjon arsenforurenset drikkevann i Bangladesh til over 9000 dødsfall i 2001. Hvordan arsen gift og drap ikke er helt forstått, men det er ingen tvil om at elementet forårsaker ødeleggelse av vitale organer i menneskene. kropp.

Når elementet antimon (Sb) kombineres med tre oksygenatomer for å danne antimontrioksid, brukes det mye som et flammehemmende middel til møbler, tepper , gardiner, gummi, plast og lim. Mengden av dette molekylet i disse husholdningsproduktene pleier å være veldig liten, og disse nivåene av antimon blir ansett som trygge.
Vismut (Bi) er et metall som finnes i samme rad i det periodiske systemet som et antall giftige metaller; forbindelser som inneholder vismut er imidlertid ufarlige. Vismutforbindelser kan finnes i kosmetikk på grunn av deres særegne og ønskelige sølvfargede glans. Selv om du ikke har brukt vismutholdige produkter for personlig pleie, har du sannsynligvis møtt det i det velkjente antacida Peptobismol®, som brukes til å behandle urolig mage, eller den fjerde juli når du ser på fyrverkeri. Det er en vismutforbindelse som forårsaker knitrende lydene fra dragenegg fyrverkeri.
Sist, men ikke minst, av elementene i gruppe 15 er fosfor (P). Den ble oppdaget i 1669 av alkymisten Hennig Brandt og oppkalt fra det greske ordet «fosfor», som betyr lysbringer. Det er fordi når elementformen samhandler med atmosfærisk oksygen, gir den et strålende lys. Kjemikere fant ut hvordan man kunne utnytte kraften til denne reaksjonen for utvikling av fyrstikker. Det røde spissen på en fyrstikk inneholder fortsatt en form for fosfor i dag.
Fosfater – regulerer kreftcelleskjebnen
I tillegg til gnister generert av elementet , fosfor finnes i en forbindelse kjent som fosfat: fosfor bundet til fire oksygenatomer.Når et fosfatmolekyl er festet til et protein i celler, kan det slå på eller aktivere proteinet slik at det kan utføre sin funksjon i cellen – som stimulerende vekst.
Når fosfatet ikke lenger er festet til proteinet, slutter cellene å vokse. Du kan tenke på det nesten som fyrstikkene beskrevet ovenfor – når fosfatet er der, kan fyrstikket antennes og virksomheten kan fortsette. Når fosfatet fjernes, er fyrstikket bare en pinne og det gis ikke noe lys; ikke så mye arbeid kan skje i mørket.
I kreftceller er fosfatstatusen ute av kontroll. Se for deg mange tente fyrstikker og et veldig lyst rom som kan resultere i en strøm av aktivitet. Denne aktiviteten kan ha alvorlige konsekvenser for celler. For eksempel kan uregulert vekst og migrasjon føre til kreft.
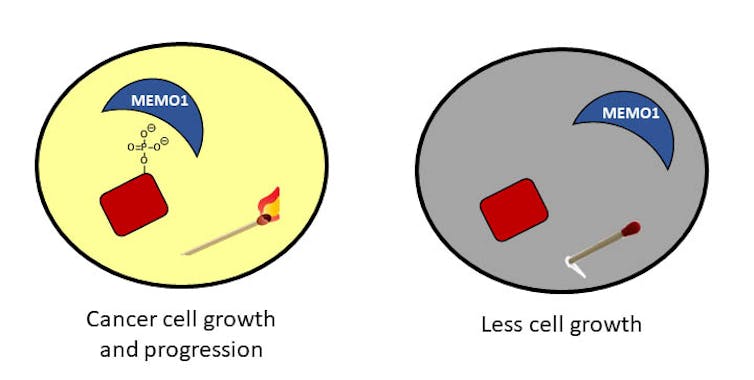
I laboratoriet mitt ved University of Richmond er vi interessert i å forstå disse fosfater og spesielt ett protein som samhandler med dem. Dette proteinet, kalt MEMO1, finnes i store mengder hos brystkreftpasienter og hjelper fosfatene til alltid å holde seg knyttet til proteiner. Vi prøver å forstå hvordan MEMO1 samhandler med disse fosfatene og utvikler strategier for å forstyrre disse interaksjonene.
Vi håper at vårt arbeid avslører en måte å bidra til å fjerne fosfater for å stoppe ukontrollert vekst av celler – med andre ord, for å blåse ut fyrstikkene.
Så neste gang du hører ordene «periodisk tabell», vær så snill å tenk på livet. Tenk på molekylene du møter hvert øyeblikk hver dag, tenk på medisinen som holder deg frisk og tenk på de av oss som jobber for å forstå hvordan du holder deg på den måten .