- Tilstedeværelsen av høye konsentrasjoner av antistoffer (titer > 1: 640) burde gjøre en mistenksom på at en autoimmun lidelse er tilstede. I dette scenariet anbefaler jeg at sera deretter testes for antistoffer mot dsDNA, Sm, RNP, Ro (SS-A), La (SS-B) og kanskje Scl-70. Tilstedeværelsen av antistoffer mot noen av disse øker sannsynligheten for at pasienten har SLE, MCTD, Sjögrens eller sklerodermi. Noen laboratorier vil automatisk teste for disse antistoffene når screening ANA er positiv. Imidlertid er tilstedeværelsen av disse antistoffene ikke diagnostisk med sykdommer. Hvis ingen innledende diagnose kan stilles, er det min praksis å følge pasienten nøye over tid for utvikling av en ANA-assosiert sykdom, og se pasienten minst to ganger årlig.
- Kombinasjonen av lave titere av antistoff (< 1:80) og ingen eller få tegn eller symptomer på sykdom antyder en mye mindre sannsynlighet for en autoimmun sykdom. Som et resultat, må disse pasientene med lave ANA-titere vurderes sjeldnere – hvert år med mindre kliniske symptomer utvikler seg til å antyde en autoimmun sykdom.
- En pasient med negativ ANA er høyst usannsynlig å ha enten SLE, MCTD , Sjögrens eller sklerodermi. Imidlertid, hvis det fremdeles er sterke kliniske bevis for en systemisk autoimmun lidelse, kan man teste for de spesifikke antistoffene mot dobbeltstrenget (ds) DNA, Sm, RNP, Ro, La eller Scl-70, selv om, etter min erfaring, de er vanligvis negative. Ikke desto mindre er det forsvarlig å se slike pasienter der det er høy klinisk mistankeindeks, i hvert fall årlig – selv om hyppigere hvis klinisk indikert.
- Antinukleære antistoffer produserer et bredt spekter av fargemønstre (homogen, diffus , perifer, kant, flekkete, nucleolar, anticentromere, etc.). Det kjernefysiske fargemønsteret har blitt anerkjent for å ha relativt lav følsomhet og spesifisitet for forskjellige autoimmune lidelser. Tilstedeværelsen av antistoffer rettet mot spesifikke kjernefysiske antigener er vanligvis mer nyttig. (Disse antistoffene inkluderer følgende: dsDNA, Sm, RNP, Ro, La eller Scl-70.)
I løpet av de siste årene har etterforskere og bioteknologiske firmaer utviklet fast fase immunanalyser for å erstatte IF ANA-testen.4-23 Begrunnelsen bak dette forsøket knytter seg til IF-teknikkens ytelsesegenskaper. Denne testen er veldig arbeidskrevende og kan variere på grunn av forskjellige tolkninger av teknikere. Også kompliserende testing er falming av bildet når det blir undersøkt i et fluorescerende mikroskop. Videre bruker IF-teknikken seriefortynninger av pasientsera, som vil gi resultater som kanskje ikke er lineære. Variasjoner i titer to ganger er vanlige i daglige tester på samme prøve; fire ganger forskjeller sies å være «signifikante.» Derimot er fastfase-immunoanalyser automatiserte og svært reproduserbare. Resultatene er lineære, og teknikken er mindre arbeidskrevende og dermed billigere å utføre.
På grunn av disse hensynene bør det være økonomiske besparelser i ved å anvende en fastfase-immunanalyse for å kvantifisere en ANA. Således, i et forsøk på å utvikle fastfase-ANA-immunoanalyser, har et antall grupper lagt på den faste fasen hva antigener som helst blir analysert i de mer spesifikke ANA-immunoanalysene (f.eks. Sm, RNP, Ro / SSA, La / SSB, nukleoprotein, celleekstrakter, etc.). I publiserte rapporter er korrelasjonskoeffisienten mellom ANA-titere og disse fastfase-analysene ganske god. Dermed har mange kommersielle firmaer byttet ANA-er til disse fastfase-immunanalysene.4-23. Men bekymringsfullt er den høye frekvensen / prosentandelen av falske negative resultater hos pasienter med kjent SLE og relaterte sykdommer, samt den fortsatt høye frekvensen av «falske positive» (f.eks. en positiv ANA hos noen uten SLE) i disse studiene. 15-21 Det er behov for ytterligere arbeid for å forbedre følsomheten og spesielt spesifisiteten til disse fastfase-immunanalysene for å sikre at pasienter med SLE og relaterte sykdommer ikke blir savnet av disse fastfase-immunanalysene. >
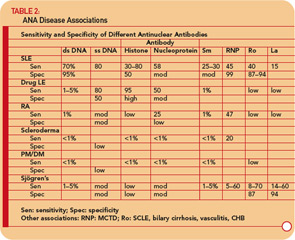
Antistoffer mot DNA
Antistoffer mot DNA kan primært deles i de som reagerer med enkeltstrenget (ss) DNA og de som gjenkjenner dsDNA.24-26
Anti- ssDNA-antistoffer er rapportert i SLE, revmatoid artritt, medikamentrelatert lupus, friske slektninger til pasienter med SLE, og, sjeldnere, ved andre revmatiske sykdommer. (Se tabell 2, s. 17.) Således har anti-ssDNA begrenset nytte for diagnosen SLE eller andre revmatiske sykdommer. Anti-ssDNA korrelerer ikke godt med sykdomsaktivitet og er derfor ikke nyttige for sykdomsadministrasjon.
Antistoffer mot dsDNA oppdages hyppigst ved fastfase-immunanalyser, men også i noen laboratorier ved crithidia IF-analysen eller av og til Farr radioimmunoassay.De fleste sykehus- og kommersielle laboratorier gjør bare ett. Farr-analysen har sannsynligvis den høyeste spesifisiteten og den laveste følsomheten av de tre analysene for diagnostisering av SLE, mens fast-fase-analysene har den høyeste følsomheten og laveste spesifisitet; krithidia-analysen faller mellom. Farr-analysen har også ulempen med å bruke radioaktivt materiale, som de fleste laboratorier skyr, og crithidia-testen er veldig arbeidskrevende. Jeg foretrekker ELISA-analysen til daglig bruk.
Anti-dsDNA er spesifikke (95%), men ikke veldig følsomme (70%) for SLE, noe som gjør dem veldig nyttige for diagnose når de er positive.9 (Se tabell 2 , s. 17.) De finnes av og til under andre forhold, inkludert revmatoid artritt, juvenil artritt, medikamentindusert lupus, autoimmun hepatitt og til og med hos normale personer.
Titere på anti-dsDNA-antistoffer svinger ofte med sykdomsaktivitet, spesielt lupus nefritt, og er derfor nyttige hos mange pasienter for å følge løpet av SLE. Hvis en pasient har en stigende titer, eller veldig høy titer, men klinisk er i ro, behandler jeg ikke den serologiske abnormiteten, men anser det som et advarselstegn om at pasienten må følges nærmere og behandles når noe skjer klinisk for å berettige endring i terapi. Noen etterforskere har imidlertid behandlet disse serologiske abnormitetene (spesielt når de er forbundet med lave komplementnivåer) og har rapportert forbedrede kliniske resultater. Motsatt bruker jeg en fallende titer hos noen som blir bedre etter bluss på behandlingen som en guide for å redusere behandlingen (f.eks. Kortikosteroider og / eller immunsuppressiva).
Sammenhengen mellom anti-dsDNA-antistoffer og andre sykdomsmanifestasjoner av SLE er langt mindre tydelig. For eksempel er det ingen sammenheng mellom anti-dsDNA titer og sykdomsaktivitet av nevropsykiatrisk SLE.
Å skille aktiv lupus manifestasjoner fra smittsomme komplikasjoner eller toksiske effekter av medikamenter – og fra ikke-relatert sykdom – er alltid en utfordring. Tilstedeværelsen av anti-dsDNA-antistoffer kan være nyttig for noen pasienter i å gjøre dette skillet.
Anti-Smith og Anti-Ribonukleoprotein-antistoffer
Antistoffer mot Smith (Sm) og anti-ribonukleoprotein (anti-RNP) oppdages hyppigst ved fastfase-immunanalyser. 24,27
Anti-Sm-antistoffer finnes hos bare 10% til 40% av pasientene med SLE, men er svært sjeldne hos pasienter med andre forhold (dvs. de er ikke følsomme, men er svært spesifikke). Måling av anti-Sm-titere kan være nyttig diagnostisk, spesielt på et tidspunkt når anti-DNA-antistoffer ikke kan påvises. Gitt den relativt lave følsomheten til anti-Sm, utelukker imidlertid en negativ verdi på ingen måte diagnosen SLE.
Anti-RNP-antistoffer finnes hos omtrent 40% til 60% av pasientene med SLE, men er ikke spesifikke for SLE, fordi de er en definerende funksjon i MCTD. Disse antistoffene kan også forekomme i lave titre og lave frekvenser i andre revmatiske sykdommer, inkludert RA og sklerodermi. (Se tabell 2, s. 17.)
Verken titer (nivåer) av anti-Sm eller anti-RNP-antistoffer korrelerer med noen klinisk aktivitet.
Anti-Ro / SSA og Anti-La / SSB-antistoffer
Antistoffer mot Ro / SSA og La / SSB oppdages hyppigst ved fastfase-immunanalyser.28,29 Anti-Ro / SSA og anti-La / SSB er blitt påvist i høy frekvens hos pasienter med Sjögrens syndrom og i SLE, men også hos pasienter med lysfølsom dermatitt, og hos 0,1% til 0,5% av friske voksne.
Anti-Ro / SSA-antistoffer finnes hos ca. 50% av pasienter med SLE. (Se tabell 2, s. 17.) De har vært assosiert med lysfølsomhet, subakutt kutan lupus, kutan vaskulitt (palpabel purpura), interstitiell lungesykdom, nyfødt lupus og medfødt hjerteblokk. Anti-Ro / SSA-antistoffer finnes hos omtrent 75% av pasientene med primært Sjögrens syndrom (se tabell 2, s. 17), og høye titere av disse antistoffene er assosiert med en større forekomst av ekstra kjertelegenskaper, spesielt purpura og vaskulitt. Derimot er Ro / SSA-antistoffer tilstede hos bare 10% til 15% av pasientene med sekundært Sjögrens syndrom assosiert med revmatoid artritt. Derfor støtter tilstedeværelsen av Ro / SSA- eller anti-La / SSB-antistoffer hos pasienter med mistanke om primært Sjögrens syndrom diagnosen.
Omtrent 50% av pasientene med SLE som har anti-Ro-antistoff har også anti -La antistoff, et nært beslektet RNA-protein antigen. Tilsvarende har de fleste pasienter med Sjögrens syndrom også anti-La (SSB) antistoffer. Det er svært sjelden å finne pasienter med anti-La-antistoffer uten anti-Ro-antistoffer.
Etter min mening er indikasjonene for å bestille en anti-Ro / SSA og anti-La / SSB antistofftest som følger:
- Kvinner med SLE som er gravide eller kan bli gravid i fremtiden;
- Kvinner som har en historie med å føde et barn med hjerteblokk eller myokarditt;
- Pasienter med en historie med uforklarlige lysfølsomme hudutbrudd;
- Pasienter sterkt mistenkt for å ha SLE, men som har en negativ ANA-test; eller
- Pasienter med symptomer på xerostomi, keratokonjunktivitt sicca og / eller spytt- og tårekjertelforstørrelse.
Antiribosomalt P-proteinantistoffer
Anti- ribosomale P-proteinantistoffer er påvist hos 10% til 20% av pasientene med SLE i USA og 40% til 50% av asiatiske pasienter med SLE, men sjelden i andre revmatiske sykdommer. 30 Anti-ribosomalt P-proteinantistoffer kan være svært spesifikk for lupusassosiert psykose, selv om ikke alle studier har bekreftet dette. Depresjon og nyre- og leverinvolvering hos pasienter med lupus har også vært assosiert med anti-ribosomalt P-proteinantistoffer i noen små studier.
På grunn av lav følsomhet og dårlig klinisk korrelasjon, ser mange etterforskere – inkludert meg selv – se liten klinisk brukbarhet i denne testen.
Antisentromere antistoffer
Antisentromere antistoffer (ACAer) finnes nesten utelukkende hos pasienter med begrenset kutan systemisk sklerose (lcSSc), spesielt hos de med CREST.31 ACA er observert hos 57% av pasientene med CREST, men har også blitt sett hos pasienter med andre tilstander, inkludert hos noen pasienter med Raynauds fenomen alene. ACA oppdages vanligvis av det karakteristiske IF-mønsteret på Hep-2-celler.
Anti – Scl-70 (topoisomerase-1) Antistoffer
Omtrent 15% til 20% av pasientene med sklerodermi har antistoffer mot et 70 kd protein (topoisomerase-1), senere kalt Scl-70.31. Den vanlige metoden for påvisning er ved ELISA. Tilstedeværelsen av disse antistoffene ser ut til å øke risikoen for lungefibrose hos pasienter med sklerodermi og er ganske spesifikk for sykdommen.
Oppsummering
Hvis man mistenker SLE basert på historien, fysisk og fullstendig blodtelling (f.eks leukopeni, trombocytopeni), be om en ANA-test. Hvis det er negativt, er det svært lite sannsynlig at pasienten har SLE, og pasienten kan bli beroliget. Hvis titeren er < 1: 160, er SLE usannsynlig, og pasienten kan forsikres om at SLE er usannsynlig, men pasienten bør følges med jevne mellomrom. En titer på ≥1: 160 øker sannsynligheten for SLE og relaterte lidelser. Det er imidlertid viktig å huske at 85% av individer med positiv ANA ikke har SLE. Hvis ANA er positiv, bør man også teste for antistoffer mot dsDNA, Sm, RNP, Ro / SSA og La / SSB. Tilstedeværelsen av disse antistoffene øker sannsynligheten for at pasienten har SLE og relaterte lidelser (se Tabell 2, s. 17), og pasienten må følges nærmere. Deteksjonen av antisentromere og anti-Scl-70 antistoffer er veldig nyttig for diagnostisering av sklerodermi. Påvisning av antistoffer mot Ro / SSA og La / SSB er også nyttige for diagnosen Sjögrens syndrom.
Den eneste av disse testene som er nyttige for å overvåke aktivitet er anti-dsDNA.
Anerkjennelse: Jeg er takket være arbeidet til mange forfattere av UpToDate in Medicine, hvis arbeid ga en nyttig ramme for utviklingen av denne artikkelen, samt til Dr. Robert Shmerling, David Lee og Donald Bloch, som jeg har skrevet artikler og kapitler med om dette samme emnet.
Dr. Schur er professor i medisin ved Harvard Medical School og divisjonen for revmatologi, immunologi og allergi ved medisinsk avdeling ved Brigham and Women’s Hospital i Boston.
- Reichlin M. Måling og klinisk betydning av antinukleære antistoffer. Oppdatert. Oktober 2008.
- American College of Rheumatology Ad Hoc Committee on Immunologic Testing Guidelines. Retningslinjer for immunologisk laboratorietesting ved revmatiske sykdommer: En introduksjon. Leddgikt. 2002; 47: 429-433.
- Solomon DH, Kavanaugh AJ, Schur PH, et al. Bevisbaserte retningslinjer for bruk av immunologiske tester: Antinukleær antistofftesting. Leddgikt. 2002; 47: 434-444.
- Sinclair D, Saas M, Williams D, Hart M, Goswami R. Kan en ELISA erstatte immunfluorescens for påvisning av anti-nukleære antistoffer? – Den rutinemessige bruken av anti ELISAs for screening av atomantistoffer. Clin Lab. 2007; 53: 183-191.
- Avaniss-Aghajani E, Berzon S, Sarkissian A. Klinisk verdi av multipleksede perlebaserte immunanalyser for påvisning av autoantistoffer mot kjernefysiske antigener. Clin Vaccine Immunol. 2007; 14: 505-509.
- Copple SS, Martins TB, Masterson C, Joly E, Hill HR. Sammenligning av tre multipleksede immunanalyser for påvisning av antistoffer mot ekstraherbare nukleære antistoffer ved bruk av klinisk definerte sera. Ann N Y Acad Sci.2007; 1109: 464-472.
- Caramaschi P, Ruzzenente O, Pieropan S, et al. Bestemmelse av ANA-spesifisitet ved bruk av multiplekset fluorescerende mikrokuleimmunoanalyse hos pasienter med ANA-positivitet ved høye titre etter infliximab-behandling: Foreløpige resultater. Rheumatol Int. 2007; 27: 649-654.
- Biagini RE, Parks CG, Smith JP, Sammons DL, Robertson SA. Analytisk ytelse av AtheNA MultiLyte ANA II-analysen i sera fra lupuspasienter med flere positive ANAer. Anal Bioanal Chem. 2007; 388: 613-618.
- Gonzalez C, Garcia-Berrocal B, Perez M, et al. Laboratoriescreening av bindevevssykdommer ved en ny automatisert ENA-screeninganalyse (EliA Symphony) hos klinisk definerte pasienter. Clin Chim Acta. 2005; 359: 109-114.
- Eissfeller P, Sticherling M, Scholz D, et al. Sammenligning av forskjellige testsystemer for samtidig påvisning av autoantistoffer ved bindevevssykdommer. Ann N Y Acad Sci. 2005; 1050: 327-339.
- Smith J, Onley D, Garey C, et al. Bestemmelse av ANA-spesifisitet ved bruk av UltraPlex-plattformen. Ann N Y Acad Sci. 2005; 1050: 286-294.
- Martins TB, Burlingame R, von Muhlen CA, et al. Evaluering av multiplekset fluorescerende mikrosfære immunoanalyse for påvisning av autoantistoffer mot kjernefysiske antigener. Clin Diagn Lab Immunol. 2004; 11: 1054-1059.
- Bernardini S, Infantino M, Bellincampi L, et al. Screening av antinukleære antistoffer: Sammenligning mellom enzymimmunoanalyse basert på kjernefysiske homogenater, rensede eller rekombinante antigener og immunfluorescensanalyse. Clin Chem Lab Med. 2004; 42: 1155-1160.
- Nossent H, Rekvig OP. Antinukleært antistoff-screening i dette nye årtusenet: Farvel til mikroskopet? Scand J Rheumatol. 2001; 30: 123-126; diskusjon 127-128.
- Lopez-Hoyos M, Rodriguez-Valverde V, Martinez-Taboada V. Utførelse av antinukleært antistoff bindevevssykdomsskjerm. Ann N Y Acad Sci. 2007; 1109: 322-329.
- Ghillani P, Rouquette AM, Desgruelles C, et al. Evaluering av LIAISON ANA-skjermanalyse for antinukleært antistofftesting ved autoimmune sykdommer. Ann N Y Acad Sci. 2007; 1109: 407-413.
- Bonilla E, Francis L, Allam F, et al. Immunfluorescensmikroskopi er bedre enn fluorescerende perler for påvisning av antinukleært antistoffreaktivitet hos pasienter med systemisk lupus erytematose. Clin Immunol. 2007; 124: 18-21.
- Nifli AP, Notas G, Mamoulaki M, et al. Sammenligning av en multiplex, perlebasert fluorescerende analyse og immunfluorescensmetoder for påvisning av ANA og ANCA autoantistoffer i humant serum. J Immunol Methods. 2006; 311: 189-197.
- Shovman O, Gilburd B, Zandman-Goddard G, et al. Multiplexed AtheNA multi-lyte immunoassay for ANA screening in autoimmune sykdommer. Autoimmunitet. 2005; 38: 105-109.
- Ulvestad E. Ytelsesegenskaper og klinisk nytte av en hybrid ELISA for påvisning av ANA. Apmis. 2001; 109: 217-222.
- Olaussen E, Rekvig OP. Screeningtester for antinukleære antistoffer (ANA): Selektiv bruk av sentrale kjernefysiske antigener som et rasjonelt grunnlag for screening ved ELISA. J Autoimmun. 1999; 13: 95-102.
- Homburger HA, Cahen YD, Griffiths J, Jacob GL. Påvisning av antinukleære antistoffer: Sammenlignende evaluering av enzymimmunoanalyse og indirekte immunfluorescensmetoder. Arch Pathol Lab Med. 1998; 122: 993-999.
- Gniewek RA, Stites DP, McHugh TM, Hilton JF, Nakagawa M. Sammenligning av antinukleære antistoff-testmetoder: Immunofluorescensanalyse versus enzymimmunoanalyse. Clin Diagn Lab Immunol. 1997; 4: 185-188.
- Reichlin M. Antistoffer mot DNA, SM og RNP. Oppdatert. Oktober 2008.
- Hahn BH. Antistoffer mot DNA. Nye Engl J Med. 1998; 338: 1359.
- Kavanaugh AF, Solomon DH, American College of Rheumatology Ad Hoc Committee on Immunologic Testing Guidelines. Retningslinjer for immunologisk laboratorietesting ved revmatiske sykdommer: Anti-DNA-antistofftester. Leddgikt. 2002; 47: 546-555.
- Benito-Garcia E, Schur PH, Lahita R. Retningslinjer for immunologisk laboratorietesting ved revmatiske sykdommer: Anti-Sm og Anti-RNP antistofftester. Leddgikt. 2004; 51: 1030-1044.
- Reichlin M. Klinisk betydning av anti-Ro / SSA og anti-La / SSB antistoffer. Oppdatert. Oktober 2008.
- Reveille JD, Sherrer YRS, Solomon DH, Schur P, Kavanaugh A. Bevisbasert retningslinjer for bruk av immunologiske laboratorietester: Anti-Ro (SS-A) og La (SS- B): En rapport fra ACR Ad Hoc Committee on Immunological Testing Guidelines. Sendt ut for publisering.
- Reichlin M. Antiribosomal P-proteinantistoffer. Oppdatert. Oktober 2008.
- Denton CP. Klassifisering av sklerodermi. Oppdatert. Oktober 2008.