Klinisk sak
En 45 år gammel kvinne med en 20-årig historie med Crohns sykdom presentert med feber, frysninger og tretthet i 10 dager. Rett før symptomene begynte, gjennomgikk pasienten en ukomplisert koloskopi der hun fikk utført 17 biopsier for overvåking eller polypektomi. Under koloskopi var Crohns sykdom i remisjon, og det ble ikke notert slimhinnebetennelse.
I ED var pasientens vitale tegn HR 110, BP 120/80, RR 18, T 102.5. Hun hadde mild ømhet i høyre øvre del av magen. Laboratoriestudier avdekket et forhøyet antall hvite blodlegemer (15.000) og forhøyet AST og ALT (120/137 U / L), med svakt forhøyet alkalisk fosfatase på 200 IE / L. En datortomografi (CT) -skanning av underlivet avslørte flere områder med lav demping i høyre leverlobe i samsvar med leverabscesser. Drenering av abscessene ble dyrket og vokste Streptococcus anginosus. Oppløsningen av alle lesjoner skjedde etter at de ble tappet av intervensjonsradiologi, og pasienten fikk et 6-ukers forløp med intravenøs antibiotika.
Innledning
Koloskopi er en vanlig utført prosedyre for diagnostisering og behandling av et bredt spekter av tilstander, inkludert kreft, inflammatoriske tarmsykdommer, polypper, blødninger og strikturer. I følge American Cancer Society anbefales screening koloskopi hvert 10. år fra 50 år. Hos høyrisikopasienter som de med inflammatorisk tarmsykdom utføres koloskopi oftere. Fremgangsmåten er fremdeles den mest effektive måten å finne og fjerne små pre-kreft polypper, og dermed redusere risikoen for død fra tykktarms- og endetarmskreft.
Generelt er koloskopi veldig trygt. En 2008-systematisk gjennomgang av 12 studier på totalt 57 742 koloskopier utført for gjennomsnittsrisikoscreening viste en samlet alvorlig bivirkningshastighet på bare 2,8 per 1000 prosedyrer og dødelighet på 0,007% .2 Risikoen for koloskopi er imidlertid ikke konstant på tvers av grupper, og noen komplikasjoner er vanligere enn andre. Eldre voksne har økt risiko for alvorlige komplikasjoner sammenlignet med yngre pasienter. I en studie av 53 220 koloskopier hadde pasienter i alderen 80 til 84 år en signifikant høyere frekvens av alvorlige komplikasjoner sammenlignet med pasienter i alderen 66 til 69 år. Risikoen for alvorlige komplikasjoner ble også økt blant pasienter med komorbide tilstander som en historie med hjerneslag, KOLS, atrieflimmer og hjertesvikt.
Pyogen leverabscess (PLA) er en sjelden, men alvorlig komplikasjon av koloskopi. . De fleste komplikasjoner av koloskopi vil forekomme innen 7 dager, men PLA kan presentere dager eller til og med uker senere enn det, og historien om nylig koloskopi kan ikke engang fremkalles med mindre klinikeren er klar over denne enheten.4-6 På grunn av forsinket natur av PLA, vil sannsynligvis disse pasientene bli diagnostisert i akuttmottaket.
Andre sene komplikasjoner som elektro-koagulasjonssyndrom etter polypektomi, og de vanligste problemene med forsinket blødning, uspesifikk magesmerter, reaksjoner på sedasjonsmidler , og perforering kan også sees i ED. Derimot vil gasseksplosjon eller øyeblikkelig blødning sjelden bli sett i ED, da disse problemene vanligvis opptrer raskt i endoskopisuiten, der de behandles fremover. ED-leger må være klar over alle mulige komplikasjoner og deres tidsforløp og ha verktøyene for å diagnostisere og behandle den uheldige pasienten etter koloskopi som får en alvorlig komplikasjon.
Komplikasjoner
Pyogenic Leverabscess
PLA er en farlig sykdom med høy sykelighet og dødelighet som forekommer med en hastighet på 10 til 20 tilfeller per 100.000 sykehusinnleggelser.4-6 Med fremskritt innen diagnostiske teknikker og intervensjoner, forbedres dødeligheten.7 Imidlertid er pasienter fortsatt i alvorlig fare, spesielt hvis diagnosen er forsinket, som den ofte er, fordi pasienter kan presentere ikke spesifikt. En retrospektiv studie av 63 pasienter med PLA viste at feber var vanlig (59%), men andre tegn og symptomer som smerter i høyre øvre kvadrant og peritoneale tegn var tilstede hos henholdsvis bare 39% og 14%. 8 Diagnosen i denne studien var ofte forsinket i gjennomsnitt en uke fra symptomdebut.
Koloskopi er en sjelden, men også sannsynligvis undergjenkjent utfelling av PLA. Det antas at lydløse mikroperforeringer under prosedyren fører til infeksjon som kan frø leveren gjennom portalsirkulasjonen. Tilsvarende kan andre intra-abdominale infeksjoner som divertikulitt potensielt forårsake PLA hvis det infiserte området blir drenert av portvenen.9 Leverklaring av bakterier via portalnettverket er et normalt fenomen hos friske pasienter, men galleobstruksjon, dårlig perfusjon og høy bakterielast (som i tilfelle infeksjon eller flere biopsier under koloskopi som sår blodstrømmen) kan disponere for spredning og abscess formasjon. Litteraturen beskriver omtrent 34% av PLA-tilfellene som kryptogene, men en del av disse kan godt være pasienter med nylig koloskopi som ikke ble anerkjent som en risikofaktor for sykdomsprosessen.8
De fleste PLA-isolater er polymikrobielle og består av normal enterisk flora. Blodkulturer er positive i 33-65% av tilfellene, men abscesskulturer er nesten alle positive.10 De mest isolerte mikroorganismer er Streptococcus-arter (37%), Eserichia Coli (33%), Bacteroides-arter (24%), Klebsiella pneumoniae (18%) og mikroaerofile streptokokker (12%). 10-11 Strep anginosus, funnet i pasientens tilfelle, er en fakultativ anaerob gram-positiv coccus og en av de vanligste organismer som finnes i PLA.
Rask diagnose av PLA er kritisk, fordi selv om diagnose og terapi forbedres, forblir dødeligheten på 10%. 5,7 Smittsomme komplikasjoner av koloskopi generelt er sjeldne, men igjen er sannsynligvis også årsakssammenheng underkjent. Koloskopi har vært implisert i minst noen få tilfeller av PLA.12-14. Men forbigående systemisk bakteriemi, sett i 4% av koloskopier, ser ikke ut til å øke risikoen for infeksjon i seg selv.15 I stedet antas infeksjonen i PLA å spre seg via faktiske mikroperforeringer.
Selv om det er kjent at ærlige perforeringer er relativt sjeldne (mindre enn 0,1% av koloskopier), er ikke forekomst og patofysiologi av mikroperforeringer ikke helt kjent. 16-17 Bevæpnet med kunnskap om denne kliniske enhet, en kliniker som fremkaller en god historie og har en høy mistankeindeks, kan raskere diagnostisere PLA hos en pasient med nylig koloskopi.
Infeksjon
Det er allment akseptert at forbigående bakteriemi etter at koloskopi forekommer i omtrent 4% av prosedyrene, selv om intervallet er rapportert som 0-25%, og risikofaktorer for bakteriemi ikke er definert.18 Høyere forekomst av bakteriemi oppstår under rutinemessige daglige aktiviteter som tannpuss og tygging av mat. Selv om tegn eller symptomer på systemisk infeksjon hos pasienter med forbigående bakteriemi er sjeldne, kan pasienter føle feber, frysninger og klager som etterligner alt fra øvre luftveier til bukinfeksjoner.18
Selv om forbigående bakteriemi er en akseptert risiko for koloskopi , det er ingen bevist fordel for rutinemessig antibiotikaprofylakse, og de fleste pasienter vil ikke ha tatt antibiotika peri-prosedyren.18 Nåværende retningslinjer fra American Society for Gastroenterology (ASGE) er enige med American Heart Association (AHA) og anbefaler mot antibiotikaprofylakse for pasienter som gjennomgår rutinemessig koloskopi.19
Det kan være vanskelig å skille symptomer på forbigående bakteriemi fra ekte infeksjon.18 Generelt garanterer pasienter med smittsomme symptomer i dagene etter koloskopi laboratoriestudier inkludert blodkulturer, og avhengig av indeksen for mistanke om perforering, abdominal bildebehandling.20-21 Hvis mistanke om perforering er lav eller diagnosene s er utelukket, kan IV-hydrering og antibiotika gis hvis det er berettiget av pasientens kliniske status.
Blødning
Blødning etter polypeptomi kan enten være øyeblikkelig eller forsinket. Umiddelbar blødning er assosiert med polypektomi-teknikker som ikke bruker kauteri eller når blandet strøm brukes til prosedyren. Forsinket blødning er oftere sett i ED, da øyeblikkelig blødning ofte oppdages på prosedyren og behandles av endoskopisten. Forsinket blødning kan sees opptil 7 dager etter inngrepet. Det antas å forekomme på grunn av sloughing av en skille som dekket et blodkar eller på grunn av utvidelse av sonen med termisk nekrose til ikke-skadet vev, noe som kan resultere i blødning hvis det involverer et blodkar. 19,22
Flere store studier har rapportert blødning i 1 til 6 per 1000 koloskopier (0,1% -0,6%). 22 En studie som analyserte over 50 000 koloskopier fant imidlertid at frekvensen av GI-blødning var signifikant forskjellig, avhengig av om polypektomi ble utført. Blødning etter polypeptomi forekommer med 1-2%, med høyere priser sett ved fjerning av større polypper. Risikoen for blødning etter polypektomi kan økes hos pasienter med trombocytopeni eller koagulopatier.23
Kjente risikofaktorer for blødning etter koloskopi inkluderer polyppstørrelse, antall polypper som er fjernet, historie med nylig antikoagulasjonsbruk eller polypp histologi.22 Merkelig nok fant flere, store studier ikke aspirinbruk assosiert med blødning etter polypektomi.24-26
Pasienter med forsinket blødning kan ha tegn på blødning eller anemi, inkludert utmattelse, svakhet , blekhet, kraftig blødning eller blodpropp ved tørking, takykardi, brystsmerter og kortpustethet.Pasienter kan beskrive hematochezia eller melena, avhengig av hvor blødningen befinner seg.
Innledende behandling av en pasient med mistanke om blødning inkluderer adressering av grunnleggende luftveier, pust og sirkulasjon med 2 store boring IV, krystalloid væsker og hjerteovervåking. Pasienter med grov lavere GI-blødning kan dekompensere raskt og bør ha en aktiv type og skjerm i tilfelle transfusjon er nødvendig.
Bildebehandling er ikke alltid nødvendig, og om mulig skal beslutningen om bildebehandling tas sammen med GI konsulter, helst legen som utførte koloskopien. Gjenta koloskopi er ofte den valgte diagnostiske og terapeutiske prosedyren. American College of Radiology gir den høyeste hensiktsmessigheten av koloskopi, selv om den også inkluderer CTA i underlivet / bekkenet og Tc-99m RBC-skanning i underlivet / bekkenet som mulig passende trinn i diagnosen.27
Hvis pasienten er ustabil og den utførende endoskopisten er utilgjengelig, bør ED-legen konsultere generell intervensjonsradiologi (IR), GI og kirurgi.
Perforering
Koloskopisk perforering (CP) er en av de mest alvorlige og fryktede komplikasjoner av koloskopi. Selv om det er sjeldent, resulterer CP i høy sykelighet og dødelighet. 28-32 Perforering kan skyldes mekaniske krefter mot tarmveggen, barotrauma eller elektrokauteri og kan føre til dannelse av abscess, fisteldannelse, intra-abdominal sepsis, lengre sykehusopphold og til og med død.
CP forekommer i omtrent 0,016% av diagnostiske koloskopier, men kan sees hos opptil 5% av terapeutiske koloskopier.33-35 Avhengig av hva som faktisk ble gjort under koloskopien, kan risikoen for perforering være høyere eller lavere enn gjennomsnittet, så å skaffe den operative rapporten eller historikken fra endoskopisten kan være nyttig for å bestemme risikoen.
CP-risiko for varierte koloskopiske prosedyrer: 1,36-37
-Screeningskoloskopi: 0,01-0,1%
-Anastomotisk strengningsdilatasjon: 0-6%
-Crohn sykdoms strammedilatasjon: 0-18%
-Stent plassering: 4%
-Kolonisk dekompresjonsrørplassering: 2%
-Kolonisk endoskopisk slimhinnereseksjon 0-5%
Bortsett fra hendelsene under prosedyre, spesifikke risikofaktorer for CP inkluderer høy alder, flere comorbiditeter, divertikulose, obstruksjon, reseksjon av polypper, polypper som er større enn 1 cm i størrelse eller de som finnes i høyre tykktarm, nedsatt mobilitet i tykktarmen, eksisterende svakhet i tykktarmveggen , forrige ufullstendig forsøk på koloskopi, eller endoskopisk uerfarenhet.20
Pasienter med CP kan presentere plutselig, forverret magesmerter, etterfulgt av den falsk beroligende fullstendige smertedriften når perforeringen dekomprimerer det betente organet. Når gastrointestinalt innhold fortsetter å søle ut i bukhinnen, forverres smerte og peritoneale symptomer. Imidlertid vil symptomene variere avhengig av plassering og størrelse på perforering, graden av fekal sive inn i bukhinnen, og pasientens alder og comorbiditeter.
Spesielt kan perforeringer også være retroperitoneal, tilsvarende den plassering av stigende og synkende tykktarm og lever- og miltbøyninger. Selv om det vanligste symptomet på en perforering i tykktarmen er magesmerter, kan eldre pasienter ha en avstumpet respons. Andre symptomer inkluderer feber, kvalme, oppkast, dyspné, brystsmerter, scapular smerter og nakkesmerter. Spesielt perforeringer i retroperitoneale kan ha minimale eller atypiske symptomer, og vitale tegn kan vise takykardi og feber, men kan også være normale.20
Innledende behandling av en mistenkt perforering inkluderer oppmerksomhet mot luftveier, pust, sirkulasjon med 2 storhullede IV-er, krystalloid væsker og hjerteovervåker. Labs inkludert CBC, CMP, lipase, type og skjermoppnåelse bør skaffes. Pasienten bør være strengt NPO med empiriske IV-antibiotika. Stat-bildebehandling med CT-underliv / bekken eller røntgen av magen hvis det er ustabilt, bør bestilles ved siden av et statskirurgisk konsultasjon.21
Post-polypectomy syndrom
Post-polypectomy syndrom, også kjent som postkoagulasjonssyndrom eller polypektektomi brannsyndrom, resultat av elektrokoagulasjonsskade på tarmveggen, og skaper en transmural brenning og fokal peritonitt uten åpen perforasjon.38 Den rapporterte forekomsten varierer fra 3 per 100.000 (0,003%) til 1 av 1000 (0,1% ). Post-polypektomisyndrom ble rapportert hos 6 pasienter av 16 318 koloskopier utført mellom 1994 og 2002 i et stort integrert helsesystem.39 Risikofaktorer for denne uvanlige komplikasjonen er ukjente.
Pasienter med post-polypektomisyndrom er vanligvis tilstede innen 12 timer etter koloskopi med feber, takykardi og magesmerter. Imidlertid kan symptomutbruddet bli forsinket med opptil 5–7 dager etter inngrepet. 40 Pasienter har ofte leukocytose og kan utvise stivhet og takykardi, som alle etterligner kolonperforering.41
Men i motsetning til perforering, som kan kreve fremvoksende kirurgi, blir pasienter med post-polypektomisyndrom generelt behandlet konservativt med intravenøs væske, smertestyring og gradvis forbedring av dietten, med eller uten antibiotika rettet mot gram- negative og anaerobe patogener.42 Mindre alvorlige tilfeller kan til og med håndteres poliklinisk med orale antibiotika og klare væsker i 1-2 dager.42-43
Da disse pasientene kan skille seg fra pasienter med perforering, enhver pasient mistenkt for post-polypektomisyndrom garanterer laboratorier og bildebehandling. Ved post-polypektomisyndrom vil CT-skanning vanligvis utvise fokal fortykning av tykktarmveggen med omkringliggende fettstrenging uten ekstramural luft, men i milde tilfeller kan CT være negativ.42 Uavhengig av avbildningsresultat, som med perforering, hvis post-polypektomisyndrom mistenkes, bør pasienten ha en kirurgisk konsultasjon.
Perler
- Koloskopi er en mye brukt screeningtest hos pasienter over 50. Komplikasjoner kan være tidlig eller forsinket. EM-leger bør være oppmerksomme på mulige komplikasjoner og deres forventede tidslinje, for å kunne diagnostisere og håndtere mulig presentasjonskomplikasjon nøyaktig. pyogen leverabscess.
- Historie om pasientfaktorer og selve prosedyren (underliggende forhold, medisiner, om polypper ble fjernet, hvis kauteri ble brukt, om det var øyeblikkelig blødning) kan lede diagnose og behandling i ED.
- Pyogen leverabscess kan være 1-2 uker etter koloskopi med smerter og feber i høyre øvre kvadrant.
- Mye av tykktarmen er retroperitoneal. Retroperitoneale perforeringer kan forårsake vage og atypiske symptomer, så mistankeindeksen må være høy.
- Postpolypektomisyndrom kan etterligne perforering og kan vanligvis differensieres ved avbildning.
Referanser / Videre lesing:
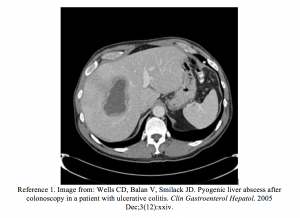
- Wells CD, Balan V, Smilack JD. Pyogen leverabscess etter koloskopi hos en pasient med ulcerøs kolitt. Clin Gastroenterol Hepatol. 2005 des; 3 (12): xxiv.
- Whitlock, E.P., Lin, J.S., Liles, E. et al. Screening for kolorektal kreft: en målrettet, oppdatert systematisk gjennomgang av U.S.TeSactive Force Task Force. Ann Intern Med. 2008; 149: 638–658.
- Warren JL, Klabunde CN, Mariotto AB, Meekins A, Topor M, Brown ML, Ransohoff. Bivirkninger etter poliklinisk koloskopi i Medicare-befolkningen. Ann Intern Med. 2009; 150 (12): 849.
- Johannsen EC, Sifri CD, Madoff LC. Pyogene leverabscesser.Infect Dis Clin North Am. 2000; 14: 547–63.
- Meddings L, Myers RP, Hubbard J, et al. En populasjonsbasert studie av pyogene leverabscesser i USA: Forekomst, dødelighet og tidsmessige trender. Am J Gastroenterol. 2010; 105: 117–24.
- Kaplan GG, Gregson DB, Laupland KB. Befolkningsbasert studie av epidemiologien til og risikofaktorene for pyogen leverabscess. Clin Gastroenterol Hepatol. 2004; 2: 1032-8.
- Petri A, Höhn J, Hódi Z, Wolfárd A, Balogh A. Pyogen leverabscess – 20 års erfaring. Sammenligning av behandlingsresultater i to perioder. Langenbecks Arch Surg. 2002; 387: 27–31.
- Pang TC, Fung T, Samra J, Hugh TJ, Smith RC. Pyogen leverabscess: En tilsyn med 10 års erfaring. Verden J Gastroenterol. 2011; 17: 1622–30.
- Murarka S, Pranav F, Dandavate V. DisseminatedStreptococcus anginosus from sigmoid diverticulitis. J Glob Infect Dis. 2011; 3: 79–81.
- Branum GD, Tyson GS, Branum MA, Meyers WC. Leverabscess. Endringer i etiologi, diagnose og ledelse. Ann Surg. 1990 212 desember (6): 655-62.
- Gyorffy EJ, Frey CF, Silva J Jr, McGahan J. Pyogenic leverabscess. Diagnostiske og terapeutiske strategier. Ann Surg. 1987 20. desember (6): 699-705.
- Bonenfant F, Rousseau É, Farand P. Streptococcus anginosuspyogen leverabscess etter en screeningkoloskopi. Canadian Journal of Infectious Diseases & Medisinsk mikrobiologi. 2013; 24 (2): e45-e46.
- Ian G. Harnik. Pyogen leverabscess etter malign polypektomi. Dig Dis Sci. 2007; 52: 3524–5.
- Paraskeva KD, Bury RW, Isaacs P.Streptococcus milleri leverabscesser: En uvanlig komplikasjon etter koloskopisk fjerning av et påvirket fiskeben. Gastrointest Endosc. 2000; 51: 357–8.
- Low DE, Shoenut JP, Kennedy JK, et al. Prospektiv vurdering av risiko for bakteriemi ved koloskopi og polypektomi. Dig Dis Sci. 1987; 32: 1239–43.
- Becker F, Nusko G, Welke J, Hahn EG, Mansmann U. Oppfølging etter kolorektal polypektomi: En nytte-risikoanalyse av tyske overvåkingsanbefalinger. Int J Colorectal Dis. 2007; 22: 929–39.
- Macrae FA, Tan KG, Williams CB. Mot tryggere koloskopi: En rapport om komplikasjonene ved 5000 diagnostiske eller terapeutiske koloskopier. Mage. 1983; 24: 376–83.
- Nelson, D.B.Smittsomme sykdomskomplikasjoner av GI-endoskopi: del II, eksogene infeksjoner. Gastrointest Endosc. 2003; 57: 695–711.
- Khashab, M.A., Chithadi, K.V., Acosta, R.D. et al. Antibiotisk profylakse for GI-endoskopi. ASGE Standards of Practice Committee. Gastrointest Endosc. 2015; 81: 81-89.
- Lohsiriwat V. Kolonoskopisk perforering: Forekomst, risikofaktorer, ledelse og utfall. World Journal of Gastroenterology: WJG. 2010; 16 (4): 425-430.
- American College of Radiology ACR Appropriateness Criteria: Acute (Nonlocalized)
- Ko, C.W. og Dominitz, J.A. Komplikasjoner av koloskopi: størrelse og ledelse. Gastrointest Endosc Clin N Am. 2010; 20: 659–671.
- Warren JL, Klabunde CN, Mariotto AB, et al. Bivirkninger etter poliklinisk koloskopi i Medicare-befolkningen. Ann Intern Med 2009; 150: 849-57.
- Hui, A.J., Wong, R.M., Ching, J.Y. et al. Risiko for koloskopisk polypektomi-blødning med antikoagulantia og blodplater: analyse av 1657 tilfeller. Gastrointest Endosc. 2004; 59: 44–48.
- Sawhney, M.S., Salfiti, N., Nelson, D.B. et al. Risikofaktorer for alvorlig forsinket blødning i etterpolypektomi. Endoskopi. 2008; 40: 115–119
- Yousfi, M., Gostout, C.J., Baron, T.H. et al. Postpolypectomy nedre gastrointestinal blødning: potensiell rolle for aspirin. Am J Gastroenterol. 2004; 99: 1785–1789.
- American College of Radiology ACR Appropriateness Criteria: Radiologic Management of Lower Gastrointestinal Tract Bleeding. https://acsearch.acr.org/docs/69457/Narrative/ (Besøkt 16. juli 2017).
- Lohsiriwat V, Sujarittanakarn S, Akaraviputh T, Lertakyamanee N, Lohsiriwat D, Kachinthorn U. Kolonoskopisk perforering: En rapport fra World Gastroenterology Organization endoscopy training centre i Thailand. Verden J Gastroenterol. 2008; 14: 6722–6725.
- Iqbal CW, Cullinane DC, Schiller HJ, Sawyer MD, Zietlow SP, Farley DR. Kirurgisk styring og resultater av 165 koloskopiske perforeringer fra en enkelt institusjon. Arch Surg. 2008; 143: 701–706; diskusjon 706-707.
- Teoh AY, Poon CM, Lee JF, Leong HT, Ng SS, Sung JJ, Lau JY. Resultater og prediktorer for dødelighet og stomidannelse i kirurgisk behandling av koloskopiske perforeringer: en multisenter-gjennomgang. Arch Surg. 2009; 144: 9–13.
- Lüning TH, Keemers-Gels ME, Barendregt WB, Tan AC, Rosman C. Koloskopiske perforeringer: en gjennomgang av 30 366 pasienter. Surg Endosc. 2007; 21: 994–997.
- Mai CM, Wen CC, Wen SH, Hsu KF, Wu CC, Jao SW, Hsiao CW. Iatrogen kolonperforering ved koloskopi: en dødelig komplikasjon for pasienter med høy bedøvelsesrisiko. Int J Colorectal Dis. 2010 apr; 25 (4): 449-54.
- Rathgaber SW, Wick TM. Koloskopi fullføring og komplikasjonsfrekvenser i en gastroenterologisk praksis i samfunnet. Gastrointest Endosc. 2006; 64: 556–562.
- Damore LJ, Rantis PC, Vernava AM, Longo WE. Koloskopiske perforeringer. Etiologi, diagnose og ledelse. Dis Colon Rectum. 1996; 39: 1308–1314.
- Repici A, Pellicano R, Strangio G, Danese S, Fagoonee S, Malesci A. Endoskopisk slimreseksjon for tidlig kolorektal neoplasi: patologisk grunnlag, prosedyrer og utfall. Dis Colon Rectum. 2009; 52: 1502-1515.
- Chukmaitov A, Bradley CJ, Dahman B, et al. Forening av polypektomi-teknikker, endoskopivolum og anleggstype med koloskopikomplikasjoner. Gastrointest Endosc. 2013; 77: 436.
- Fisher DA, Maple DT, et al. Komplikasjoner av koloskopi. ASGE Standards of Practice Committee Gastrointest Endosc. 2011; 74: 745. Magesmerter og feber eller mistenkt abscess i magen; Variant 1: Postoperativ pasient med feber. https://acsearch.acr.org/docs/69356/Narrative/ (Besøkt 17. juli 2017).
- Hirasawa K, Sato C, Makazu M, et al. Koagulasjonssyndrom: Forsinket perforering etter endoskopisk kolorektal behandling. World Journal of Gastrointestinal Endoscopy. 2015; 7 (12): 1055-1061.
- Levin TR, Zhao W, Conell C, Seeff LC, Manninen DL, Shapiro JA, Schulman J. Komplikasjoner av koloskopi i et integrert helsevesen. Ann Intern Med. 2006; 145 (12): 880.
- Kim HW. Hva er forskjellen mellom postpolypectomy feber og postpolypectomy koagulasjonssyndrom? Clin Endosc. 2014; 47 (3): 205–6.
- Stock C, Ihle P, Sieg A, Schubert I, Hoffmeister M, Brenner H Bivirkninger som krever sykehusinnleggelse innen 30 dager etter poliklinisk screening og ikke-screening koloskopi. Gastrointest Endosc. 2013 mar; 77 (3): 419-29.
- Sethi A, sang LMWK. Bivirkninger relatert til endoskopisk endoskopisk slimhinnereseksjon og polypektomi. Gastrointest Endosc Clin N Am. 2015; 25 (1): 55–69.
- Benson BC, Myers JJ, Laczek JT. Postpolypectomy elektrokoagulasjonssyndrom: En etterligner av kolonperforering. Saksrepresentant Emerg Med. 2013; 2013 687931.