Obniżanie prężności par
Jak opisano w rozdziale dotyczącym cieczy i ciał stałych, równowagowe ciśnienie pary cieczy to ciśnienie wywierane przez gaz faza, w której parowanie i kondensacja zachodzą w równym tempie:
\ text {liquid} \ rightleftharpoons \ text {gas}
Rozpuszczanie nielotnej substancji w cieczy lotnej powoduje obniżenie prężności par cieczy. Zjawisko to można zracjonalizować, rozważając wpływ dodanych cząsteczek substancji rozpuszczonej na procesy parowania i kondensacji cieczy. Aby odparować, na powierzchni roztworu muszą znajdować się cząsteczki rozpuszczalnika. Obecność substancji rozpuszczonej zmniejsza powierzchnię dostępną dla cząsteczek rozpuszczalnika, a tym samym zmniejsza szybkość parowania rozpuszczalnika. Ponieważ obecność substancji rozpuszczonej nie wpływa na szybkość kondensacji, wynikiem netto jest to, że równowaga parowania i kondensacji jest osiągana przy mniejszej liczbie cząsteczek rozpuszczalnika w fazie pary (tj. Przy niższej prężności pary) (Rysunek 1). Chociaż ta interpretacja kinetyczna jest przydatna, nie uwzględnia ona kilku ważnych aspektów koligatywnego charakteru obniżania ciśnienia pary. Bardziej rygorystyczne wyjaśnienie dotyczy własności entropii, która jest przedmiotem dyskusji w późniejszym rozdziale tekstowym o termodynamice. Aby zrozumieć obniżenie prężności par cieczy, należy zauważyć, że większa entropia roztworu w porównaniu z jego oddzielnym rozpuszczalnikiem i substancją rozpuszczoną służy skutecznej stabilizacji cząsteczek rozpuszczalnika i utrudnianiu ich parowania. Rezultatem jest niższa prężność par i odpowiednio wyższa temperatura wrzenia, jak opisano w następnej sekcji tego modułu.
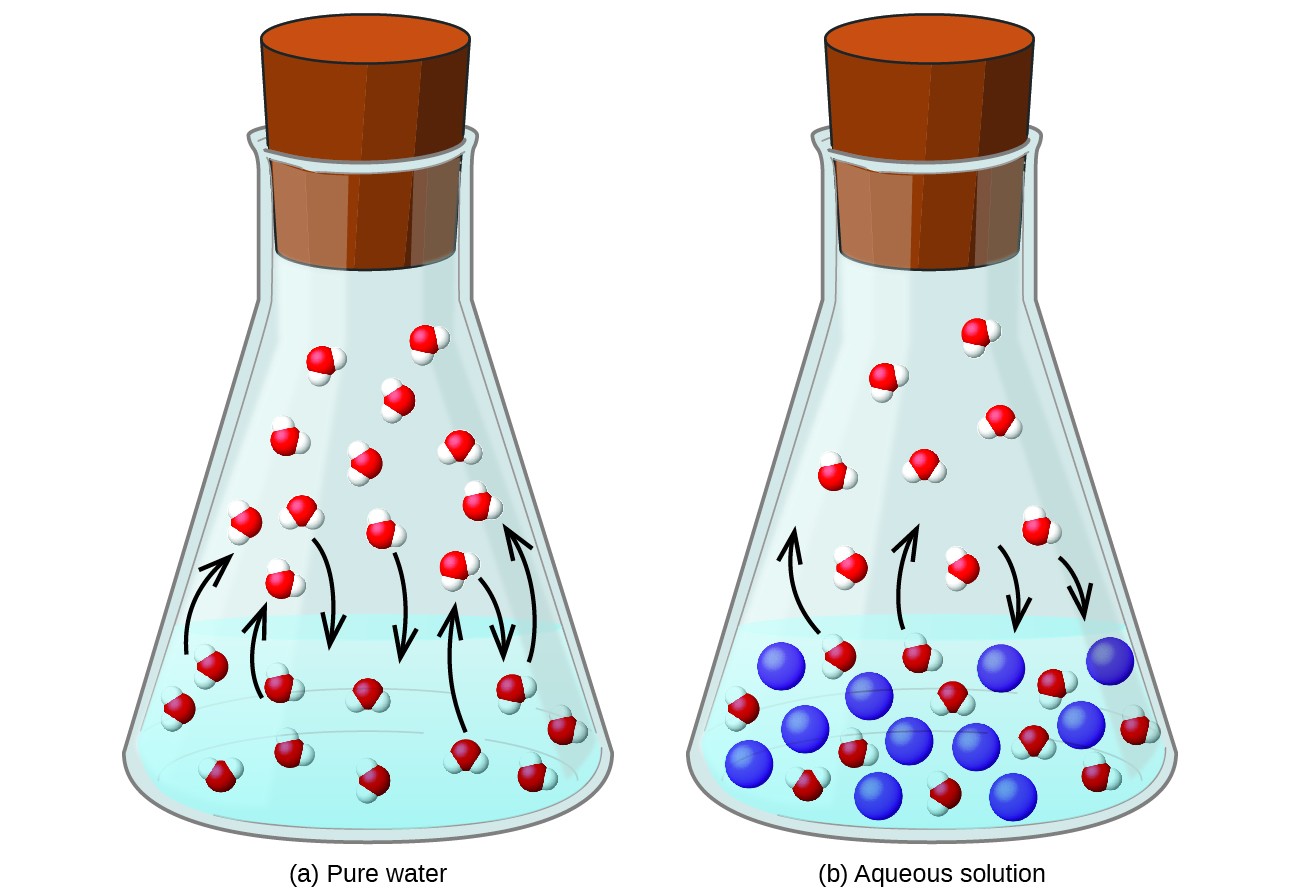
Rysunek 1. Obecność nielotnych substancji rozpuszczonych obniża prężność par roztworu, utrudniając parowanie cząsteczek rozpuszczalnika.
Zależność między prężnością par składników roztworu a stężeniem te składniki opisuje prawo Raoulta: ciśnienie cząstkowe wywierane przez dowolny składnik idealnego roztworu jest równe prężności pary czystego składnika pomnożonej przez jego ułamek molowy w roztworze.
{P} _ {\ text {A}} = {X} _ {\ text {A}} {P} _ {\ text {A}} ^ {\ star}
Pamiętając, że całkowite ciśnienie mieszaniny gazowej jest równe sumie ciśnień cząstkowych wszystkich jej składników (prawo ciśnień cząstkowych Daltona), całkowite ciśnienie pary wywierane przez roztwór zawierający i składniki wynosi
{ P} _ {\ text {rozwiązanie}} = \ sum _ {i} {P} _ {i} = \ sum _ {i} {X} _ {i} {P} _ {i} ^ {\ star}
Substancja nielotna to taka, której prężność pary jest pomijalna (P ^ {\ star} ≈ 0), a więc prężność pary powyżej roztworu zawierającego tylko nielotne substancje rozpuszczone jest spowodowana tylko rozpuszczalnikiem:
{P} _ {\ text {rozwiązanie}} = {X} _ {\ text {rozpuszczalnik}} {P} _ {\ text {rozpuszczalnik}} ^ {\ star}
Destylacja roztworów
Destylacja to technika rozdzielania składników mieszanin, która jest szeroko stosowana zarówno w laboratorium, jak iw warunkach przemysłowych. Służy do rafinacji ropy naftowej, izolowania produktów fermentacji oraz oczyszczania wody. Ta technika separacji obejmuje kontrolowane ogrzewanie mieszaniny próbki w celu selektywnego odparowania, kondensacji i zebrania jednego lub więcej interesujących składników. Typową aparaturę do destylacji w skali laboratoryjnej przedstawiono na rysunku 2.

Rysunek 2. Typowy laboratoryjną jednostkę destylacyjną przedstawiono na (a) fotografii i (b) schemacie elementów. (źródło a: modyfikacja pracy „Rifleman82” / Wikimedia commons; źródło b: modyfikacja pracy autorstwa „Slashme” / Wikipedia)
Rafinerie ropy naftowej stosują destylację frakcyjną na dużą skalę, aby oddzielić składniki ropy naftowej. Ropa naftowa jest podgrzewana do wysokich temperatur u podstawy wysokiej kolumny frakcjonującej, odparowując wiele składników, które unoszą się w kolumnie. Kiedy odparowane składniki osiągają odpowiednio chłodne strefy podczas wynurzania, kondensują się i są zbierane. Zebrane ciecze są prostszymi mieszaninami węglowodorów i innych związków ropopochodnych, które mają odpowiedni skład do różnych zastosowań (np. Olej napędowy, nafta, benzyna), jak pokazano na rysunku 3.

Rysunek 3. Ropa naftowa to złożona mieszanina, która jest oddzielana metodą destylacji frakcyjnej na dużą skalę w celu wyodrębnienia różnych prostszych mieszanin.
Wysokość punktu wrzenia
Jak opisano w rozdziale dotyczącym cieczy i ciał stałych, temperatura wrzenia cieczy to temperatura, w której jej prężność par jest równa ciśnieniu atmosferycznemu otoczenia.Ponieważ prężność par roztworu jest obniżona z powodu obecności nielotnych substancji rozpuszczonych, ma się rozumieć, że następnie temperatura wrzenia roztworu zostanie podwyższona. Dlatego w porównaniu do czystego rozpuszczalnika, roztwór będzie wymagał wyższej temperatury, aby osiągnąć dowolną prężność pary, w tym taką, która jest równoważna ciśnieniu otaczającej atmosfery. Wzrost temperatury wrzenia obserwowany po rozpuszczeniu nielotnej substancji rozpuszczonej w rozpuszczalniku, ΔTb, nazywany jest podwyższeniem temperatury wrzenia i jest wprost proporcjonalny do stężenia molowego substancji rozpuszczonych:
\ Delta {T} _ {\ text {b}} = {K} _ {\ text {b}} m
gdzie Kb to stała elewacji punktu wrzenia lub stała ebulioskopowa, a m to stężenie molowe (molalność) wszystkich substancji rozpuszczonych.
Stałe wzrostu temperatury wrzenia są charakterystycznymi właściwościami zależnymi od rodzaju rozpuszczalnika. Wartości Kb dla kilku rozpuszczalników podano w Tabeli 1.
Stopień obniżenia prężności par rozpuszczalnika i podwyższenia temperatury wrzenia zależy od całkowitej liczby cząstek substancji rozpuszczonej obecnych w danej ilości rozpuszczalnika, a nie na masę, rozmiar lub tożsamość chemiczną cząstek. 1 m wodny roztwór sacharozy (342 g / mol) i 1 m wodny roztwór glikolu etylenowego (62 g / mol) będą miały tę samą temperaturę wrzenia, ponieważ każdy roztwór zawiera jeden mol cząstek (cząsteczek) substancji rozpuszczonej na kilogram rozpuszczalnika .
Przykład 6: Temperatura wrzenia roztworu jodu
Wyznacz temperaturę wrzenia roztworu 92,1 g jodu I2 w 800,0 g chloroformu CHCl3 , zakładając, że jod jest nielotny i że rozwiązanie jest idealne.
Sprawdź swoją wiedzę
Jaka jest temperatura wrzenia roztworu 1,0 g gliceryna C3H5 (OH) 3 w 47,8 g wody? Załóż idealne rozwiązanie.
Punkt zamarzania Depresja

Rysunek 4. Sól kamienna ( NaCl), chlorek wapnia (CaCl2) lub ich mieszanina służy do topienia lodu. (źródło: modyfikacja pracy Eddiego Welkera)
Roztwory zamarzają w niższych temperaturach niż czyste ciecze. Zjawisko to jest wykorzystywane w programach „odladzania”, które wykorzystują sól (Rysunek 4), chlorek wapnia lub mocznik do topienia lodu na drogach i chodnikach oraz w stosowaniu glikolu etylenowego jako „płynu niezamarzającego” w chłodnicach samochodowych. Woda morska zamarza w niższej temperaturze niż woda słodka, więc oceany arktyczne i antarktyczne pozostają niezamarznięte nawet w temperaturach poniżej 0 ° C (podobnie jak płyny ustrojowe ryb i innych zimnokrwistych zwierząt morskich żyjących w tych oceanach).
Spadek temperatury krzepnięcia rozcieńczonego roztworu w porównaniu do czystego rozpuszczalnika ΔTf nazywany jest obniżeniem temperatury krzepnięcia i jest wprost proporcjonalny do stężenia molowego substancji rozpuszczonej
\ Delta {T} _ {\ text {f}} = {K} _ {\ text {f}} m
gdzie m jest stężeniem molowym substancji rozpuszczonej w rozpuszczalnik i Kf nazywa się stałą obniżenia temperatury krzepnięcia (lub stałą krioskopową). Podobnie jak w przypadku stałych wzrostu temperatury wrzenia, są to właściwości charakterystyczne, których wartości zależą od tożsamości chemicznej rozpuszczalnika. Wartości Kf dla kilku rozpuszczalników podano w Tabeli 1.
Właściwości koligacyjne i odladzanie
Chlorek sodu i jego analogi z grupy 2 chlorek wapnia i magnezu są często używane do odladzanie jezdni i chodników, ze względu na fakt, że roztwór którejkolwiek z tych soli będzie miał temperaturę zamarzania niższą niż 0 ° C, czyli temperaturę zamarzania czystej wody. Sole metali z grupy 2 są często mieszane z tańszym i łatwiej dostępnym chlorkiem sodu („solą kamienną”) do stosowania na drogach, ponieważ są one nieco mniej korozyjne niż NaCl i powodują większe obniżenie temperatury zamarzania , ponieważ dysocjują, dając trzy cząstki na jednostkę wzoru, a nie dwie cząstki, takie jak chlorek sodu.
Ponieważ te związki jonowe mają tendencję do przyspieszania korozji metalu, nie byłoby mądrym wyborem do stosowania w płyn niezamarzający do chłodnicy w samochodzie lub do odladzania samolotu przed startem.Do tych zastosowań często stosuje się związki kowalencyjne, takie jak glikol etylenowy lub propylenowy. Glikole użyte w płynie do chłodnic nie tylko obniżają temperaturę zamarzania cieczy, ale także podwyższają temperaturę wrzenia, dzięki czemu płyn jest przydatny zarówno zimą, jak i latem. Ogrzane glikole są często rozpylane na powierzchnię samolotów przed startem podczas niesprzyjającej pogody zimą, aby usunąć już utworzony lód i zapobiec tworzeniu się większej ilości lodu, co byłoby szczególnie niebezpieczne, gdyby utworzył się na powierzchniach sterowych samolotu (Rysunek 5).

Rysunek 5. Obniżenie punktu zamarzania jest wykorzystywane do usuwania lodu z (a) jezdni oraz (b) powierzchnie sterowe statku powietrznego.
Diagram fazowy rozwiązania
Koligatywny wpływ na prężność par, temperaturę wrzenia i punkt zamarzania opisane w poprzedniej sekcji są dogodnie podsumowane przez porównanie diagramów fazowych dla czystej cieczy i roztworu otrzymanego z tej cieczy. Diagramy faz wody i roztworu wodnego pokazano na rysunku 6.
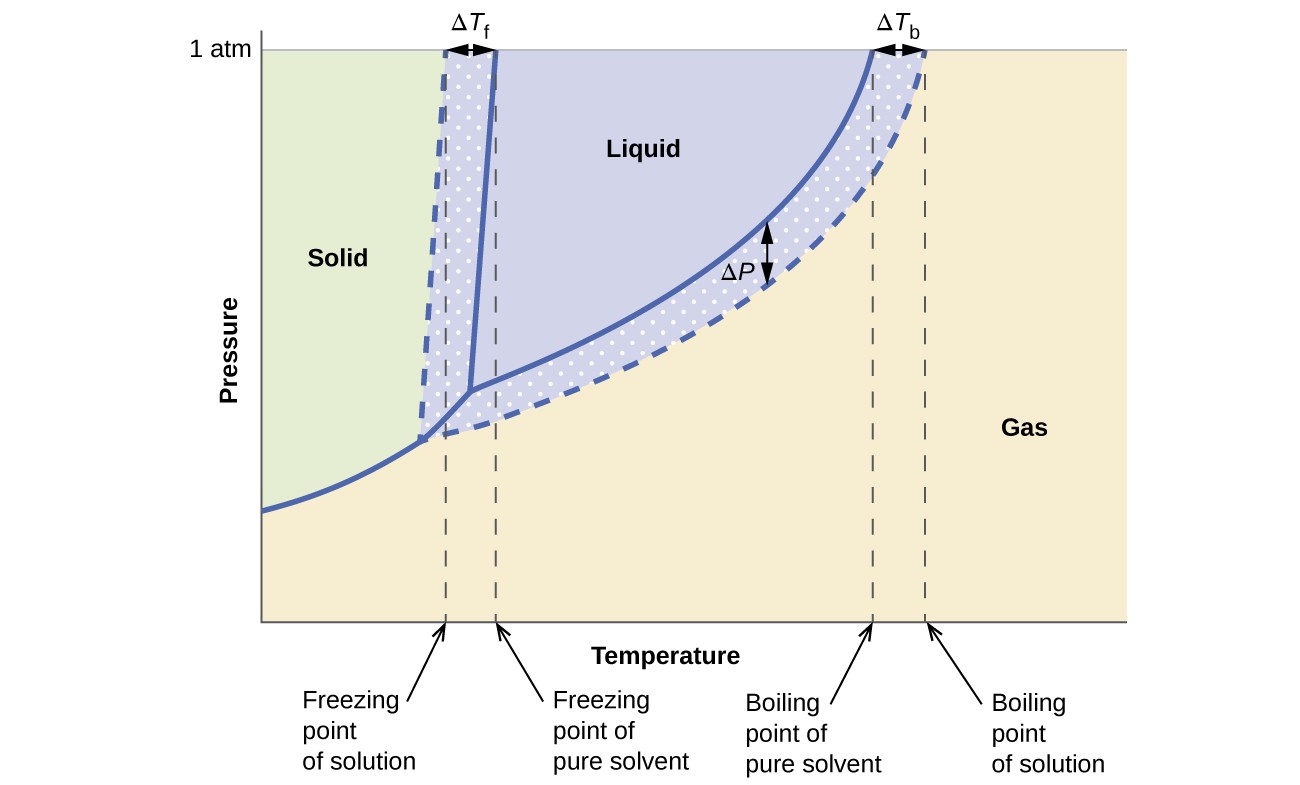
Rysunek 6. Ta faza diagramy przedstawiają wodę (krzywe stałe) i wodny roztwór nieelektrolitu (krzywe przerywane).
Krzywa ciecz-para dla roztworu znajduje się poniżej odpowiedniej krzywej dla rozpuszczalnika, przedstawiającej parę obniżenie ciśnienia ΔP, które wynika z rozpuszczania nielotnej substancji rozpuszczonej. W konsekwencji, przy dowolnym ciśnieniu, temperaturę wrzenia roztworu obserwuje się w wyższej temperaturze niż temperatura czystego rozpuszczalnika, co odzwierciedla podwyższenie temperatury wrzenia ΔTb, związane z obecnością nielotnej substancji rozpuszczonej. Krzywa ciało stałe-ciecz dla roztworu jest przesunięta w lewo od krzywej dla czystego rozpuszczalnika, przedstawiając obniżenie temperatury zamarzania ΔTb, które towarzyszy tworzeniu się roztworu. Na koniec zauważ, że krzywe ciało stałe-gaz dla rozpuszczalnika i jego roztworu są identyczne. Dzieje się tak w przypadku wielu roztworów zawierających ciekłe rozpuszczalniki i nielotne substancje rozpuszczone. Podobnie jak w przypadku waporyzacji, gdy roztwór tego rodzaju jest zamrażany, w rzeczywistości to tylko cząsteczki rozpuszczalnika przechodzą przemianę ciecz-ciało stałe, tworząc czysty stały rozpuszczalnik, który wyklucza substancje rozpuszczone. Dlatego fazy stałe i gazowe składają się wyłącznie z rozpuszczalników, a więc przejścia między tymi fazami nie podlegają efektom koligatywnym.
Osmoza i ciśnienie osmotyczne roztworów
Szereg naturalnych a materiały syntetyczne wykazują selektywne przenikanie, co oznacza, że tylko cząsteczki lub jony o określonej wielkości, kształcie, polarności, ładunku itd. są zdolne do przejścia (przenikania) przez materiał. Biologiczne błony komórkowe stanowią eleganckie przykłady selektywnego przenikania w naturze, podczas gdy rurki do dializy używane do usuwania odpadów metabolicznych z krwi są prostszym przykładem technologicznym. Niezależnie od tego, w jaki sposób można je wytworzyć, materiały te są ogólnie nazywane membranami półprzepuszczalnymi.
Rozważmy aparat zilustrowany na rysunku 7, w którym próbki czystego rozpuszczalnika i roztworu są oddzielone membraną, w której tylko rozpuszczalnik cząsteczki mogą przenikać. Cząsteczki rozpuszczalnika będą dyfundować przez membranę w obu kierunkach. Ponieważ stężenie rozpuszczalnika jest większe w czystym rozpuszczalniku niż w roztworze, cząsteczki te będą dyfundować ze strony rozpuszczalnika membrany na stronę roztworu z większą szybkością niż w odwrotnym kierunku. Rezultatem jest przenoszenie cząsteczek rozpuszczalnika z czystego rozpuszczalnika do roztworu. Kierowany dyfuzją transfer cząsteczek rozpuszczalnika przez półprzepuszczalną membranę to proces znany jako osmoza.
Rysunek 7. (a) Roztwór i czysty rozpuszczalnik są początkowo oddzielane membraną osmotyczną. (b) Przeniesienie netto cząsteczek rozpuszczalnika do roztworu zachodzi, dopóki jego ciśnienie osmotyczne nie zapewni równych szybkości transferu w obu kierunkach.
Gdy osmoza jest przeprowadzana w urządzeniu takim jak pokazano na rysunku 7 objętość roztworu zwiększa się, gdy zostaje rozcieńczony przez gromadzenie się rozpuszczalnika. Powoduje to wzrost poziomu roztworu, zwiększając jego ciśnienie hydrostatyczne (z powodu ciężaru kolumny roztworu w probówce) i powodując szybszy transfer cząsteczek rozpuszczalnika z powrotem na stronę czystego rozpuszczalnika. Gdy ciśnienie osiągnie wartość, która daje odwrotną szybkość przenoszenia rozpuszczalnika równą szybkości osmozy, przenoszenie rozpuszczalnika w masie ustaje. To ciśnienie nazywa się ciśnieniem osmotycznym (Π) roztworu. Ciśnienie osmotyczne rozcieńczonego roztworu jest powiązane z jego molarnością substancji rozpuszczonej, M i temperaturą absolutną, T, zgodnie z równaniem
\ Pi = MRT
gdzie R jest uniwersalną stałą gazową.
Jeśli roztwór zostanie umieszczony w urządzeniu takim jak to pokazane na rysunku 8, przyłożenie ciśnienia większego niż ciśnienie osmotyczne roztworu odwraca osmozę i wypycha cząsteczki rozpuszczalnika z roztworu do czystego rozpuszczalnika. Ta technika odwróconej osmozy jest używana do odsalania wody morskiej na dużą skalę i na mniejszą skalę do produkcji wody wodociągowej o wysokiej czystości do picia.
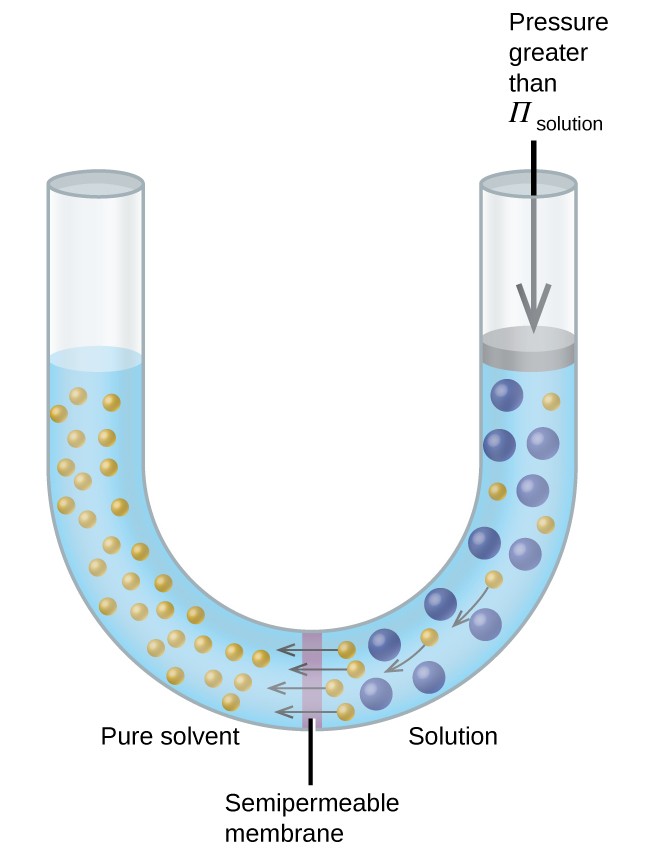
Rysunek 8. Przyłożenie ciśnienia większego niż ciśnienie osmotyczne roztworu spowoduje odwrócenie osmozy. Cząsteczki rozpuszczalnika z roztworu są wypychane do czystego rozpuszczalnika.
Oczyszczanie wody metodą odwróconej osmozy
W procesie osmozy dyfuzja służy do przemieszczania wody przez membrana półprzepuszczalna z mniej stężonego roztworu do bardziej stężonego roztworu. Ciśnienie osmotyczne to ciśnienie, które należy przyłożyć do bardziej stężonego roztworu, aby zatrzymać osmozę. Jeśli zastosuje się większe ciśnienie, woda przejdzie z bardziej stężonego roztworu do mniej stężonego (czystszego) roztworu. Nazywa się to odwróconą osmozą. Odwrócona osmoza (RO) jest wykorzystywana do oczyszczania wody w wielu zastosowaniach, od zakładów odsalania w miastach nadmorskich po urządzenia do oczyszczania wody w sklepach spożywczych (Rysunek 9) i mniejsze gospodarstwa domowe z odwróconą osmozą. Dzięki ręcznej pompie małe jednostki RO mogą być używane w krajach trzeciego świata, obszarach katastrof i łodzi ratunkowych. Nasze siły zbrojne dysponują różnymi jednostkami RO napędzanymi generatorami, które można transportować pojazdami do odległych miejsc.

Rysunek 9. Systemy odwróconej osmozy do oczyszczania wody pitnej są pokazane na (a) małej i (b) dużej skali. (kredyt a: modyfikacja pracy Jerry’ego Kirkharta; kredyt b: modyfikacja pracy Willarda J.Lathropa)
Przykłady osmozy są widoczne w wielu systemach biologicznych, ponieważ komórki są otoczony półprzepuszczalnymi membranami. Marchewki i seler, które stały się wiotkie z powodu utraty wody, można ponownie uczynić chrupiącymi, umieszczając je w wodzie. Woda przenika do komórek marchwi lub selera na zasadzie osmozy. Ogórek umieszczony w stężonym roztworze soli traci wodę przez osmozę i wchłania trochę soli, aby stać się marynatą. Osmoza może również wpływać na komórki zwierzęce. Stężenia substancji rozpuszczonych są szczególnie ważne, gdy roztwory są wstrzykiwane do organizmu. Substancje rozpuszczone w płynach komórkowych i surowicy krwi nadają tym roztworom ciśnienie osmotyczne około 7,7 atm. Roztwory wstrzyknięte do organizmu muszą mieć takie samo ciśnienie osmotyczne jak surowica krwi; to znaczy powinny być izotoniczne z surowicą krwi. Jeśli mniej stężony roztwór, roztwór hipotoniczny, zostanie wstrzyknięty w ilości wystarczającej do rozcieńczenia surowicy krwi, woda z rozcieńczonej surowicy przedostanie się do komórek krwi na drodze osmozy, powodując rozszerzanie się i pękanie komórek. Ten proces nazywa się hemolizą. Kiedy wstrzykuje się bardziej stężony roztwór, hipertoniczny roztwór, komórki tracą wodę do bardziej stężonego roztworu, kurczą się i prawdopodobnie umierają w procesie zwanym krenacją. Efekty te zilustrowano na Rysunku 10.
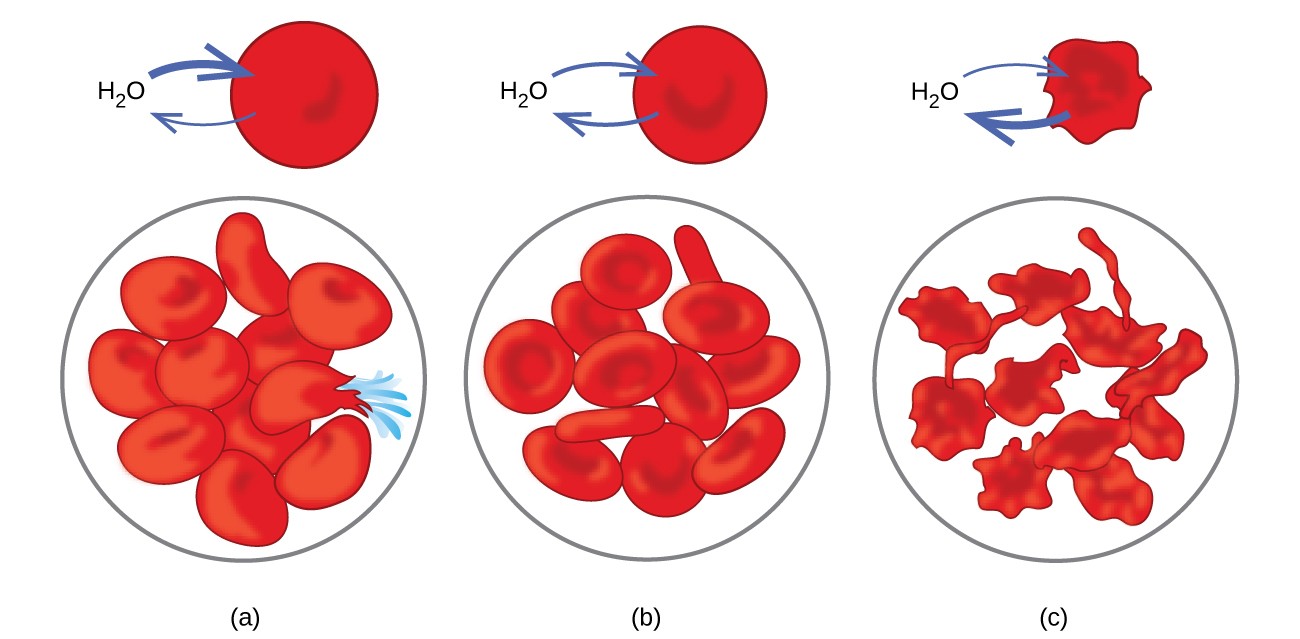
Rys. 10. Błony krwinek czerwonych są przepuszczalne dla wody i będą (a) pęcznieć i prawdopodobnie pękać w roztworze hipotonicznym; (b) utrzymywać normalną objętość i kształt w roztworze izotonicznym; i (c) kurczą się i prawdopodobnie umierają w roztworze hipertonicznym. (kredyt a / b / c: modyfikacje pracy „LadyofHats” / Wikimedia commons)
Oznaczanie mas molowych
Ciśnienie osmotyczne i zmiany temperatury krzepnięcia, wrzenia punkt, a prężność pary są wprost proporcjonalne do stężenia obecnej substancji rozpuszczonej. W konsekwencji, możemy użyć pomiaru jednej z tych właściwości do określenia masy molowej substancji rozpuszczonej na podstawie pomiarów.
Właściwości koligatywne elektrolitów
Jak wspomniano wcześniej w tym module, właściwości koligatywne roztworu zależą tylko od liczby, a nie tożsamości rozpuszczonych substancji rozpuszczonych. Warunki stężenia w równaniach dla różnych właściwości koligatywnych (obniżenie temperatury zamarzania , podwyższenie temperatury wrzenia, ciśnienie osmotyczne) dotyczą wszystkich substancji rozpuszczonych obecnych w roztworze. W przypadku roztworów rozważanych dotychczas w tym rozdziale, substancje rozpuszczone były nieelektrolitami, które rozpuszczają się fizycznie bez dysocjacji lub jakiegokolwiek innego towarzyszącego procesu. le, który się rozpuszcza, daje jedną rozpuszczoną cząsteczkę substancji rozpuszczonej. Rozpad elektrodytu nie jest jednak tak prosty, co ilustrują dwa typowe przykłady poniżej:
Biorąc pod uwagę pierwszy z tych przykładów i zakładając całkowitą dysocjację, 1,0 m wodny roztwór NaCl zawiera 2,0 mole jonów (1,0 mol Na + i 1.0 mol Cl−) na każdy kilogram wody, a przewiduje się, że obniżenie jego temperatury zamarzania będzie wynosić
Gdy ten roztwór zostanie faktycznie przygotowany i zmierzy się jego obniżenie temperatury zamarzania, otrzymamy jednak wartość 3,4 ° C. Podobne rozbieżności obserwuje się w przypadku innych związków jonowych, a różnice między zmierzonymi i oczekiwanymi wartościami właściwości koligatywnych zwykle stają się bardziej znaczące, gdy zwiększają się stężenia substancji rozpuszczonej. Te obserwacje sugerują, że jony chlorku sodu (i innych silnych elektrolitów) nie ulegają całkowitej dysocjacji w roztworze.
Aby to wyjaśnić i uniknąć błędów towarzyszących założeniu całkowitej dysocjacji, parametr mierzony eksperymentalnie, wymieniony w honorowy laureata Nagrody Nobla niemieckiego chemika Jacobusa Henricusa van’t Hoffa. Współczynnik van’t Hoffa (i) jest zdefiniowany jako stosunek cząstek substancji rozpuszczonej w roztworze do liczby rozpuszczonych jednostek formuły:
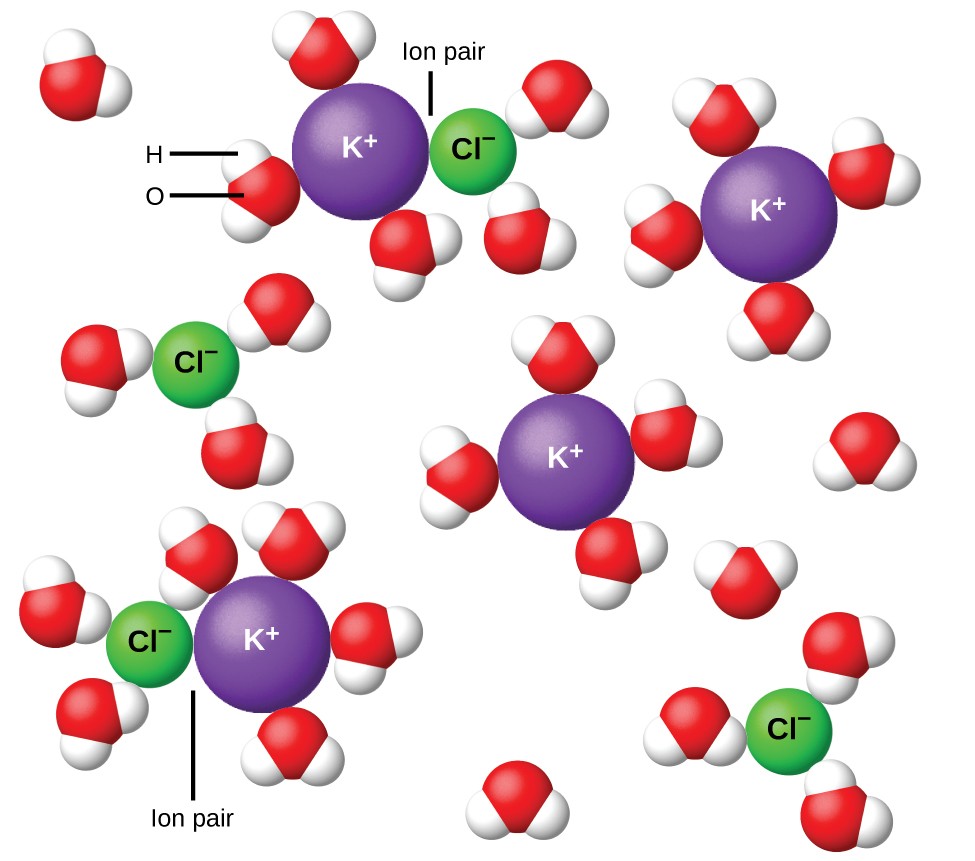
Rysunek 11. Jony stają się coraz bardziej rozdzielone, im bardziej rozcieńczony roztwór a resztkowe przyciąganie międzyjonowe maleje.
W 1923 roku chemicy Peter Debye i Erich Hückel zaproponowali teorię wyjaśniającą pozorną niepełną jonizację silnych elektrolitów. Zasugerowali, że chociaż przyciąganie międzyjonowe w roztworze wodnym jest znacznie zmniejszone przez solwatację jonów i działanie izolujące polarnego rozpuszczalnika, nie jest ono całkowicie zniwelowane. Resztkowe przyciąganie zapobiega zachowywaniu się jonów jako całkowicie niezależnych cząstek (Rysunek 11). W niektórych przypadkach jon dodatni i ujemny mogą w rzeczywistości stykać się, dając solwatowaną jednostkę zwaną parą jonową. Tak więc aktywność lub efektywne stężenie dowolnego określonego rodzaju jonu jest mniejsze niż wskazywane przez rzeczywiste stężenie. Im bardziej rozcieńcza się roztwór, im bardziej rozrzedzają się jony, a resztkowe przyciąganie międzyjonowe staje się coraz mniejsze. Zatem w skrajnie rozcieńczonych roztworach efektywne stężenia jonów (ich aktywności) są zasadniczo równe stężeniom faktycznym. Należy zauważyć, że współczynniki van’t Hoffa dla elektrolitów w tabeli 2 dotyczą roztworów 0,05 m, w których stężenie i dla NaCl wynosi 1,9, w przeciwieństwie do idealnej wartości 2.
Przykład 11: Temperatura zamarzania roztworu elektrolitu
Stężenie jonów w wodzie morskiej jest w przybliżeniu takie samo jak w roztworze zawierającym 4,2 g NaCl rozpuszczonego w 125 g wody. Załóżmy, że każdy z jonów w roztworze NaCl ma taki sam wpływ na temperaturę zamarzania wody, jak cząsteczka nieelektrolitu i określ temperaturę zamarzania roztworu (która jest w przybliżeniu równa temperaturze zamarzania wody morskiej).
Sprawdź swoją wiedzę
Załóż, że każdy z jonów chlorku wapnia, CaCl2, ma taki sam wpływ na temperaturę zamarzania wody, jak cząsteczka nieelektrolitu. Oblicz temperaturę zamarzania roztworu 0,724 g CaCl2 w 175 g wody.
Spróbuj
- Mięso można klasyfikować jako świeże (nie mrożone), mimo że jest przechowywane w temperaturze -1 ° C. Dlaczego mięso nie miałoby zamarznąć w tej temperaturze?
- Związek organiczny ma skład 93,46% C i 6,54% masowego H. Roztwór 0,090 g tego związku w 1,10 g kamfory topi się w temperaturze 158,4 ° C. Temperatura topnienia czystej kamfory wynosi 178,4 ° C. Kf dla kamfory wynosi 37,7 ° C / m. Jaki jest wzór cząsteczkowy substancji rozpuszczonej? Pokaż swoje obliczenia.
- Wiadomo, że sól jest fluorkiem metalu alkalicznego. Szybkie przybliżone określenie temperatury krzepnięcia wskazuje, że 4 g soli rozpuszczonej w 100 g wody daje roztwór, który zamarza w temperaturze około -1,4 ° C. Jaka jest formuła soli? Pokaż swoje obliczenia.
Glosariusz
Aktywność: efektywne stężenie jonów w roztworze; jest niższe niż rzeczywiste stężenie, z powodu interakcji jonowych.
podwyższenie temperatury wrzenia: podwyższenie temperatury wrzenia cieczy przez dodanie substancji rozpuszczonej
stała podwyższenia temperatury wrzenia: stała proporcjonalności w równaniu odnoszącym się do podniesienia temperatury wrzenia do molalności substancji rozpuszczonej; znana również jako stała ebulioskopowa
właściwość koligacyjna: właściwość roztworu, która zależy tylko od stężenia substancji rozpuszczonej
krenowanie: proces, w którym komórki biologiczne kurczą się z powodu utraty wody przez osmozę
obniżenie temperatury zamarzania: obniżenie temperatury zamarzania cieczy przez dodanie substancji rozpuszczonej
stała obniżenia temperatury zamarzania: (również stała krioskopowa) stała proporcjonalności w równaniu obniżenie temperatury zamarzania w celu rozpuszczenia molalności
hemoliza: pęknięcie czerwonych krwinek w wyniku gromadzenia się nadmiaru wody w wyniku osmozy
hipertoniczny: o wyższym ciśnieniu osmotycznym
hipotoniczny : o mniejszym ciśnieniu osmotycznym
para jonowa: solwatowana para anion / kation utrzymywana razem przez umiarkowane przyciąganie elektrostatyczne
izotoniczny: o jednakowym ciśnieniu osmotycznym
molalność (m) : jednostka stężenia zdefiniowana jako stosunek liczby moli substancji rozpuszczonej do masy rozpuszczalnika w kilogramach
ułamek molowy (X): stosunek ilości molowej składnika roztworu do całkowitej liczby moli wszystkich składników roztworu
osmoza: dyfuzja cząsteczek rozpuszczalnika przez półprzepuszczalną membranę
ciśnienie osmotyczne (Π ): przeciwne ciśnienie wymagane, aby zapobiec przenoszeniu cząsteczek rozpuszczalnika w masie przez membranę półprzepuszczalną
Prawo Raoulta: ciśnienie cząstkowe wywierane przez składnik roztworu jest równe iloczynowi ułamka molowego składnika w roztworze i jego równowagi prężność pary w stanie czystym
membrana półprzepuszczalna: membrana, która wybiórczo przepuszcza określone jony lub cząsteczki
współczynnik van’t Hoffa (i): stosunek liczby moli cząsteczek w roztworze do liczby moli jednostek formuły rozpuszczonych w roztworze
- Nieelektrolit pokazany dla porównania. ↵

