- Obecność wysokich stężeń przeciwciał (miano > 1: 640) powinna wzbudzić podejrzenie, że choroba autoimmunologiczna jest teraźniejszość. W tym scenariuszu zalecam następnie przebadanie surowic pod kątem przeciwciał przeciwko dsDNA, Sm, RNP, Ro (SS-A), La (SS-B) i być może Scl-70. Obecność przeciwciał przeciwko którymkolwiek z nich znacznie zwiększa prawdopodobieństwo, że pacjent ma SLE, MCTD, Sjögrena lub twardzinę skóry. Niektóre laboratoria będą automatycznie testować te przeciwciała, gdy tylko przesiewowa ANA będzie pozytywna. Jednak obecność tych przeciwciał nie świadczy o chorobie. Jeśli nie można postawić wstępnej diagnozy, praktykuję uważne obserwowanie pacjenta w miarę upływu czasu pod kątem rozwoju choroby związanej z ANA i obserwowanie go co najmniej dwa razy w roku.
- Połączenie niskich mian przeciwciał (< 1:80) i brak oznak lub symptomów choroby lub ich nieliczne wskazują na znacznie mniejsze prawdopodobieństwo wystąpienia choroby autoimmunologicznej. W rezultacie pacjenci z niskim mianem ANA muszą być poddawani ponownej ocenie rzadziej – co roku, chyba że objawy kliniczne ewoluują, by sugerować chorobę autoimmunologiczną.
- Pacjent z ujemnym wynikiem ANA jest bardzo mało prawdopodobne, aby miał SLE lub MCTD. , Sjögrena lub twardziny skóry. Jeśli jednak nadal istnieją mocne dowody kliniczne na układową chorobę autoimmunologiczną, można zbadać obecność swoistych przeciwciał przeciwko dwuniciowemu (ds) DNA, Sm, RNP, Ro, La lub Scl-70, chociaż z mojego doświadczenia wynika, że są zazwyczaj negatywne. Niemniej jednak rozsądnie jest obserwować takich pacjentów, u których występuje wysoki kliniczny wskaźnik podejrzenia, przynajmniej raz w roku – chociaż częściej, jeśli jest to klinicznie wskazane.
- Przeciwciała przeciwjądrowe wytwarzają szeroki zakres wzorów barwienia (jednorodne, rozproszone , obwodowy, brzegowy, nakrapiany, jąderkowy, anticentromer itp.). Stwierdzono, że wzór barwienia jądra ma stosunkowo niską czułość i swoistość dla różnych zaburzeń autoimmunologicznych. Obecność przeciwciał skierowanych przeciwko określonym antygenom jądrowym jest zwykle bardziej przydatna. (Te przeciwciała obejmują następujące: dsDNA, Sm, RNP, Ro, La lub Scl-70.)
W ciągu ostatnich kilku lat badacze i firmy biotechnologiczne opracowywały fazę stałą testy immunologiczne zastępujące test IF ANA.4-23 Uzasadnienie tej próby wiąże się z charakterystyką wydajności techniki IF. Ten test jest bardzo pracochłonny i podlega zmianom z powodu różnych interpretacji przez techników. Komplikuje również testowanie blaknięcia obrazu podczas badania w mikroskopie fluorescencyjnym. Ponadto technika IF wykorzystuje seryjne rozcieńczenia surowic pacjentów, co może dać wyniki, które mogą nie być liniowe. Dwukrotne wahania miana są częste w codziennych testach na tej samej próbce; czterokrotne różnice są określane jako „znaczące”. Z drugiej strony, testy immunologiczne na fazie stałej są zautomatyzowane i wysoce powtarzalne. Wyniki są liniowe, a technika jest mniej pracochłonna, a zatem tańsza w wykonaniu.
Ze względu na powyższe rozważania, powinny być oszczędności ekonomiczne w wykorzystując test immunologiczny na fazie stałej do ilościowego oznaczania ANA. Tak więc, próbując opracować testy immunologiczne na obecność ANA w fazie stałej, szereg grup umieściło na fazie stałej wszelkie antygeny, które są zwykle oznaczane w bardziej specyficznych testach immunologicznych ANA (np. DNA, Sm, RNP, Ro / SSA, La / SSB, nukleoproteina, ekstrakty komórkowe itp.) W opublikowanych raportach współczynnik korelacji między mianami ANA a tymi oznaczeniami w fazie stałej jest całkiem dobry. Dlatego wiele firm komercyjnych zmieniło swoje ANA do tych testów immunologicznych w fazie stałej.4-23 Jednak niepokojąca jest wysoka częstotliwość / odsetek wyników fałszywie ujemnych u pacjentów ze znanym SLE i chorobami pokrewnymi, jak również utrzymująca się wysoka częstość występowania „fałszywie dodatnich” (np. pozytywna ANA w kimś bez SLE) w tych badaniach.15-21 Potrzebne są dalsze prace w celu poprawy czułości, a zwłaszcza swoistości tych testów immunologicznych na fazie stałej, aby zapewnić, że pacjenci ze SLE i chorobami pokrewnymi nie zostaną pominięci przez te testy immunologiczne w fazie stałej.
Przeciwciała przeciwko DNA
Przeciwciała przeciwko DNA można przede wszystkim podzielić na te, które reagują z jednoniciowym (ss) DNA i te, które rozpoznają dsDNA.24-26
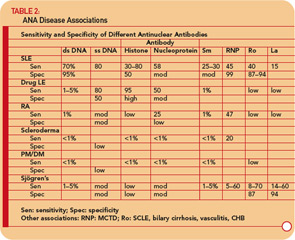
Anty- Przeciwciała ssDNA opisywano w SLE, reumatoidalnym zapaleniu stawów, toczniu związanym z lekami, u zdrowych krewnych pacjentów ze SLE i, rzadziej, w innych chorobach reumatycznych. (Patrz Tabela 2, str. 17.) Zatem anty-ssDNA ma ograniczoną przydatność w diagnostyce SLE lub innych chorób reumatycznych. Anty-ssDNA nie koreluje dobrze z aktywnością choroby i dlatego nie jest użyteczne w leczeniu choroby.
Przeciwciała przeciwko dsDNA są najczęściej wykrywane za pomocą testów immunologicznych na fazie stałej, ale także w niektórych laboratoriach za pomocą testu Crithidia IF lub od czasu do czasu test radioimmunologiczny Farra.Większość laboratoriów szpitalnych i komercyjnych wykonuje tylko jedno. Test Farra ma prawdopodobnie najwyższą specyficzność i najniższą czułość spośród trzech testów do diagnozy SLE, podczas gdy testy w fazie stałej mają najwyższą czułość i najniższą specyficzność; test Crithidia znajduje się pomiędzy. Test Farra ma również tę wadę, że wykorzystuje materiał radioaktywny, którego większość laboratoriów unika, a test na krytydynie jest bardzo pracochłonny. Preferuję test ELISA do codziennego użytku.
Anty-dsDNA są specyficzne (95%), chociaż nie są bardzo czułe (70%) dla SLE, co czyni je bardzo przydatnymi w diagnostyce, gdy są dodatnie.9 (patrz Tabela 2 , str. 17) .Od czasu do czasu występują w innych stanach, w tym reumatoidalnym zapaleniu stawów, młodzieńczym zapaleniu stawów, toczniu polekowym, autoimmunologicznym zapaleniu wątroby, a nawet u osób zdrowych.
Miana przeciwciał anty-dsDNA często ulegają wahaniom z aktywnością choroby, zwłaszcza zapaleniem nerek w przebiegu tocznia, i dlatego są przydatne u wielu pacjentów do śledzenia przebiegu SLE. Jeśli miano pacjenta wzrasta lub jest bardzo wysokie, ale klinicznie jest spokojne, nie leczę nieprawidłowości serologicznych, ale uważam to za znak ostrzegawczy, że należy uważniej obserwować pacjenta i leczyć, gdy dzieje się coś klinicznego uzasadniającego zmiana w terapii. Jednak niektórzy badacze leczyli te nieprawidłowości serologiczne (zwłaszcza gdy są związane z niskim poziomem dopełniacza) i zgłaszali lepsze wyniki kliniczne. I odwrotnie, używam spadającego miana u osoby, która poprawia się po zaostrzeniu leczenia, jako przewodnika w zmniejszaniu leczenia (np. Kortykosteroidy i / lub leki immunosupresyjne).
Związek między przeciwciałami anty-dsDNA a innymi objawy chorobowe SLE są znacznie mniej wyraźne. Na przykład nie ma związku między mianem anty-dsDNA a aktywnością chorobową neuropsychiatrycznego SLE.
Odróżnienie objawów aktywnego tocznia od powikłań infekcyjnych lub toksycznego działania leków – i od chorób niezwiązanych z chorobą – jest zawsze wyzwaniem. Obecność przeciwciał anty-dsDNA może być pomocna u niektórych pacjentów w dokonaniu tego rozróżnienia.
Przeciwciała anty-Smitha i anty-rybonukleoproteinowe
Przeciwciała przeciwko Smithowi (Sm) i anty-rybonukleoproteinie (anty-RNP) są najczęściej wykrywane za pomocą testów immunologicznych w fazie stałej.24,27
Przeciwciała anty-Sm występują tylko u 10% do 40% pacjentów z SLE, ale są one bardzo rzadkie u pacjentów z inne stany (tj. nie są wrażliwe, ale są wysoce specyficzne). Pomiar miana przeciwciał anty-Sm może być przydatny diagnostycznie, szczególnie w czasie, gdy przeciwciała anty-DNA są niewykrywalne. Biorąc jednak pod uwagę stosunkowo niską czułość anty-Sm, wartość ujemna w żaden sposób nie wyklucza rozpoznania SLE.
Przeciwciała anty-RNP stwierdza się u około 40% do 60% pacjentów ze SLE, ale nie są specyficzne dla SLE, będąc cechą definiującą MCTD. Te przeciwciała mogą również występować w niskich mianach i niskich częstotliwościach w innych chorobach reumatycznych, w tym w RZS i twardzinie skóry. (Patrz Tabela 2, str. 17.)
Ani miano (poziomy) przeciwciał anty-Sm, ani anty-RNP nie koreluje z jakąkolwiek aktywnością kliniczną.
Anty-Ro / SSA i przeciwciała anty-La / SSB
Przeciwciała przeciwko Ro / SSA i La / SSB są najczęściej wykrywane za pomocą testów immunologicznych w fazie stałej.28,29 Wykryto anty-Ro / SSA i anty-La / SSB z dużą częstością u pacjentów z zespołem Sjögrena i SLE, ale także u pacjentów z nadwrażliwym zapaleniem skóry oraz u 0,1% do 0,5% zdrowych dorosłych.
Przeciwciała anty-Ro / SSA stwierdza się u około 50% pacjentów ze SLE. (Patrz Tabela 2, str. 17.) Były one związane z nadwrażliwością na światło, podostrym toczniem skórnym, zapaleniem naczyń krwionośnych skóry (wyczuwalna plamica), śródmiąższową chorobą płuc, toczniem noworodkowym i wrodzonym blokiem serca. Przeciwciała anty-Ro / SSA występują u około 75% pacjentów z pierwotnym zespołem Sjögrena (patrz Tabela 2, str. 17), a wysokie miana tych przeciwciał są związane z większą częstością występowania cech pozagruczołowych, zwłaszcza plamicy i zapalenia naczyń. Natomiast przeciwciała Ro / SSA są obecne tylko u 10% do 15% pacjentów z wtórnym zespołem Sjögrena związanym z reumatoidalnym zapaleniem stawów. Dlatego obecność przeciwciał Ro / SSA lub anty-La / SSB u pacjentów z podejrzeniem pierwotnego zespołu Sjögrena silnie wspiera rozpoznanie.
Około 50% pacjentów ze SLE, którzy mają przeciwciała anty-Ro, ma również Przeciwciało -La, blisko spokrewniony antygen białkowy RNA. Podobnie większość pacjentów z zespołem Sjögrena ma również przeciwciała anty-La (SSB). Niezwykle rzadko można znaleźć pacjentów z przeciwciałami anty-La bez przeciwciał anty-Ro.
Moim zdaniem wskazania do zamówienia testu na przeciwciała anty-Ro / SSA i anty-La / SSB są następujące:
- Kobiety z TRU, które są w ciąży lub może zajść w ciążę w przyszłości;
- Kobiety, które w przeszłości rodziły dziecko z blokiem serca lub zapaleniem mięśnia sercowego;
- Pacjenci z niewyjaśnionymi wykwitami skórnymi nadwrażliwości na światło w wywiadzie;
- Pacjenci z silnym podejrzeniem SLE, ale z ujemnym wynikiem testu ANA; lub
- Pacjenci z objawami kserostomii, suchego zapalenia rogówki i spojówki i / lub powiększenia ślinianek i gruczołów łzowych.
Przeciwciała przeciwiribosomalne białku P
Anty- Przeciwciała rybosomalnego białka P wykryto u 10% do 20% pacjentów ze SLE w Stanach Zjednoczonych i 40% do 50% pacjentów pochodzenia azjatyckiego ze SLE, ale rzadko w innych chorobach reumatycznych.30 Przeciwciała przeciw rybosomalnemu białku P mogą być silnie specyficzne dla psychozy związanej z toczniem, chociaż nie wszystkie badania to potwierdziły. W niektórych małych badaniach depresja oraz zaangażowanie nerek i wątroby u pacjentów z toczniem były również związane z przeciwciałami przeciwko rybosomalnemu białku P.
Ze względu na niską czułość i słabą korelację kliniczną wielu badaczy – w tym ja – widzi niewielka przydatność kliniczna w tym teście.
Przeciwciała przeciw centromerowi
Przeciwciała przeciw centromerowi (ACA) stwierdza się prawie wyłącznie u pacjentów z ograniczoną skórną twardziną układową (lcSSc), zwłaszcza u CREST.31 ACA obserwowano u 57% pacjentów z CREST, ale obserwowano je również u pacjentów z innymi schorzeniami, w tym u niektórych pacjentów z samym objawem Raynauda. ACA są zazwyczaj wykrywane przez charakterystyczny wzór IF na komórkach Hep-2.
Przeciwciała anty-Scl-70 (topoizomeraza-1)
Około 15% do 20% pacjentów z twardziną skóry mają przeciwciała przeciwko białku 70 kD (topoizomeraza-1), nazwanym później Scl-70.31. Zwykłą metodą wykrywania jest ELISA. Obecność tych przeciwciał wydaje się zwiększać ryzyko włóknienia płuc u pacjentów z twardziną skóry i jest dość specyficzna dla tej choroby.
Podsumowanie
Jeśli podejrzewa się TRU na podstawie wywiadu, badanie i pełną morfologię krwi (np. leukopenia, trombocytopenia), poproś o test ANA. Jeśli wynik jest negatywny, jest bardzo mało prawdopodobne, że pacjent ma SLE i można go uspokoić. Jeśli miano jest < 1: 160, TRU jest mało prawdopodobne i można zapewnić pacjenta, że SLE jest mało prawdopodobny, ale należy go okresowo obserwować. Miano ≥1: 160 zwiększa prawdopodobieństwo SLE i powiązanych zaburzeń. Jednak ważne jest, aby pamiętać, że 85% osób z pozytywną ANĄ nie ma SLE. Jeśli ANA jest dodatnia, należy również zbadać przeciwciała przeciwko dsDNA, Sm, RNP, Ro / SSA i La / SSB. Obecność tych przeciwciał znacznie zwiększa prawdopodobieństwo, że pacjent ma SLE i powiązane z nim zaburzenia (patrz Tabela 2, str. 17) i wymaga dokładniejszej obserwacji. Wykrywanie przeciwciał anty-centromerowych i anty-Scl-70 jest bardzo przydatne w diagnostyce twardziny skóry. Wykrywanie przeciwciał przeciwko Ro / SSA i La / SSB jest również przydatne w diagnostyce zespołu Sjögrena.
Jedynym z tych testów przydatnych do monitorowania aktywności jest anty-dsDNA.
Podziękowanie: Jestem wdzięczny pracy wielu autorów UpToDate in Medicine, których praca dostarczyła użytecznych ram dla opracowania tego artykułu, a także dr. Robert Shmerling, David Lee i Donald Bloch, z którymi napisałem artykuły i rozdziały na ten sam temat.
Dr. Schur jest profesorem medycyny w Harvard Medical School oraz wydziałem reumatologii, immunologii i alergii na wydziale medycyny Brigham and Women’s Hospital w Bostonie.
- Reichlin M. Pomiar i znaczenie kliniczne przeciwciała przeciwjądrowe. Aktualny. Październik 2008.
- American College of Rheumatology Ad Hoc Committee on Immunologic Testing Guidelines. Wytyczne dotyczące laboratoryjnych badań immunologicznych w chorobach reumatycznych: wprowadzenie. Zapalenie stawów. 2002; 47: 429-433.
- Solomon DH, Kavanaugh AJ, Schur PH, et al. Oparte na faktach wytyczne dotyczące stosowania testów immunologicznych: testowanie przeciwciał przeciwjądrowych. Zapalenie stawów. 2002; 47: 434-444.
- Sinclair D, Saas M, Williams D, Hart M, Goswami R. Czy ELISA może zastąpić immunofluorescencję w wykrywaniu przeciwciał przeciwjądrowych? – Rutynowe stosowanie anty -Jądrowe testy przesiewowe przeciwciał ELISA. Clin Lab. 2007; 53: 183-191.
- Avaniss-Aghajani E, Berzon S, Sarkissian A. Wartość kliniczna multipleksowanych testów immunologicznych opartych na kulkach do wykrywania autoprzeciwciał na antygeny jądrowe. Clin Vaccine Immunol. 2007; 14: 505-509.
- Copple SS, Martins TB, Masterson C, Joly E, Hill HR. Porównanie trzech multipleksowych testów immunologicznych do wykrywania przeciwciał na możliwe do ekstrakcji przeciwciała jądrowe przy użyciu klinicznie zdefiniowanych surowic. Ann N Y Acad Sci.2007; 1109: 464-472.
- Caramaschi P, Ruzzenente O, Pieropan S, et al. Określenie swoistości ANA przy użyciu multipleksowego fluorescencyjnego testu immunologicznego z mikrosferami u pacjentów z dodatnim mianem ANA w wysokich mianach po leczeniu infliksymabem: wyniki wstępne. Rheumatol Int. 2007; 27: 649-654.
- Biagini RE, Parks CG, Smith JP, Sammons DL, Robertson SA. Analityczne wykonanie testu AtheNA MultiLyte ANA II w surowicach od pacjentów z toczniem z wieloma dodatnimi ANA. Anal Bioanal Chem. 2007; 388: 613-618.
- Gonzalez C, Garcia-Berrocal B, Perez M, et al. Laboratoryjne badanie przesiewowe chorób tkanki łącznej za pomocą nowego zautomatyzowanego testu przesiewowego ENA (EliA Symphony) u pacjentów zdefiniowanych klinicznie. Clin Chim Acta. 2005; 359: 109-114.
- Eissfeller P, Sticherling M, Scholz D, et al. Porównanie różnych systemów testowych do jednoczesnego wykrywania autoprzeciwciał w chorobach tkanki łącznej. Ann N Y Acad Sci. 2005; 1050: 327-339.
- Smith J, Onley D, Garey C, et al. Określenie specyficzności ANA z wykorzystaniem platformy UltraPlex. Ann N Y Acad Sci. 2005; 1050: 286-294.
- Martins TB, Burlingame R, von Muhlen CA, et al. Ocena multipleksowego testu immunologicznego z mikrosferą fluorescencyjną do wykrywania autoprzeciwciał na antygeny jądrowe. Clin Diagn Lab Immunol. 2004; 11: 1054-1059.
- Bernardini S, Infantino M, Bellincampi L, et al. Badanie przesiewowe przeciwciał przeciwjądrowych: Porównanie enzymatycznego testu immunologicznego opartego na homogenatach jądrowych, oczyszczonych lub rekombinowanych antygenach i teście immunofluorescencyjnym. Clin Chem Lab Med. 2004; 42: 1155-1160.
- Nossent H, Rekvig OP. Badania przesiewowe przeciwciał przeciwjądrowych w nowym tysiącleciu: Pożegnanie z mikroskopem? Scand J Rheumatol. 2001; 30: 123-126; dyskusja 127-128.
- Lopez-Hoyos M, Rodriguez-Valverde V, Martinez-Taboada V. Wykonanie badania przesiewowego tkanki łącznej przeciwciał przeciwjądrowych. Ann N Y Acad Sci. 2007; 1109: 322-329.
- Ghillani P, Rouquette AM, Desgruelles C, et al. Ocena testu przesiewowego LIAISON ANA do badania przeciwciał przeciwjądrowych w chorobach autoimmunologicznych. Ann N Y Acad Sci. 2007; 1109: 407-413.
- Bonilla E, Francis L, Allam F, et al. Mikroskopia immunofluorescencyjna jest lepsza od kulek fluorescencyjnych do wykrywania reaktywności przeciwciał przeciwjądrowych u pacjentów z toczniem rumieniowatym układowym. Clin Immunol. 2007; 124: 18-21.
- Nifli AP, Notas G, Mamoulaki M, et al. Porównanie multipleksowego testu fluorescencyjnego opartego na kulkach i metod immunofluorescencyjnych do wykrywania autoprzeciwciał ANA i ANCA w ludzkiej surowicy. J Immunol Methods. 2006; 311: 189-197.
- Shovman O, Gilburd B, Zandman-Goddard G, et al. Multipleksowany wielolitowy test immunologiczny AtheNA do badań przesiewowych ANA w chorobach autoimmunologicznych. Autoimmunizacja. 2005; 38: 105-109.
- Ulvestad E. Charakterystyka wydajnościowa i użyteczność kliniczna hybrydowego testu ELISA do wykrywania ANA. Apmis. 2001; 109: 217-222.
- Olaussen E, Rekvig OP. Testy przesiewowe na obecność przeciwciał przeciwjądrowych (ANA): Selektywne wykorzystanie centralnych antygenów jądrowych jako racjonalna podstawa do badań przesiewowych metodą ELISA. J Autoimmun. 1999; 13: 95–102.
- Homburger HA, Cahen YD, Griffiths J, Jacob GL. Wykrywanie przeciwciał przeciwjądrowych: ocena porównawcza testów immunoenzymatycznych i metod immunofluorescencji pośredniej. Arch Pathol Lab Med. 1998; 122: 993-999.
- Gniewek RA, Stites DP, McHugh TM, Hilton JF, Nakagawa M. Porównanie metod testowania przeciwciał przeciwjądrowych: test immunofluorescencyjny a test immunoenzymatyczny. Clin Diagn Lab Immunol. 1997; 4: 185-188.
- Reichlin M. Antibodies to DNA, SM i RNP. Aktualny. Październik 2008.
- Hahn BH. Przeciwciała do DNA. New Engl J Med. 1998; 338: 1359.
- Kavanaugh AF, Solomon DH, American College of Rheumatology Ad Hoc Committee on Immunologic Testing Guidelines. Wytyczne dotyczące laboratoryjnych testów immunologicznych w chorobach reumatycznych: testy na obecność przeciwciał anty-DNA. Zapalenie stawów. 2002; 47: 546-555.
- Benito-Garcia E, Schur PH, Lahita R. Wytyczne dotyczące immunologicznych testów laboratoryjnych w chorobach reumatycznych: testy przeciwciał anty-Sm i anty-RNP. Zapalenie stawów. 2004; 51: 1030-1044.
- Reichlin M. Kliniczne znaczenie przeciwciał anty-Ro / SSA i anty-La / SSB. Aktualny. Październik 2008.
- Reveille JD, Sherrer YRS, Solomon DH, Schur P, Kavanaugh A. Oparte na dowodach wytyczne dotyczące stosowania immunologicznych testów laboratoryjnych: Anti-Ro (SS-A) i La (SS- B): Raport komitetu ad hoc ACR ds. Wytycznych dotyczących badań immunologicznych. Przedłożono do publikacji.
- Reichlin M. Przeciwciała przeciwko białku P antyiribosomalne. Aktualny. Październik 2008 r.
- Denton CP. Klasyfikacja twardziny skóry. Aktualny. Październik 2008 r.