US Pharm. 2013; 38 (11) (Oncology suppl): 3-6.
SAMMANFATTNING: Anemi är en vanlig komplikation hos patienter med cancer. Det kan orsakas av antingen själva tumören eller den terapeutiska regimen som används. Villkorets svårighetsgrad och förekomst varierar beroende på ett antal faktorer. Behandlingen syftar till att öka blodets syrebärande förmåga, minska trötthet och förbättra patientens övergripande livskvalitet. Erytropoesstimulerande medel, järntillskott och röda blodkroppstransfusioner har alla rekommenderats i olika miljöer. Medan dessa har visat sig vara fördelaktiga hos vissa patienter, är den optimala terapeutiska modaliteten ännu inte fastställd.
Anemi är en viktig orsak till sjuklighet hos patienter med cancer, kopplad till dålig fysisk prestanda, prognos och terapeutiskt resultat.1 Enligt World HealthOrganization ( WHO), anemi definieras som en hemoglobinnivå (Hb) av < 12 g / dL hos icke-gravida kvinnor och < 13 g / dL hos män ≥15 år.2
Epidemiologi
Anemi är en av de vanligaste manifestationerna hos patienter med cancer. I själva verket har det visat sig att 30-90% av alla cancerpatienter är anemiska, en siffra som är beroende av typen av cancer och definitionen av anemi som används.3 Incidensen och svårighetsgraden av anemi beror på ett antal faktorer, som listas i TABELL 1.4,5

Etiologi
Huvudorsaken till anemi hos cancerpatienter är tvåfaldig: själva cancern och den terapi som används för att hantera cancer.Cancerceller som infiltrerar benmärgen kan direkt undertrycka matopoies och orsaka anemi. Dessutom frigör cancercellerna cytokiner som kan leda till järnbindning, vilket minskar produktionen av röda blodkroppar (RBC). Tumörer kan leda till kronisk blodförlust från tumörstället, vilket leder till progressiv anemi från cancer och organskada.6
Detta problem förvärras av blodförluster, näringsbrist, hemolys, endokrina störningar, ärftlig sjukdom, njurinsufficiens eller närvaron av inflammatoriska cytokiner associerade med cancer och kronisk sjukdom.4,6 Cancerpatienter tenderar att tappa aptiten, vilket leder till näringsbrister. Hos patienter med gastrointestinala (GI) tumörer leder malabsorption av näringsämnen också till brister. Hemolys härrör från immunförmedlade antikroppar eller förändringar i koagulationsförmåga. Som ett resultat är anemi en vanlig comorbiditet hos patienter som nyligen diagnostiserats med cancer. Nästan hälften av patienterna som diagnostiserats med gynekologisk cancer och en tredjedel av patienterna som diagnostiserats med icke-Hodgkin-lymfom har anemi vid diagnosen.
Dessutom är myelosuppression en av biverkningarna av kemoterapi och en signifikant bidragande faktor till anemi . Särskilt strålbehandling mot skelettet orsakar också hematologisk toxicitet och därmed anemi.6
Symtom
De vanligaste symtomen på anemi är trötthet, ansträngning i dyspné, hjärtklappning, depression, hjärtsvikt, nedsatt kognitiv funktion, yrsel och hjärtsvikt.7,8
Diagnos
Omfattningen av problemet med anemi hos cancerpatienter förstärks av suboptimala diagnostiska åtgärder, avsaknaden av en standarddefinition och faktum att orsaken ofta är multifaktoriell. 6,9A detaljerad historik som registrerar varaktigheten och tiden till symtomens början, förekomsten av comorbida tillstånd, familjehistoria och historia av exponering för antineoplastiska läkemedel och strålning bör tas. Afysisk undersökning för att kontrollera synkope, dyspné, huvudvärk, yrsel, bröstsmärtor, trötthet, onormal menstruation hos kvinnor och blekhet bör genomföras.6
National Cancer Comprehensive Network rekommenderar att aCBC utförs för patienter med en Hb < 11 g / dL eller en minskning av HB-antalet på 2 g / dL. Detta är användbart för att bestämma om cytopenier är närvarande. En visuell granskning av perifert blodutstryk för att bekräfta storlek, form och färg på RBC rekommenderas också.6
Patofysiologi
Anemi är resultatet av en kombination av minskad cirkulerande erytrocyter , minskad packad cellvolym och minskade Hb-nivåer.6 Detta kan inträffa genom olika patofysiologiska mekanismer, inklusive överdrivet blodförlust, ökad förstörelse av RBC och minskad ordenropoies.
Erytropoietin (EPO), vitamin B12, folsyra och järn är väsentligt för erytropoies. Erytropoietin kontrollerar tematurering, differentiering och överlevnad av erytroidceller under denna process.10 EPO produceras främst av njurarna och transporteras till benmärgen.11
Onormal järnmetabolism eller retention av järn i makrofager minskar mängden järn som är tillgängligt forerythropoiesis.Den förändrade metabolismen av järn orsakas främst av hepcidin, ett protein som minskar absorptionen av järn i tarmarna såväl som frisättningen av järn genom makrofagerna. Reproduktionen av hepcidin ökar av cytokiner som frigörs från tumörer, vilket minskar mängden cirkulerande järn. Det har också visats att produktionen av cytokiner såsom interleukin (IL) -6 ökas av vissa kemoterapeutiska regimer.5 Upprepade cykler av kemoterapi kan förvärra minskningen av erytropoies kumulativt.7
Eftersom syretillförseln minskar, kroppens vävnadsceller blir hypoxiska, vilket resulterar i en serie av fysiologiska reaktioner när kroppen försöker få eller upprätthålla vävnadssyring.
Man tror att det normala användningen av järncancerpatienter kan avbrytas av en interaktion mellan tumörcellerna och värdens eget immunsystem. Denna interaktion leder till uppreglering av specifika inflammatoriska cytokiner, såsom IL-1, gammainterferon och tumörnekrosfaktor alfa (TNF-α), som minskade differentieringen av erytroidprekursorer i benmärgen, stör normal järnanvändning och hämmar normal hypoxi. drivenerythropoietin produktion. Nefrotoxiska kemoterapeutiska medel kan förvärra problemet genom att orsaka nedsatt njurfunktion.
Vid kronisk anemi har tumörer visat sig frigöra ananemiinducerande faktor, en molekyl som minskar livslängden för erytrocyter. Detta förvärrar anemi till den punkt där erytropoes inte kan kompensera för RBCs sämre överlevnad. 12
Riskfaktorer för anemi i cancer
Följande riskfaktorer har identifierats för anemi vid cancer9:
- Myelosuppressiv kemoterapi eller strålterapi
- Låga Hb-nivåer (10-12 g / dL) vid initiering av cytotoxisk kemoterapi
- Administration av platina- innehåller regimer, vilket också ökar behovet av transfusionsstöd.
Behandling
Förutom en övergripande förbättring av patientens livskvalitet är behandling av anemi nödvändig för ett antal av anledningar.Anemi äventyrar leveransen av tillräckliga mängder syre till allceller, inklusive tumörceller.7 Eftersom låg vävnadsoxygenering är associerad med en minskad känslighet hos tumörer för strålning och andra former av kemoterapi, reduceras effekten av dessa behandlingar i anemi.13,14
Målet med behandlingen bör vara att öka teoxigen-bäringen blodkapacitet och behandla den bakomliggande orsaken. Underliggande tillstånd som näringsbrister är lättare att behandla än andra, såsom ockult blodförlust. Olika alternativ är tillgängliga för hantering av cancerpatienter med anemi. Dessa inkluderar15:
- Lämplig kompletterande behandling med folsyra och / eller vitamin B12 för att korrigera näringsbrister
- Erytropoies-stimulerande medel (ESA)
- Järntillskott
- Blodtransfusioner, som är indicerade för patienter med akut svår blodförlust. För patienter med kronisk anemi föredras erytropoietiska medel.
Erytropoies-stimulerande medel: ESA, inklusive rekombinant humant erytropoietin alfa (rHuEPO; Procrit, Epogen) och darbepoetin alfa (Aranesp), var utvecklades traditionellt för hantering av anemi hos patienter med kronisk njursvikt. De har visat liknande effektivitet och begränsningar vid användning av ojämförliga doser hos cancerpatienter med anemi. 5 ESA: er är indicerade för behandling av patienter vars endogena EPO-nivåer är normalt låga, eftersom ESA: s verkningssätt och immunologiska och hematologiska effekter liknar de för endogena EPO. 9 Studier genomfört på rHuEPO har visat att det förbättrar patienternas Hblevels och livskvalitet och minskar transfusionskraven.15,16 Det har föreslagits att ESA också förbättrar den kognitiva funktionen hos patienter som får kemoterapi.17
En systemisk granskning utförd av American Cancer Societyshows att optimal klinisk nytta av erytropoietisk behandling av kemoterapiinducerad anemi kan uppnås genom tidigt ingripande.18Det är helt klart en fördel med att använda ESA; emellertid bör alla andra orsaker till anemi undersökas och korrigeras innan användning av ESAtherapy.
Darbepoetin och rHuEPO är båda indikerade för behandling av anemi hos patienter med icke-myeloida maligniteter i whomanemia är relaterade till kemoterapi.5 American Society of Hematology (ASH) och American Society of Clinical Oncology (ASCO) rekommenderar att behandling inleds när Hb-nivåer sjunker under 10 g / dL och dosen minskas om det finns en lägsta ökning på 1 g / dL i Hblevels med 2 veckor.19 Syftet med behandlingen bör vara att höja Hb till den lägsta koncentrationen för att undvika transfusion. Om den minimala ökningen av 1 till 2 g / dL Hb inte uppnås efter 6 till 8 veckors behandling bör ESA-behandlingen avbrytas.18 Även om det är svårt att förutsäga patientsvar på dessa terapier med aktuell data, har det visat sig att cirka 50% till 60% av patienterna uppvisar en 2 g / dL ökning av Hb vid behandling med rHuEPO.9 ESA-behandling bör avbrytas efter avslutad kemoterapikursen.20,21
Den rekommenderade dosen för darbepoetin alfa är 2,25 mcg / kg som en subkutan (SC) injektion varje vecka. Om Hb-nivåerna inte stiger minst 1 g / dL efter 6 veckor bör dosen ökas till 4,5 mcg / kg. Om Hb-nivåerna ökar mer än 1 g / dL under en tvåveckorsperiod överstiger Hb 12 g / dL, bör dosen av darbepoetin reduceras med 40%. 20 Darbepoetin bör stoppas om Hb-nivåerna stiger över 13 g / dL. 9
Den rekommenderade dosen av rHuEPO är 40 000 U administrerad SC en gång i veckan eller 150 U / kg administrerad SC tre gånger i veckan på patienter med Hb-nivåer under 10 g / dL. Dosen av rHuEPO bör minskas med 25% om Hb-nivån ökar > 1 g / dL under en tvåveckorsperiod eller når en nivå som behövs för att undvika RBC-transfusion.21
ESA är förpackade i en injektionsflaska som inte ska skakas, eftersom de kommer att denaturera. 20,21 Innehållet i injektionsflaskan bör inte spädas eller samlas.
Riskerna med ESA-behandling bör också tagit hänsyn till. ESA antas öka negativa kardiovaskulära händelser, öka risken för venös tromboembolism, förkorta tiden till tumörprogression och minska överlevnaden hos anemiska cancerpatienter genom olika mekanismer. 22,23 Av denna anledning avskräcks användningen av ESAs hos cancerpatienter som inte genomgår behandling med kemoterapi eller strålbehandling.24 Alla ESA: er kommer med en blackbox-varning för att öka risken för dödsfall, hjärtinfarkt, stroke, venös tromboembolism, trombos av kärlåtkomst och tumorprogression och återfall.20,21 ESA APPRISE OncologyProgram har upprättats FDA att ge patienter, vårdgivare och vårdpersonal råd om säker användning av ESAs.25
Järntillskott: Järntillskott, helst parenteralt, är indicerat hos patienter med låga nivåer av offerritin (< 30 ng / ml), transferrinmättnad (TSAT < 15%) och låg (< 26 pg / cell ) retikulocyt Hb-konten t (CHr). Två typer av irondeficiency har erkänts hos anemiska cancerpatienter:
- Absolut järnbrist (AID) som uppstår vid kronisk blödning på grund av till exempel GI eller gynekologiska lesioner, blodförlust från operation, näring brister och anemi av kronisk sjukdom (ACD). Det definieras som en serumferritinnivå på < 30 mcg / L och minskad TSAT på < 15% .1
- Funktionell järnbrist (FID) som uppstår efter fortsatt erytropoietinanvändning. Det är den vanligaste orsaken till ett otillräckligt svar på ESA-behandling, särskilt hos patienter med njursvikt. Därför kommer de flesta patienter i ESA-behandling så småningom att behöva järntillskott.6
Järntillskott infördes när ESA-behandling ensam visade dåliga svarsfrekvenser hos kemoterapibehandlade patienter.1 Effekten av en kombination av IV Järn- och ESA-terapi testades och järns roll i funktionell järnbrist fastställdes.1 Medan nuvarande bevis stöder användningen av IV-järntillskott för att förbättra hemoglobinsvar hos anemiska patienter med cancer, krävs prospektiva studier om långsiktig effekt och säkerhet av IV-järn. Dessutom måste optimala doseringsregimer fastställas.5 Järn kan administreras oralt eller som parenteralformuleringar av järndextran, järnglukonat och järnsackaros med låg molekylvikt (LMW). Parenteralt administrerat järn har ett bättre svar jämfört med oralt järn.6 Det senare används därför sällan hos cancerpatienter med anemi och diskuteras inte i denna artikel. Testdoser rekommenderas för järndextran. Patienter som har uppvisat tidigare känslighet för järndextran eller andra IV-järnpreparat eller de som har flera läkemedelsallergier bör också få en testdos. TABELL 2 visar doseringsregimen för IV-järntillskott.6
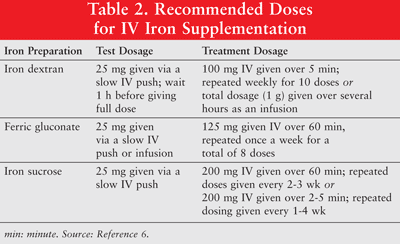
Parenteralt järn är associerat med hypotoni, illamående, kräkningar och / eller diarré, smärta, högt blodtryck, dyspné, klåda, huvudvärk och yrsel. Dessutom kan det vara obekvämt att administrera och kostsamt.9 Eftersom järndextran med hög molekylvikt (HMW) är förknippat med en högre förekomst av biverkningar än LMW järndextran, är det senare totalt sett att föredra.6
Rött Blodcellstransfusion: RBC är den föredragna blodprodukten för transfusioner för att korrigera anemi i fall av akut anemi efter blödning. Vissa patienter kan behöva en infusion som är negativ av cytomegalovirus.Målet med att använda en RBC-transfusion är att behandla eller förhindra en brist på blodets syreförmåga och transfusion är vanligtvis inte indicerat om patientens Hblevel är ≥10 g / dL.6
RBC-transfusioner erbjuder fördelen med en snabb ökning av Hb- och hematokritnivåerna omedelbart efter infusion. Det uppskattas att en transfusion av 300 ml (1 enhet) rena RBC kommer att resultera i en genomsnittlig ökning med 1 g / dL Hb eller 3% av hematokrit hos en annan vuxen normal som inte upplever samtidig blodförlust. Detta leder till en övergripande snabb förbättring av trötthet.6
Patientens blod måste korsmatchas för ABO-kompatibilitet innan RBC kan transfunderas. Om patienten behöver upprepade infusioner kan risken för biverkningar minimeras genom användning av leukocytreducerande blod och premedicinering med anantihistamin eller paracetamol.6
RBC-transfusion är inte utan risker, inklusive potentialen för transfusionsöverförd smittsam medel, transfusionsreaktioner, alloimmunisering och immunsuppression.9 Andra risker för transfusion inkluderar hjärtsvikt, ökad trombotisk händelse och järnöverbelastning.6 Det är dock bra att notera att patienter som behöver RBC-infusion under den period som motsvarar kemoterapibehandling är mycket osannolikt uppleva järnöverbelastning.6
Framtidsperspektiv
Nya strategier för att hantera anemi hos cancerpatienter bedrivs för närvarande. Även om det inte finns någon ersättning för människans blod, är forskare i färd med att utveckla produkter som har syreförmåga hos RBC. I rörledningen finns Hb-baserade oxygenbärare och perfluorkolväten.5
Slutsats
Sammantaget är det optimala tillvägagångssättet för anemi som en viktig fråga inom onkologi ännu inte fastställt. Brist på konsistens mellan vårdgivare, en tydlig definition av anemi i cancer och diagnostiska kriterier bidrar alla till detta problem.
1. Steinmetz HT. Rollen av intravenöst järn vid behandling av anemi hos cancerpatienter. Ther Adv Hematol. 2012; 3: 177-191.
2. deBenoist B, McLean E, Egli I, et al. Världsomfattande förekomst av anemi 1993–2005: WHO: s globala databas om anemi. Genève, Schweiz: Världshälsoorganisationen; 2008.
3. Knight K, Wade S, Balducci L. Prevalens och resultat av anemi i cancer: en systematisk genomgång av litteraturen. Am J Med. 2004; 116 (suppl 7A): 11S-26S.
4. Schwartz RN. Anemi hos patienter med cancer: incidens, orsaker, påverkan, hantering och användning av behandlingsriktlinjer och protokoll. Am J Health Syst Pharm. 2007; 64 (3 suppl 2): S5-S13; frågesport S28-S30.
5. Calabrich A, Katz A. Hantering av anemi hos cancerpatienter. Framtidens Oncol. 2011; 7: 507-517.
6. Rodgers GM, Becker P, Blinder M, et al. Cancer- och kemoterapiinducerad anemi. J Natl Compr Canc Netw. 2012; 10: 628-653.
7. Groopman JE, Itri LM. Kemoterapiinducerad anemi hos vuxna: incidens och behandling. J Natl Cancer Inst. 1999; 91: 1616-1634.
8. Ludwig H, Strasser K. Symptomatologi av anemi. Semin Oncol. 2001; 28: 7-14.
9. Gillespie TW. Anemi vid cancer. Cancer omvårdnad. 2003; 26: 119-128.
10. Koeller JM. Kliniska riktlinjer för behandling av cancerrelaterad anemi. Farmakoterapi. 1998; 18: 156-169.
11. Cazzola M, Mercuriali F, Brugnara C. Användning av rekombinant humant erytropoietin utanför uremismiljön. Blod. 1997; 89: 424-867.
12. Nowrousian MR, Kasper C, Oberhoff C, et al. Patofysiologi av cancerrelaterad anemi. I: Smith JF, Boogaerts MA, Ehmer B, red. Erytropoietin vid cancerstödjande behandling. New York, NY: Marcel Dekker; 1997: 13-34.
13. Vaupel P, Dunst J, Engert A, et al. Effekter av rekombinant humant erytropoietin (rHuEPO) på tumörkontroll hos patienter med cancerinducerad anemi. Onkologie. 2005; 28: 216-221.
14. Zhao KL, Liu G, Jiang GL, et al. Förening av hemoglobinnivå med sjuklighet och mortalitet hos patienter med lokalt avancerad esofagealt karcinom som genomgår strålbehandling – en sekundäranalys av tre på varandra följande kliniska fas III-studier. Clin Oncol (R Coll Radiol). 2006; 18: 621-627.
15. Glaspy JA. Utvecklingen av erytropoietiska medel inom onkologi. Expert Opin Emerg Drugs. 2005; 10: 553-567.
16. Adamson JW, Spivak JL. Fysiologisk grund för farmakologisk användning av rekombinant humant erytropoietin vid kirurgi och cancerbehandling. Kirurgi. 1994; 115: 7-15.
17. Ferrario E, Ferrari L, Bidoli P, et al. Behandling av cancerrelaterad anemi med epoetin alfa: en översyn. Cancer Treat Rev. 2004; 30: 563-575.
18. Lyman GH, Glaspy J. Finns det kliniska fördelar med tidigt erytropoietisk intervention för kemoterapiinducerad anemi? Asystematisk granskning. Cancer. 2006; 106: 223-233.
19. Rizzo JD, Brouwers M, Hurley P, et al. AmericanSociety of Clinical Oncology / American Society of Hematology klinisk praxis uppdatering av användningen av epoetin och darbepoetin hos vuxnapatienter med cancer. J Clin Oncol. 2010; 28: 4996-5010.
20. Aranesp (darbepoetin alfa) förskrivningsinformation.Thousand Oaks, CA: Amgen Inc; Maj 2012.
21. Procrit (epoetin alfa) förskrivningsinformation. Horsham, PA: Janssen Products, LP; Juli 2012.
22. Beutel G, Ganser A. Risker och fördelar med erytropoiesstimulerande medel vid cancerhantering. Semin Hematol. 2007; 44: 157-165.
23. Fenner MH, Ganser A. Erytropoietin i cancerrelaterad anemi. Curr Opin Oncol. 2008; 20: 685-689.
24. Smith RE Jr, Aapro MS, Ludwig H, et al. Darbepoetinalfa för behandling av anemi hos patienter med aktiv cancer som inte får kemoterapi eller strålbehandling: resultat av en fas III, multicenter, randomiserad, dubbelblind, placebokontrollerad studie. J Clin Oncol. 2008; 26: 1040-1050.
25. ESA APPRISE Oncology Program. Amgen och Janssen Products, LP. www.esa-apprise.com. Åtkomst till 13 oktober 2013.