Ångtryckssänkning
Som beskrivs i kapitlet om vätskor och fasta ämnen är jämviktsångtrycket hos en vätska det tryck som utövas av dess gasformiga fas när förångning och kondensation sker i lika höga hastigheter:
\ text {flytande} \ rightleftharpoons \ text {gas}
Upplösning av ett icke-flyktigt ämne i en flyktig vätska resulterar i en sänkning av vätskans ångtryck. Detta fenomen kan rationaliseras genom att beakta effekten av tillsatta lösningsmedelsmolekyler på vätskans förångnings- och kondensationsprocesser. För att kunna förångas måste lösningsmedelsmolekyler finnas på ytan av lösningen. Närvaron av löst ämne minskar den yta som är tillgänglig för lösningsmedelsmolekyler och minskar därmed hastigheten för lösningsmedelsförångning. Eftersom kondensationshastigheten inte påverkas av närvaron av löst ämne, är nettoresultatet att förångnings-kondensationsjämvikten uppnås med färre lösningsmedelsmolekyler i ångfasen (dvs vid ett lägre ångtryck) (figur 1). Även om denna kinetiska tolkning är användbar, tar den inte hänsyn till flera viktiga aspekter av ångtryckssänkande kolligativa natur. En mer rigorös förklaring involverar egenskapen till entropi, ett diskussionsämne i ett senare textkapitel om termodynamik. För att förstå sänkning av vätskans ångtryck är det tillräckligt att notera att den större entropin av en lösning jämfört med dess separata lösningsmedel och lösningsmedel tjänar till att effektivt stabilisera lösningsmedelsmolekylerna och hindra deras förångning. Ett lägre ångtryck resulterar och en motsvarande högre kokpunkt som beskrivs i nästa avsnitt i denna modul.
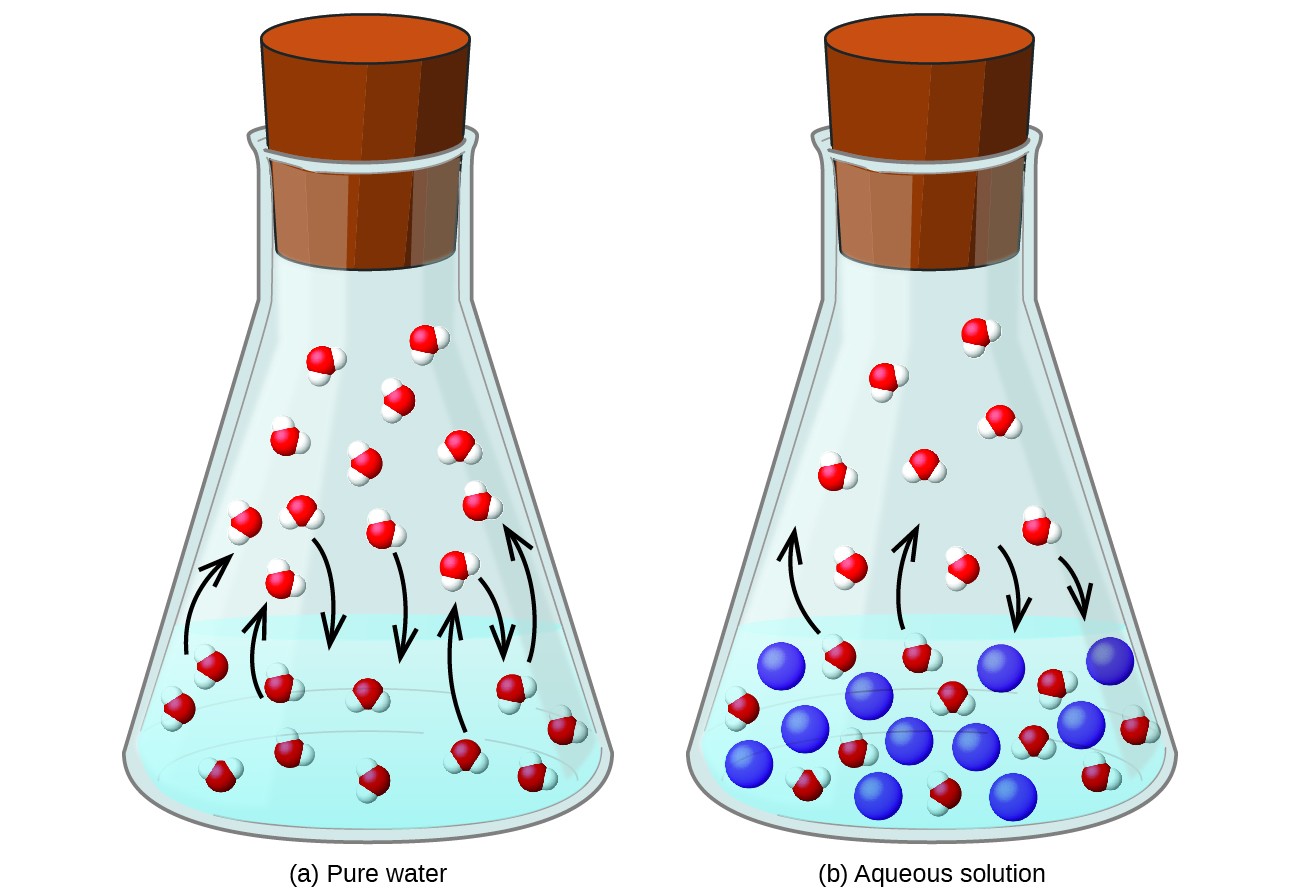
Figur 1. Förekomsten av icke-flyktiga lösningsmedel sänker ångtrycket i en lösning genom att hindra avdunstningen av lösningsmedelsmolekyler. dessa komponenter beskrivs av Raoults lag: Partialtrycket som utövas av någon komponent i en idealisk lösning är lika med ångtrycket hos den rena komponenten multiplicerat med dess molfraktion i lösningen.
{P} _ {\ text {A}} = {X} _ {\ text {A}} {P} _ {\ text {A}} ^ {\ star}
Påminner om att det totala trycket för en gasformig blandning är lika med summan av partiella tryck för alla dess komponenter (Daltons lag om partiella tryck), är det totala ångtrycket som utövas av en lösning innehållande i-komponenter
{ P} _ {\ text {lösning}} = \ sum _ {i} {P} _ {i} = \ sum _ {i} {X} _ {i} {P} _ {i} ^ {\ star}
Ett icke-flyktigt ämne är ett vars ångtryck är försumbart (P ^ {\ star} ≈ 0), och ångtrycket ovanför en lösning som endast innehåller icke-flyktiga lösta ämnen beror endast på lösningsmedlet:
{P} _ {\ text {lösning}} = {X} _ {\ text {lösningsmedel}} {P} _ {\ text {lösningsmedel}} ^ {\ stjärna}
Destillation av lösningar
Destillation är en teknik för att separera blandningskomponenter som används i stor utsträckning både i laboratoriet och i industriella miljöer. Det används för att förfina petroleum, för att isolera jäsningsprodukter och för att rena vatten. Denna separationsteknik involverar kontrollerad uppvärmning av en provblandning för att selektivt förånga, kondensera och samla en eller flera komponenter av intresse. En typisk apparat för destillationer i laboratorieskala visas i figur 2.

Figur 2. En typisk laboratoriedestillationsenheten visas i (a) ett fotografi och (b) ett schematiskt diagram över komponenterna. (kredit a: modifiering av arbete av ”Rifleman82” / Wikimedia commons; kredit b: modifiering av arbete av ”Slashme” / Wikipedia)
Oljeraffinaderier använder storskalig fraktionerad destillation för att separera komponenter av råolja. Råoljan värms upp till höga temperaturer vid basen av en lång fraktioneringskolonn, vilket förångar många av de komponenter som stiger inuti kolonnen. Eftersom förångade komponenter når tillräckligt svala zoner under sin uppstigning kondenseras de och samlas upp. De uppsamlade vätskorna är enklare blandningar av kolväten och andra petroleumföreningar som har lämplig sammansättning för olika tillämpningar (t.ex. dieselbränsle, fotogen, bensin), som avbildas i figur 3.

Figur 3. Råolja är en komplex blandning som separeras av storskalig fraktionerad destillation för att isolera olika enklare blandningar.
Kokpunktens höjd
Som beskrivs i kapitlet om vätskor och fasta ämnen är kokpunkten för en vätska den temperatur vid vilken dess ångtryck är lika med det omgivande atmosfärstrycket.Eftersom ångtrycket i en lösning sänks på grund av närvaron av icke-flyktiga lösta ämnen, är det självklart att lösningens kokpunkt därefter kommer att ökas. Jämfört med rent lösningsmedel kommer en lösning därför att kräva en högre temperatur för att uppnå vilket ångtryck som helst, inklusive en motsvarande den i den omgivande atmosfären. Ökningen av kokpunkten som observerats när icke-flyktigt löst ämne löses i ett lösningsmedel, ATb, kallas kokpunkthöjning och är direkt proportionell mot molkoncentrationen av lösta ämnen: \ Delta {T} _ {\ text {b}} = {K} _ {\ text {b}} m
där Kb är kokpunktens höjdkonstant, eller ebullioskopisk konstant och m är molkoncentration (molalitet) för alla lösta arter.
Kokpunktens höjningskonstanter är karakteristiska egenskaper som beror på lösningsmedlets identitet. Värden på Kb för flera lösningsmedel listas i tabell 1.
Hur långt ångtrycket i ett lösningsmedel sänks och kokpunkten höjs beror på det totala antalet lösta partiklar som är närvarande i en given mängd lösningsmedel, inte på partiklarnas massa eller storlek eller kemiska identitet. En 1 m vattenlösning av sackaros (342 g / mol) och en 1 m vattenlösning av etylenglykol (62 g / mol) uppvisar samma kokpunkt eftersom varje lösning har en mol lösta partiklar (molekyler) per kg lösningsmedel .
Exempel 6: Kokpunkten för en jodlösning
Hitta kokpunkten för en lösning av 92,1 g jod, I2, i 800,0 g kloroform, CHCl3 förutsatt att joden är oflyktig och att lösningen är idealisk.
Kontrollera ditt lärande
Vad är kokpunkten för en lösning på 1,0 g glycerol, C3H5 (OH) 3, i 47,8 g vatten? Antag en idealisk lösning.
Fryspunktdepression

Figur 4. Bergsalt ( NaCl), kalciumklorid (CaCl2) eller en blandning av de två används för att smälta is. (kredit: modifikation av arbete av Eddie Welker)
Lösningar fryser vid lägre temperaturer än rena vätskor. Detta fenomen utnyttjas i ”avisning” -scheman som använder salt (figur 4), kalciumklorid eller karbamid för att smälta is på vägar och trottoarer, och vid användning av etylenglykol som ”frostskyddsmedel” i bilradiatorer. Havsvatten fryser vid en lägre temperatur än färskvatten, och så förblir de arktiska och antarktiska oceanerna ofrysta även vid temperaturer under 0 ° C (liksom kroppsvätskorna hos fiskar och andra kallblodiga havsdjur som lever i dessa hav).
Minskningen i fryspunkten för en utspädd lösning jämfört med den för det rena lösningsmedlet, ATf, kallas fryspunktens fördjupning och är direkt proportionell mot den molala koncentrationen av det lösta ämnet
\ Delta {T} _ {\ text {f}} = {K} _ {\ text {f}} m
där m är den molala koncentrationen av löst ämne i lösningsmedlet och Kf kallas fryspunktens depressionskonstant (eller kryoskopisk konstant). Precis som för kokpunktens höjdkonstanter är dessa karakteristiska egenskaper vars värden beror på lösningsmedlets kemiska identitet. Värden på Kf för flera lösningsmedel anges i tabell 1.
Kolligativa egenskaper och avisning
Natriumklorid och dess grupp 2-analoger kalcium och magnesiumklorid används ofta för att avisvägar och trottoarer, på grund av det faktum att en lösning av något av dessa salter har en fryspunkt lägre än 0 ° C, fryspunkten för rent vatten. Grupp 2 metallsalter blandas ofta med den billigare och lättare tillgängliga natriumkloriden (”bergsalt”) för användning på vägar, eftersom de tenderar att vara något mindre frätande än NaCl, och de ger en större nedsänkning av fryspunkten , eftersom de dissocierar för att ge tre partiklar per formelenhet, snarare än två partiklar som natriumkloriden.
Eftersom dessa jonföreningar tenderar att påskynda metallkorrosionen, skulle de inte vara ett klokt val att använda frostskyddsmedel för kylaren i din bil eller för att avisa ett plan före start.För dessa tillämpningar används ofta kovalenta föreningar, såsom eten eller propylenglykol. Glykolerna som används i kylvätska sänker inte bara vätskans fryspunkt utan höjer kokpunkten, vilket gör vätskan användbar både vinter och sommar. Uppvärmda glykoler sprutas ofta på flygplanens yta före start vid dåligt väder på vintern för att ta bort is som redan har bildats och förhindra bildandet av mer is, vilket skulle vara särskilt farligt om det bildades på flygplanets kontrollytor (Figur 5).

Figur 5. Fryspunktsfördjupning utnyttjas för att ta bort is från (a) vägar och (b) flygplanens kontrollytor.
Fasdiagram för en lösning
De kolligativa effekterna på ångtryck, kokpunkt och fryspunkt som beskrivits i föregående avsnitt sammanfattas bekvämt genom att jämföra fasdiagrammen för en ren vätska och en lösning härledd från den vätskan. Fasdiagram för vatten och en vattenlösning visas i figur 6.
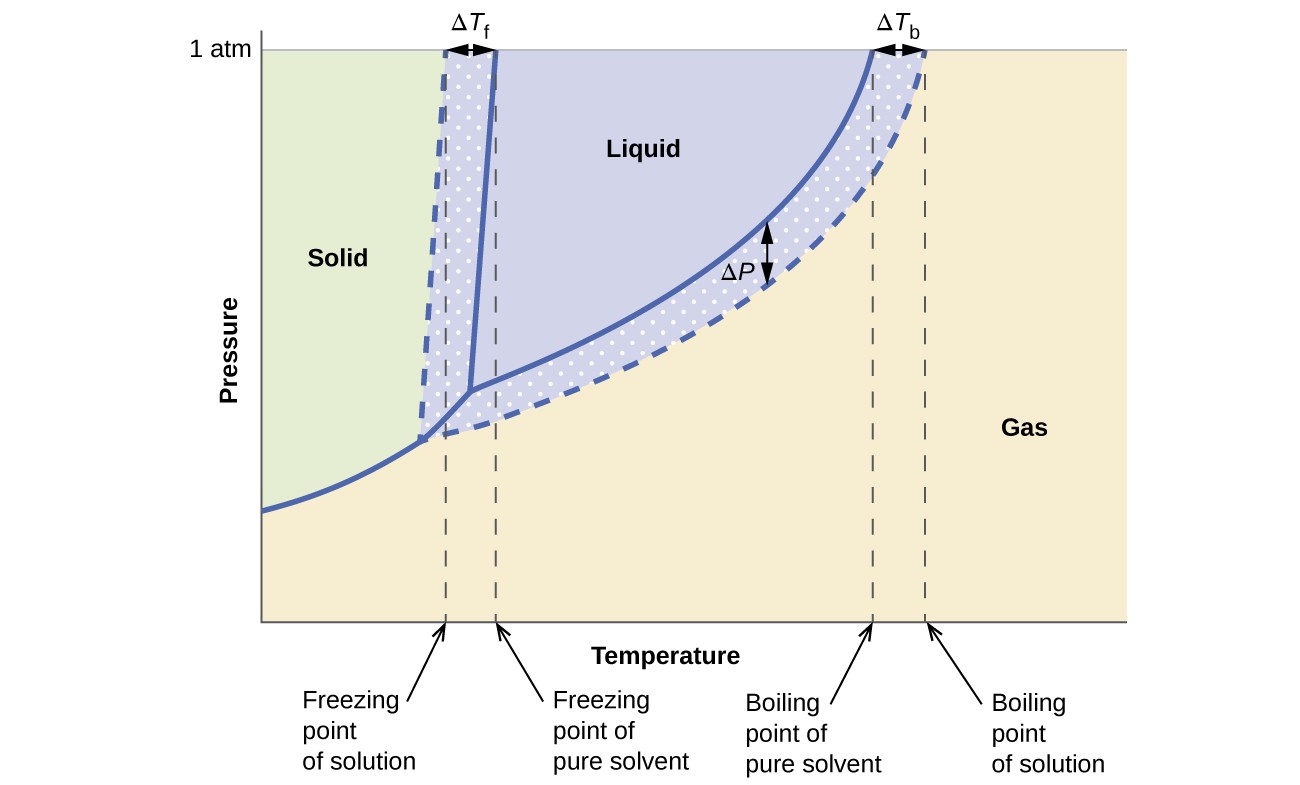
Figur 6. Dessa faser diagram visar vatten (fasta kurvor) och en vattenlösning av icke-elektrolyt (streckade kurvor).
Vätskeanångskurvan för lösningen ligger under motsvarande kurva för lösningsmedlet, som visar ångan trycksänkning, AP, som är resultatet av upplösning av icke-flyktigt löst ämne. Följaktligen observeras lösningens kokpunkt vid ett visst tryck vid en högre temperatur än för det rena lösningsmedlet, vilket återspeglar kokpunktens höjd, ATb, associerad med närvaron av icke-flyktigt löst ämne. Fast-vätskekurvan för lösningen förskjuts till vänster om den för det rena lösningsmedlet, vilket representerar fryspunktens fördjupning, ATb, som åtföljer lösningsbildning. Slutligen notera att fastgaskurvorna för lösningsmedlet och dess lösning är identiska. Detta är fallet för många lösningar som innehåller flytande lösningsmedel och icke-flyktiga lösningsmedel. Precis som för förångning, när en sådan lösning är fryst, är det faktiskt bara lösningsmedelsmolekylerna som genomgår övergången mellan vätska och fast ämne, och bildar rent fast lösningsmedel som utesluter lösta ämnen. De fasta och gasformiga faserna består därför endast av lösningsmedel och övergångar mellan dessa faser är därför inte föremål för kolligativa effekter.
Osmos och osmotiskt tryck av lösningar
Ett antal naturliga och syntetiska material uppvisar selektiv genomträngning, vilket innebär att endast molekyler eller joner av en viss storlek, form, polaritet, laddning och så vidare kan passera genom (genomtränga) materialet. Biologiska cellmembran ger eleganta exempel på selektiv genomträngning i naturen, medan dialysrör som används för att avlägsna metaboliskt avfall från blod är ett mer förenklat tekniskt exempel. Oavsett hur de kan tillverkas kallas dessa material vanligtvis semipermeabla membran.
Tänk på apparaten som illustreras i figur 7, i vilken prover av rent lösningsmedel och en lösning separeras av ett membran som endast är lösningsmedel molekyler kan genomsyra. Lösningsmedelsmolekyler kommer att diffundera över membranet i båda riktningarna. Eftersom koncentrationen av lösningsmedel är större i det rena lösningsmedlet än lösningen kommer dessa molekyler att diffundera från lösningsmedelssidan av membranet till lösningssidan i en snabbare hastighet än de kommer att göra i omvänd riktning. Resultatet är en nettoöverföring av lösningsmedelsmolekyler från det rena lösningsmedlet till lösningen. Diffusionsdriven överföring av lösningsmedelsmolekyler genom ett semipermeabelt membran är en process som kallas osmos.
Figur 7. (a) En lösning och rent lösningsmedel separeras initialt med ett osmotiskt membran. (b) Nettoöverföring av lösningsmedelsmolekyler till lösningen inträffar tills dess osmotiska tryck ger lika stora överföringshastigheter i båda riktningarna.
När osmos utförs i en apparat som den som visas i figur 7 , ökar volymen av lösningen när den späds ut genom ackumulering av lösningsmedel. Detta får lösningsnivån att stiga, vilket ökar dess hydrostatiska tryck (på grund av vikten av lösningskolonnen i röret) och resulterar i en snabbare överföring av lösningsmedelsmolekyler tillbaka till den rena lösningsmedelssidan. När trycket når ett värde som ger en omvänd lösningsmedelsöverföringshastighet lika med osmoshastigheten upphör bulköverföringen av lösningsmedlet. Detta tryck kallas lösningens osmotiska tryck (Π). Det osmotiska trycket hos en utspädd lösning är relaterat till dess lösta molaritet, M och absoluta temperatur, T, enligt ekvationen
\ Pi = MRT
där R är den universella gaskonstanten.
Om en lösning placeras i en anordning som den som visas i figur 8, vänder tryck högre än det osmotiska trycket i lösningen osmosen och skjuter lösningsmedelsmolekyler från lösningen till det rena lösningsmedlet. Denna teknik för omvänd osmos används för avsaltning av havsvatten i stor skala och i mindre skalor för att producera kranvatten med hög renhet för att dricka.
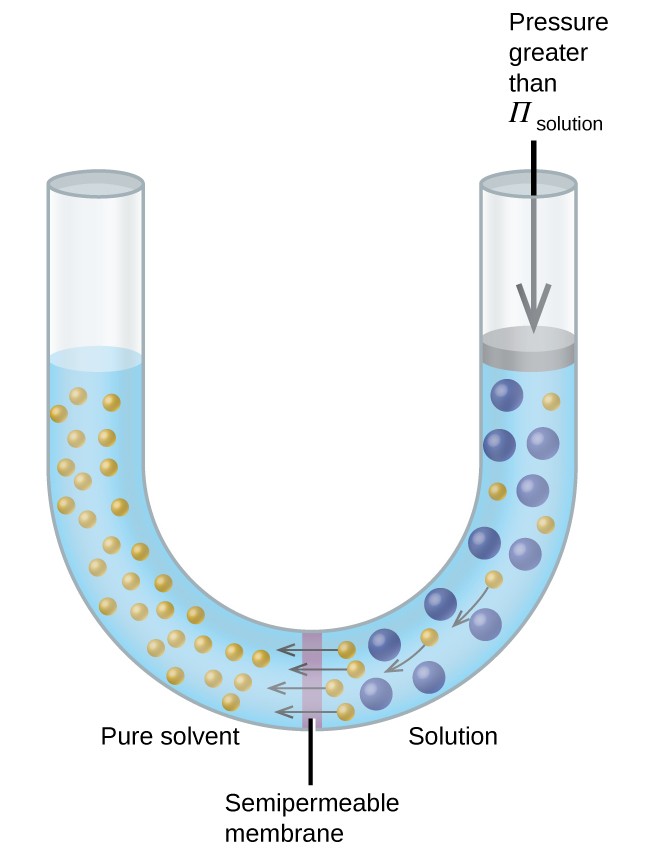
Figur 8. Att applicera ett tryck som är större än det osmotiska trycket i en lösning kommer att vända osmos. Lösningsmedelsmolekyler från lösningen skjuts in i det rena lösningsmedlet.
Omvänd osmos Vattenrening
I processen för osmos tjänar diffusion till att flytta vatten genom en semipermeabelt membran från en mindre koncentrerad lösning till en mer koncentrerad lösning. Osmotiskt tryck är den mängd tryck som måste appliceras på den mer koncentrerade lösningen för att få osmos att stoppa. Om större tryck appliceras kommer vattnet att gå från den mer koncentrerade lösningen till en mindre koncentrerad (renare) lösning. Detta kallas omvänd osmos. Omvänd osmos (RO) används för att rena vatten i många applikationer, från avsaltningsanläggningar i kuststäder, till vattenreningsmaskiner i livsmedelsbutiker (Figur 9) och mindre hushållsenheter med omvänd osmos. Med en handmanövrerad pump kan små RO-enheter användas i tredje världsländer, katastrofområden och i livbåtar. Våra militära styrkor har en mängd generatorstyrda RO-enheter som kan transporteras i fordon till avlägsna platser.

Figur 9. Omvänd osmossystem för rening av dricksvatten visas här på (a) små och (b) stora skalor. (kredit a: modifiering av arbete av Jerry Kirkhart; kredit b: modifiering av arbete av Willard J. Lathrop)
Exempel på osmos är uppenbara i många biologiska system eftersom celler är omgiven av semipermeabla membran. Morötter och selleri som har blivit slappa på grund av att de har tappat vatten kan göras skarpa igen genom att placera dem i vatten. Vatten rör sig in i morot eller selleri celler genom osmos. En gurka placerad i en koncentrerad saltlösning förlorar vatten genom osmos och absorberar lite salt för att bli en knipa. Osmos kan också påverka djurceller. Lösningskoncentrationer är särskilt viktiga när lösningar injiceras i kroppen. Lösningar i kroppsvätskor och blodserum ger dessa lösningar ett osmotiskt tryck på cirka 7,7 atm. Lösningar som injiceras i kroppen måste ha samma osmotiska tryck som blodserum; det vill säga de borde vara isotoniska med blodserum. Om en mindre koncentrerad lösning, en hypotonisk lösning, injiceras i tillräcklig mängd för att späda blodserumet, passerar vatten från det utspädda serumet in i blodkropparna genom osmos, vilket får cellerna att expandera och brista. Denna process kallas hemolys. När en mer koncentrerad lösning, en hypertonisk lösning, injiceras förlorar cellerna vatten till den mer koncentrerade lösningen, krymper och dör eventuellt i en process som kallas crenation. Dessa effekter illustreras i figur 10.
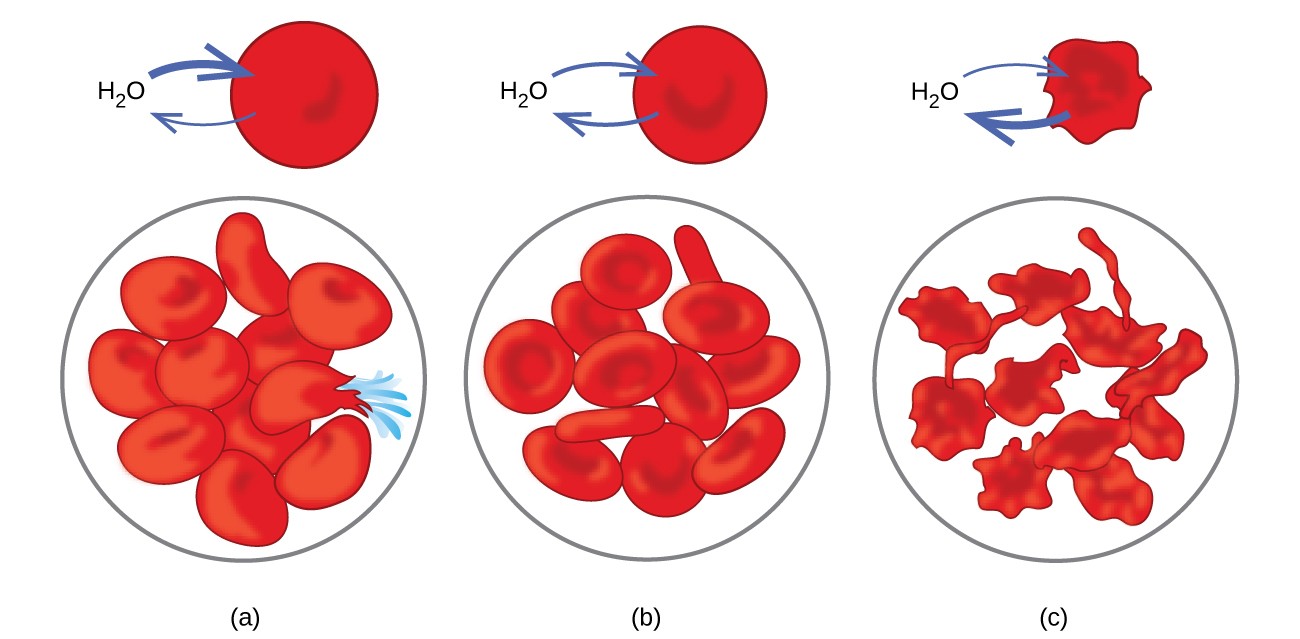
Figur 10. Röda blodkroppsmembran är vattengenomsläppliga och kommer (a) att svälla och eventuellt brista i en hypoton lösning; (b) bibehålla normal volym och form i en isoton lösning; och (c) krympa och eventuellt dö i en hypertonisk lösning. (kredit a / b / c: modifieringar av arbete av ”LadyofHats” / Wikimedia commons)
Bestämning av molmassor
Osmotiskt tryck och förändringar i fryspunkt, kokpunkt punkt och ångtryck är direkt proportionella mot koncentrationen av löst ämne närvarande. Följaktligen kan vi använda en mätning av en av dessa egenskaper för att bestämma molmassan för löst ämne från mätningarna.
Kolligativa egenskaper hos elektrolyter
Som nämnts tidigare i denna modul beror de lösande kolligativa egenskaperna bara på antalet upplösta ämnen, inte på identiteten,. Koncentrationsvillkoren i ekvationerna för olika kolligativa egenskaper (fryspunktsdepression kokpunkt, höjning av kokpunkt, osmotiskt tryck) avser alla lösta arter som finns i lösningen. För de lösningar som hittills betraktats i detta kapitel har de lösta ämnena varit icke-elektrolyter som löses fysiskt utan dissociation eller någon annan åtföljande process. le som upplöser ger en upplöst löst molekyl. Upplösningen av en elektroyte är dock inte så enkel, vilket illustreras av de två vanliga exemplen nedan:
Med tanke på det första av dessa exempel och under antagande av fullständig dissociation innehåller en 1,0 m vattenlösning av NaCl 2,0 mol joner (1,0 mol Na + och 1.0 mol Cl−) per kilo vatten, och dess fryspunktsfördjupning förväntas vara
När denna lösning faktiskt bereds och dess fryspunktsdämpning mäts, erhålls dock ett värde på 3,4 ° C. Liknande avvikelser observeras för andra jonföreningar, och skillnaderna mellan de uppmätta och förväntade kolligativa egenskaperna blir vanligtvis mer signifikanta när koncentrationerna av lösta ämnen ökar. Dessa observationer tyder på att jonerna av natriumklorid (och andra starka elektrolyter) inte är fullständigt dissocierade i lösning. ära av den nobelprisvinnande tyska kemisten Jacobus Henricus van’t Hoff används. Van’t Hoff-faktorn (i) definieras som förhållandet mellan lösta partiklar i lösning och antalet formelenheter upplösta:
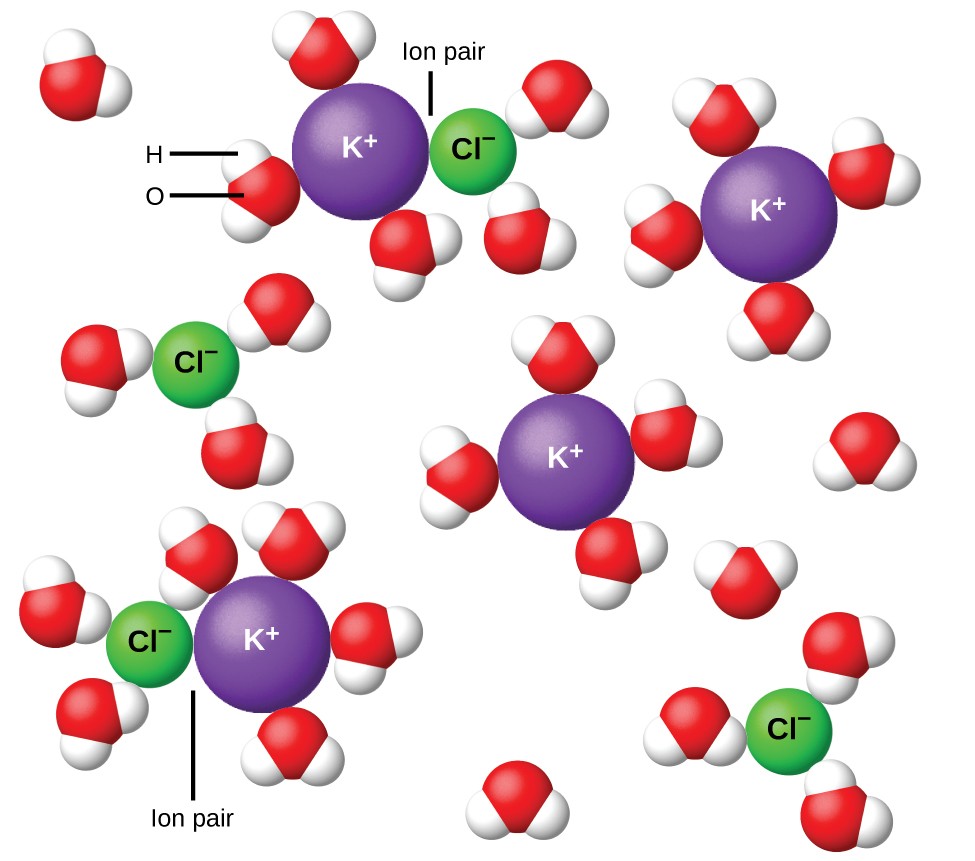
Figur 11. Jonerna blir mer och mer separerade ju mer utspädd lösningen, och de återstående interioniska attraktionerna blir mindre.
År 1923 föreslog kemisterna Peter Debye och Erich Hückel en teori för att förklara den skenbara ofullständiga joniseringen av starka elektrolyter. De föreslog att även om interionisk attraktion i en vattenhaltig lösning reduceras mycket kraftigt genom lösning av jonerna och det polära lösningsmedlets isolerande verkan, upphävs det inte helt. De återstående attraktionerna förhindrar att jonerna beter sig som helt oberoende partiklar (figur 11). I vissa fall kan en positiv och negativ jon faktiskt beröra, vilket ger en solvatiserad enhet som kallas ett jonpar. Således är aktiviteten eller den effektiva koncentrationen av någon speciell typ av jon mindre än den som indikeras av den faktiska koncentrationen. Joner separeras mer och mer brett, ju mer utspädd lösningen och de återstående interioniska attraktionerna blir mindre och mindre. I extremt utspädda lösningar är således de effektiva koncentrationerna av jonerna (deras aktiviteter) väsentligen lika med de faktiska koncentrationerna. Observera att van’t Hoff-faktorerna för elektrolyterna i tabell 2 är för 0,05 m lösningar, vid vilka koncentrationen värdet av i för NaCl är 1,9, i motsats till ett idealvärde av 2.
Exempel 11: Frysningspunkten för en lösning av en elektrolyt
Koncentrationen av joner i havsvatten är ungefär densamma som i en lösning innehållande 4,2 g NaCl upplöst i 125 g vatten. Antag att var och en av jonerna i NaCl-lösningen har samma effekt på vattenets fryspunkt som en icke-elektrolytmolekyl, och bestäm frystemperaturen som lösningen (som är ungefär lika med frystemperaturen för havsvatten).
Kontrollera ditt lärande
Antag att var och en av jonerna i kalciumklorid, CaCl2, har samma effekt på fryspunkten för vatten som en icke-elektrolytmolekyl. Beräkna fryspunkten för en lösning av 0,724 g CaCl2 i 175 g vatten.
Prova det
- Kött kan klassificeras som färskt (inte fryst) trots att det lagras vid −1 ° C. Varför skulle inte köttet frysa vid denna temperatur?
- En organisk förening har en sammansättning på 93,46% C och 6,54% H i vikt. En lösning av 0,090 g av denna förening i 1,10 g kamfer smälter vid 158,4 ° C. Smältpunkten för ren kamfer är 178,4 ° C. Kf för kamfer är 37,7 ° C / m. Vad är molekylformeln för det lösta ämnet? Visa dina beräkningar.
- Ett salt är känt för att vara en alkalimetallfluorid. En snabb ungefärlig bestämning av fryspunkten indikerar att 4 g av saltet löst i 100 g vatten ger en lösning som fryser vid cirka -1,4 ° C. Vad är saltets formel? Visa dina beräkningar.
Ordlista
aktivitet: effektiv koncentration av joner i lösning; den är lägre än den faktiska koncentrationen på grund av joninteraktioner.
kokpunktens höjd: höjning av kokpunkten för en vätska genom tillsats av en löst lösning
kokpunktens höjdkonstant: proportionalitetskonstant i ekvationen som hänför sig till kokpunktens höjd till den lösta molaliteten; även känd som den ebullioskopiska konstanten
kolligativ egenskap: egenskap hos en lösning som endast beror på koncentrationen av en löst art
crenation: process där biologiska celler krymper på grund av förlust av vatten genom osmos
fryspunktsdepression: sänkning av fryspunkten för en vätska genom tillsats av ett löst ämne
fryspunktsdepressionskonstant: (även kryoskopisk konstant) proportionalitetskonstant i ekvationen fryspunkt depression till löst molalitet
hemolys: bristning av röda blodkroppar på grund av ackumulering av överskott av vatten genom osmos
hypertonisk: med större osmotiskt tryck
hypotonisk : med mindre osmotiskt tryck
jonpar: solvatiserat anjon / katjonpar som hålls samman av måttlig elektrostatisk attraktion
isoton: med lika osmotiskt tryck
molalitet (m) : en koncentrationsenhet definierad som förhållandet mellan antalet mol löst ämne och massan av lösningsmedlet i kg
molfraktion (X): förhållandet mellan en lösningskomponents molmängd och det totala antalet mol av alla lösningskomponenter
osmos: diffusion av lösningsmedelsmolekyler genom ett semipermeabelt membran
osmotiskt tryck (Π ): motsatt tryck som krävs för att förhindra bulköverföring av lösningsmedelsmolekyler genom ett semipermeabelt membran ångtryck i rent tillstånd
semipermeabelt membran: ett membran som selektivt tillåter passage av vissa joner eller molekyler
van’t Hoff-faktor (i): förhållandet mellan antalet mol av partiklar i en lösning till antalet mol av formel-enheter upplösta i lösningen
- En icke-elektrolyt som visas för jämförelse. ↵

