- Förekomsten av höga koncentrationer av antikroppar (titer > 1: 640) borde göra en misstänkt för att en autoimmun sjukdom är närvarande. I det här scenariot rekommenderar jag att serum sedan testas för antikroppar mot dsDNA, Sm, RNP, Ro (SS-A), La (SS-B) och kanske Scl-70. Närvaron av antikroppar mot någon av dessa ökar sannolikheten för att patienten har SLE, MCTD, Sjögrens eller sklerodermi. Vissa laboratorier testar automatiskt för dessa antikroppar när ANA-screening är positiv. Emellertid är närvaron av dessa antikroppar inte diagnos av sjukdom. Om ingen initial diagnos kan ställas är det min praxis att se patienten noga över tiden för utveckling av en ANA-associerad sjukdom och se patienten minst två gånger per år.
- Kombinationen av låga titrar av antikropp (< 1:80) och inga eller få tecken eller symtom på sjukdom visar en mycket mindre sannolikhet för en autoimmun sjukdom. Som ett resultat måste dessa patienter med låga ANA-titrar omvärderas mindre ofta – årligen såvida inte kliniska symtom utvecklas för att antyda en autoimmun sjukdom.
- En patient med negativ ANA är högst osannolikt att ha antingen SLE, MCTD , Sjögrens eller sklerodermi. Men om det fortfarande finns starka kliniska bevis för en systemisk autoimmun sjukdom, kan man testa för de specifika antikropparna mot dubbelsträngat (ds) DNA, Sm, RNP, Ro, La eller Scl-70, även om, enligt min erfarenhet, de är vanligtvis negativa. Ändå är det klokt att se sådana patienter där det finns ett högt kliniskt index för misstanke, åtminstone årligen – även om det är oftare om det är kliniskt indikerat. , perifer, kant, fläckig, nukleolär, anticentromer, etc.). Kärnfärgningsmönstret har erkänts ha relativt låg känslighet och specificitet för olika autoimmuna störningar. Närvaron av antikroppar riktade mot specifika nukleära antigener är vanligtvis mer användbar. (Dessa antikroppar inkluderar följande: dsDNA, Sm, RNP, Ro, La eller Scl-70.)
Under de senaste åren har utredare och bioteknikföretag utvecklat fast fas immunanalyser för att ersätta IF ANA-testet.4-23 Motivet bakom detta försök hänför sig till IF-teknikens prestandaegenskaper. Detta test är mycket arbetskrävande och kan variera på grund av olika tolkningar av tekniker. Det komplicerade testet är också blekning av bilden när den undersöks i ett fluorescerande mikroskop. Vidare använder IF-tekniken seriella utspädningar av patientsera, vilket ger resultat som kanske inte är linjära. Variationer i titer två gånger är vanliga vid dagliga tester på samma prov; fyrfaldiga skillnader sägs vara ”signifikanta.” Däremot är fasta immunanalyser automatiserade och mycket reproducerbara. Resultaten är linjära och tekniken är mindre arbetskrävande och därmed billigare att utföra.
På grund av dessa överväganden bör det finnas ekonomiska besparingar i i ett försök att utveckla fastfas-immunanalyser för att kvantifiera en ANA. Således, i ett försök att utveckla fastfas-ANA-immunanalyser, har ett antal grupper lagt på den fasta fasen vad som helst antigener som typiskt analyseras i de mer specifika ANA-immunanalyserna (t.ex. DNA, Sm, RNP, Ro / SSA, La / SSB, nukleoprotein, cellextrakt, etc.). I publicerade rapporter är korrelationskoefficienten mellan ANA-titrar och dessa fasta fasanalyser ganska bra. Således har många kommersiella företag bytt sina ANA. till dessa fasta fasimmunanalyser.4-23. Men oroande är den höga frekvensen / procenten av falskt negativa resultat hos patienter med känd SLE och relaterade sjukdomar, liksom den fortsatta höga frekvensen av ”falska positiva” (t.ex. en positiv ANA hos någon utan SLE) i dessa studier. 15-21 Ytterligare arbete behövs för att förbättra känsligheten och särskilt specificiteten hos dessa fastfasimmunanalyser för att säkerställa att patienter med SLE och relaterade sjukdomar inte missas av dessa fastfasimmunanalyser.
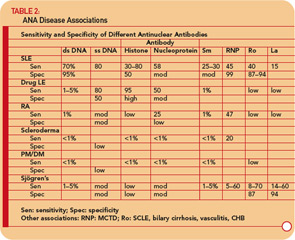
Antikroppar mot DNA
Antikroppar mot DNA kan primärt delas in i de som reagerar med enkelsträngat (ss) DNA och de som känner igen dsDNA.24-26
Anti- ssDNA-antikroppar har rapporterats i SLE, reumatoid artrit, läkemedelsrelaterad lupus, friska släktingar till patienter med SLE och, mindre vanligt, vid andra reumatiska sjukdomar. (Se tabell 2, s. 17.) Således har anti-ssDNA begränsad användbarhet för diagnos av SLE eller andra reumatiska sjukdomar. Anti-ssDNA korrelerar inte bra med sjukdomsaktivitet och är därför inte användbara för sjukdomshantering.
Antikroppar mot dsDNA detekteras oftast av fastfasimmunanalyser, men också i vissa laboratorier med crithidia IF-analysen eller ibland Farr radioimmunanalys.De flesta sjukhus och kommersiella laboratorier gör bara ett. Farr-analysen har förmodligen den högsta specificiteten och den lägsta känsligheten hos de tre analyserna för diagnos av SLE, medan fastfasanalyser har den högsta känsligheten och lägsta specificiteten; krithidia-analysen faller däremellan. Farr-analysen har också nackdelen med att använda radioaktivt material, vilket de flesta laboratorier undviker, och krithidia-testet är mycket arbetskrävande. Jag föredrar ELISA-analysen för daglig användning.
Anti-dsDNA är specifika (95%) men inte mycket känsliga (70%) för SLE, vilket gör dem mycket användbara för diagnos när de är positiva.9 (Se tabell 2 , s. 17.) De finns ibland under andra tillstånd, inklusive reumatoid artrit, juvenil artrit, läkemedelsinducerad lupus, autoimmun hepatit och till och med hos normala personer.
Titrar av anti-dsDNA-antikroppar fluktuerar ofta med sjukdomsaktivitet, särskilt lupus nefrit, och är därför användbara för många patienter för att följa SLE. Om en patient har en stigande titer, eller mycket hög titer, men som är kliniskt vilande, behandlar jag inte den serologiska avvikelsen, men anser det vara ett varningstecken att patienten måste följas närmare och behandlas när något händer kliniskt för att motivera en förändring i terapi. Vissa utredare har dock behandlat dessa serologiska avvikelser (särskilt när de är associerade med låga komplementnivåer) och har rapporterat förbättrade kliniska resultat. Omvänt använder jag en fallande titer hos någon som blir bättre efter en flare på behandlingen som en vägledning för att minska behandlingen (t.ex. kortikosteroider och / eller immunsuppressiva medel).
Föreningen mellan anti-dsDNA-antikroppar och andra sjukdomsmanifestationer av SLE är mycket mindre tydliga. Det finns till exempel inget samband mellan anti-dsDNA-titer och sjukdomsaktivitet hos neuropsykiatrisk SLE.
Det är alltid en utmaning att skilja på aktiva lupusmanifestationer från smittsamma komplikationer eller toxiska effekter av läkemedel – och från oberoende sjukdom. Förekomsten av anti-dsDNA-antikroppar kan vara till hjälp för vissa patienter att göra denna skillnad.
Anti-Smith och Anti-Ribonukleoprotein-antikroppar
Antikroppar mot Smith (Sm) och anti-ribonukleoprotein (anti-RNP) detekteras oftast av fasta immunanalyser.24,27
Anti-Sm-antikroppar finns hos endast 10% till 40% av patienterna med SLE, men är mycket sällsynta hos patienter med andra tillstånd (dvs. de är inte känsliga men är mycket specifika). Mätning av anti-Sm-titrar kan vara användbar diagnostiskt, särskilt vid en tidpunkt då anti-DNA-antikroppar inte kan detekteras. Med tanke på den relativt låga känsligheten av anti-Sm utesluter emellertid ett negativt värde inte på något sätt diagnosen SLE.
Anti-RNP-antikroppar finns hos cirka 40% till 60% av patienterna med SLE, men är inte specifika för SLE, eftersom de är en definierande funktion i MCTD. Dessa antikroppar kan också förekomma i låga titrar och låga frekvenser vid andra reumatiska sjukdomar inklusive RA och sklerodermi. (Se tabell 2, s. 17.)
Varken titern (nivåerna) av anti-Sm eller anti-RNP-antikroppar korrelerar med någon klinisk aktivitet.
Anti-Ro / SSA och Anti-La / SSB-antikroppar
Antikroppar mot Ro / SSA och La / SSB detekteras oftast med fasta fasimmunanalyser.28,29 Anti-Ro / SSA och anti-La / SSB har detekterats i hög frekvens hos patienter med Sjögrens syndrom och i SLE, men också hos patienter med ljuskänslig dermatit och hos 0,1% till 0,5% av friska vuxna.
Anti-Ro / SSA-antikroppar finns hos cirka 50% av patienter med SLE. (Se tabell 2, s. 17.) De har associerats med ljuskänslighet, subakut kutan lupus, kutan vaskulit (palpabel purpura), interstitiell lungsjukdom, neonatal lupus och medfödd hjärtblock. Anti-Ro / SSA-antikroppar finns hos cirka 75% av patienterna med primärt Sjögrens syndrom (se tabell 2, s. 17), och höga titrar av dessa antikroppar är associerade med en större förekomst av extra körtelegenskaper, särskilt purpura och vaskulit. Däremot finns Ro / SSA-antikroppar endast hos 10% till 15% av patienterna med sekundärt Sjögrens syndrom associerade med reumatoid artrit. Därför stöder närvaron av Ro / SSA- eller anti-La / SSB-antikroppar hos patienter med misstänkt primärt Sjögrens syndrom starkt diagnosen.
Cirka 50% av patienterna med SLE som har anti-Ro-antikropp har också anti -La-antikropp, ett nära besläktat RNA-proteinantigen. På samma sätt har de flesta patienter med Sjögrens syndrom också anti-La (SSB) antikroppar. Det är ytterst sällsynt att hitta patienter med anti-La-antikroppar utan anti-Ro-antikroppar.
Enligt min mening är indikationerna för att beställa ett anti-Ro / SSA- och anti-La / SSB-antikroppstest enligt följande:
- Kvinnor med SLE som är gravida eller kan bli gravid i framtiden;
- Kvinnor som tidigare har födt ett barn med hjärtblock eller myokardit;
- Patienter med en historia av oförklarliga ljuskänsliga hudutbrott;
- Patienter som starkt misstänks ha SLE men som har ett negativt ANA-test; eller
- Patienter med symtom på xerostomi, keratokonjunktivit sicca och / eller saliv- och tårkörtelförstoring.
Antiribosomalt P-proteinantikroppar
Anti- ribosomala P-proteinantikroppar har detekterats hos 10% till 20% av patienterna med SLE i USA och 40% till 50% av de asiatiska patienterna med SLE, men sällan vid andra reumatiska sjukdomar. 30 Anti-ribosomalt P-proteinantikroppar kan vara mycket specifikt för lupusassocierad psykos, även om inte alla studier har bekräftat detta. Depression och njur- och leverinvolvering hos patienter med lupus har också associerats med anti-ribosomalt P-proteinantikroppar i några små studier.
På grund av den låga känsligheten och den dåliga kliniska korrelationen ser många utredare – inklusive jag själv – se liten klinisk användbarhet i detta test.
Anticentromerantikroppar
Anticentromerantikroppar (ACA) finns nästan uteslutande hos patienter med begränsad kutan systemisk skleros (lcSSc), särskilt hos de med CREST.31 ACA har observerats hos 57% av patienterna med CREST men har också setts hos patienter med andra tillstånd, inklusive hos vissa patienter med Raynauds fenomen enbart. ACA detekteras typiskt av det karakteristiska IF-mönstret på Hep-2-celler.
Anti-Scl-70 (topoisomeras-1) Antikroppar
Cirka 15% till 20% av patienterna med sklerodermi har antikroppar mot ett 70 kd protein (topoisomeras-1), därefter benämnt Scl-70.31. Den vanliga metoden för detektion är genom ELISA. Förekomsten av dessa antikroppar verkar öka risken för lungfibros bland patienter med sklerodermi och är ganska specifik för sjukdomen.
Sammanfattning
Om man misstänker SLE baserat på historik, fysisk undersökning och fullständigt blodantal (t.ex. leukopeni, trombocytopeni), begär ett ANA-test. Om det är negativt är det mycket osannolikt att patienten har SLE, och patienten kan bli lugn. Om titern är < 1: 160 är SLE osannolikt och patienten kan vara säker på att SLE är osannolikt, men patienten bör följas regelbundet. En titer på ≥1: 160 ökar sannolikheten för SLE och relaterade störningar. Det är dock viktigt att komma ihåg att 85% av individerna med en positiv ANA inte har SLE. Om ANA är positivt bör man också testa antikroppar mot dsDNA, Sm, RNP, Ro / SSA och La / SSB. Närvaron av dessa antikroppar ökar sannolikheten för att patienten har SLE och relaterade störningar (se tabell 2, s. 17) och patienten måste följas närmare. Detektering av anticentromer- och anti-Scl-70-antikroppar är mycket användbart för diagnos av sklerodermi. Detektering av antikroppar mot Ro / SSA och La / SSB är också användbara för diagnos av Sjögrens syndrom.
Det enda av dessa tester som är användbart för att övervaka aktivitet är anti-dsDNA.
Bekräftelse: Jag är tacksam till arbetet från många författare av UpToDate in Medicine, vars arbete gav en användbar ram för utvecklingen av denna uppsats, liksom till Dr. Robert Shmerling, David Lee och Donald Bloch, med vilka jag har skrivit artiklar och kapitel om samma ämne.
Dr. Schur är professor i medicin vid Harvard Medical School och avdelningen för reumatologi, immunologi och allergi vid avdelningen för medicin vid Brigham and Women’s Hospital i Boston.
- Reichlin M. Mätning och klinisk betydelse av antinukleära antikroppar. Aktuellt. Oktober 2008.
- American College of Rheumatology Ad Hoc Committee for Immunologic Testing Guidelines. Riktlinjer för immunologiska laboratorietester vid reumatiska sjukdomar: En introduktion. Artrit Reum. 2002; 47: 429-433.
- Solomon DH, Kavanaugh AJ, Schur PH, et al. Bevisbaserade riktlinjer för användning av immunologiska tester: Antinukleär antikroppstest. Artrit Reum. 2002; 47: 434-444.
- Sinclair D, Saas M, Williams D, Hart M, Goswami R. Kan en ELISA ersätta immunfluorescens för detektion av anti-nukleära antikroppar? – Den rutinmässiga användningen av anti ELISA för screening av kärnantikroppar. Clin Lab. 2007; 53: 183-191.
- Avaniss-Aghajani E, Berzon S, Sarkissian A. Kliniskt värde av multiplexade pärlbaserade immunanalyser för detektion av autoantikroppar mot nukleära antigener. Clin Vaccine Immunol. 2007; 14: 505-509.
- Copple SS, Martins TB, Masterson C, Joly E, Hill HR. Jämförelse av tre multipleximmunanalyser för detektion av antikroppar mot extraherbara nukleära antikroppar med användning av kliniskt definierade sera. Ann N Y Acad Sci.2007; 1109: 464-472.
- Caramaschi P, Ruzzenente O, Pieropan S, et al. Bestämning av ANA-specificitet med användning av multiplexerad fluorescerande mikrosfärsimmunanalys hos patienter med ANA-positivitet vid höga titrar efter infliximab-behandling: Preliminära resultat. Rheumatol Int. 2007; 27: 649-654.
- Biagini RE, Parks CG, Smith JP, Sammons DL, Robertson SA. Analytisk prestanda för AtheNA MultiLyte ANA II-analysen i sera från lupuspatienter med multipla positiva ANA. Anal Bioanal Chem. 2007; 388: 613-618.
- Gonzalez C, Garcia-Berrocal B, Perez M, et al. Laboratoriescreening av bindvävssjukdomar genom en ny automatiserad ENA-screeninganalys (EliA Symphony) hos kliniskt definierade patienter. Clin Chim Acta. 2005; 359: 109-114.
- Eissfeller P, Sticherling M, Scholz D, et al. Jämförelse av olika testsystem för samtidig detektion av autoantikroppar vid bindvävssjukdomar. Ann N Y Acad Sci. 2005; 1050: 327-339.
- Smith J, Onley D, Garey C, et al. Bestämning av ANA-specificitet med hjälp av UltraPlex-plattformen. Ann N Y Acad Sci. 2005; 1050: 286-294.
- Martins TB, Burlingame R, von Muhlen CA, et al. Utvärdering av multiplexerat fluorescerande mikrosfärsimmunanalys för detektion av autoantikroppar mot nukleära antigener. Clin Diagn Lab Immunol. 2004; 11: 1054-1059.
- Bernardini S, Infantino M, Bellincampi L, et al. Screening av antinukleära antikroppar: Jämförelse mellan enzymimmunanalys baserat på nukleära homogenat, renade eller rekombinanta antigener och immunfluorescensanalys. Clin Chem Lab Med. 2004; 42: 1155-1160.
- Nossent H, Rekvig OP. Antinukleär antikroppsscreening i det nya årtusendet: Farväl till mikroskopet? Scand J Rheumatol. 2001; 30: 123-126; diskussion 127-128.
- Lopez-Hoyos M, Rodriguez-Valverde V, Martinez-Taboada V. Utförande av antinukleär antikropp bindvävssjukdom skärm. Ann N Y Acad Sci. 2007; 1109: 322-329.
- Ghillani P, Rouquette AM, Desgruelles C, et al. Utvärdering av LIAISON ANA-screeningsanalys för antinukleär antikroppstest vid autoimmuna sjukdomar. Ann N Y Acad Sci. 2007; 1109: 407-413.
- Bonilla E, Francis L, Allam F, et al. Immunofluorescensmikroskopi är överlägsen fluorescerande pärlor för detektion av antinukleär antikroppsreaktivitet hos patienter med systemisk lupus erythematosus. Clin Immunol. 2007; 124: 18-21.
- Nifli AP, Notas G, Mamoulaki M, et al. Jämförelse av en multiplex, pärlbaserad fluorescerande analys och immunfluorescensmetoder för detektion av ANA och ANCA autoantikroppar i humant serum. J Immunol Methods. 2006; 311: 189-197.
- Shovman O, Gilburd B, Zandman-Goddard G, et al. Multiplexed AtheNA multi-lyte immunoanalys för ANA-screening vid autoimmuna sjukdomar. Autoimmunitet. 2005; 38: 105-109.
- Ulvestad E. Prestandaegenskaper och klinisk nytta av en hybrid ELISA för detektion av ANA. Apmis. 2001; 109: 217-222.
- Olaussen E, Rekvig OP. Screeningstest för antinukleära antikroppar (ANA): Selektiv användning av centrala kärnantigener som en rationell grund för screening med ELISA. J Autoimmun. 1999; 13: 95-102.
- Homburger HA, Cahen YD, Griffiths J, Jacob GL. Detektion av antinukleära antikroppar: Jämförande utvärdering av enzymimmunanalys och indirekta immunfluorescensmetoder. Arch Pathol Lab Med. 1998; 122: 993-999.
- Gniewek RA, Stites DP, McHugh TM, Hilton JF, Nakagawa M. Jämförelse av antinukleära antikroppstestmetoder: Immunfluorescensanalys kontra enzymimmunanalys. Clin Diagn Lab Immunol. 1997; 4: 185-188.
- Reichlin M. Antikroppar mot DNA, SM och RNP. Aktuellt. Oktober 2008.
- Hahn BH. Antikroppar mot DNA. Nya Engl J Med. 1998; 338: 1359.
- Kavanaugh AF, Solomon DH, American College of Rheumatology Ad Hoc Committee on Immunologic Testing Guidelines. Riktlinjer för immunologiska laboratorietester vid reumatiska sjukdomar: Anti-DNA-antikroppstester. Artrit Reum. 2002; 47: 546-555.
- Benito-Garcia E, Schur PH, Lahita R. Riktlinjer för immunologiska laboratorietester vid reumatiska sjukdomar: Anti-Sm och Anti-RNP-antikroppstest. Artrit Reum. 2004; 51: 1030-1044.
- Reichlin M. Klinisk betydelse av anti-Ro / SSA och anti-La / SSB-antikroppar. Aktuellt. Oktober 2008.
- Reveille JD, Sherrer YRS, Solomon DH, Schur P, Kavanaugh A. Bevisbaserade riktlinjer för användning av immunologiska laboratorietester: Anti-Ro (SS-A) och La (SS- B): En rapport från ACR Ad Hoc Committee om riktlinjer för immunologisk testning. Inlämnad för publicering.
- Reichlin M. Antiribosomala P-proteinantikroppar. Aktuellt. Oktober 2008.
- Denton CP. Klassificering av sklerodermi. Aktuellt. Oktober 2008.