Kliniskt fall
En 45-årig kvinna med en 20-årig historia av Crohns sjukdom presenteras med feber, frossa och trötthet i 10 dagar. Strax innan symtomen uppstod genomgick patienten en okomplicerad koloskopi under vilken hon fick 17 biopsier utförda för övervakning eller polypektomi. Under koloskopi var hennes Crohns sjukdom i remission och ingen slemhinneinflammation noterades.
I ED var patientens vitala tecken HR 110, BP 120/80, RR 18, T 102,5. Hon hade mild ömhet i övre delen av buken. Laboratoriestudier avslöjade ett förhöjt antal vita blodkroppar (15 000) och förhöjt AST och ALT (120/137 U / L), med något förhöjt alkaliskt fosfatas på 200 IE / L. En datortomografi (CT) -undersökning av buken avslöjade flera områden med låg dämpning i höger leverlob i överensstämmelse med leverabscesser. Dränering av abscesserna odlades och växte Streptococcus anginosus. Upplösning av alla lesioner inträffade efter att de tappats av interventionell radiologi och patienten fick en 6-veckors kurs med intravenösa antibiotika.
Inledning
Koloskopi är ett vanligt utfört förfarande vid diagnos och behandling av ett stort antal tillstånd inklusive cancer, inflammatoriska tarmsjukdomar, polyper, blödning och strikturer. Enligt American Cancer Society rekommenderas screeningkoloskopi vart tionde år med början vid 50 års ålder. Hos högriskpatienter som de med inflammatorisk tarmsjukdom utförs koloskopi oftare. Förfarandet är fortfarande det mest effektiva sättet att hitta och ta bort små pre-cancerösa polyper och därmed minska risken för dödsfall från tjocktarms- och ändtarmscancer.
I allmänhet är koloskopi mycket säker. En systematisk granskning från 2008 av 12 studier på totalt 57 742 koloskopier utförda för genomsnittlig riskundersökning visade en övergripande allvarlig biverkningshastighet på bara 2,8 per 1000 procedurer och mortalitet på 0,007% .2 Risken för koloskopi är dock inte konstant över grupper och vissa komplikationer är vanligare än andra. Äldre vuxna har ökad risk för allvarliga komplikationer jämfört med yngre patienter. I en studie av 53 220 koloskopier hade patienter i åldrarna 80 till 84 år en signifikant högre frekvens av allvarliga komplikationer jämfört med patienter i åldern 66 till 69 år. Risken för allvarliga komplikationer ökade också bland patienter med komorbida tillstånd som en historia av stroke, KOL, förmaksflimmer och hjärtsvikt.
Pyogen leverabscess (PLA) är en sällsynt men allvarlig komplikation av koloskopi . De flesta komplikationer av koloskopi kommer att uppstå inom 7 dagar, men PLA kan presentera dagar eller till och med veckor senare än det, och historien om ny koloskopi kanske inte ens framkallas om inte läkaren är medveten om denna enhet.4-6 På grund av den fördröjda naturen av PLA, kommer dessa patienter sannolikt att diagnostiseras på akutavdelningen.
Andra sena komplikationer som elektrokoagulationssyndrom efter polypektomi och de vanligaste problemen med fördröjd blödning, ospecifik buksmärta, reaktioner på sederingsmedel och perforering kan också ses i ED. Däremot kommer gasexplosion eller omedelbar blödning sällan att ses i ED, eftersom dessa problem vanligtvis förekommer snabbt i endoskopisviten, där de behandlas framväxande. ED-läkare måste vara medvetna om alla möjliga komplikationer och deras tidsförlopp och ha verktygen för att korrekt diagnostisera och behandla den olyckliga patienten efter koloskopi som får en allvarlig komplikation.
Komplikationer
Pyogenic Leverabscess
PLA är en farlig sjukdom med hög sjuklighet och dödlighet som uppträder med en hastighet av 10 till 20 fall per 100.000 sjukhusinläggningar.4-6 Med framsteg inom diagnostiska tekniker och interventioner förbättras dödligheten.7 Patienter är emellertid fortfarande i allvarlig fara, särskilt om diagnosen är försenad, som det ofta är, eftersom patienter kan presentera ospecifikt. En retrospektiv studie av 63 patienter med PLA visade att feber var vanligt (59%), men andra tecken och symtom såsom smärta i högra övre kvadranten och peritoneala tecken fanns hos endast 39% respektive 14%. 8 Diagnos i denna studie var ofta fördröjt i genomsnitt en vecka från symtomsdebut.
Koloskopi är en sällsynt men också förmodligen underkänd fällning av PLA. Man tror att tysta mikroperforationer under proceduren leder till infektion som kan utsäda levern genom portalcirkulationen. På liknande sätt kan andra infektioner inom buken, såsom divertikulit, potentiellt orsaka PLA om det infekterade området dräneras av portalvenen.9 Hepatisk clearance av bakterier via portalnätverket är ett normalt fenomen hos friska patienter, men gallstopp, dålig perfusion och hög bakteriebelastning (som i fallet med infektion eller multipla biopsier under koloskopi som sådd blodomloppet) kan predisponera för spridning och abscess bildning. Litteraturen beskriver ungefär 34% av PLA-fallen som kryptogena, men en del av dessa kan mycket väl vara patienter med nyligen koloskopi som inte kändes som en riskfaktor för sjukdomsprocessen.8
De flesta PLA-isolat är polymikrobiella och består av normal enterisk flora. Blodkulturer är positiva i 33-65% av fallen, men abscesskulturer är nästan alla positiva.10 De vanligaste isolerade mikroorganismerna är Streptococcus-arter (37%), Eserichia Coli (33%), Bacteroides-arter (24%), Klebsiella pneumoniae (18%) och mikroaerofila streptokocker (12%). 10-11 Strep anginosus, som finns i denna patients fall, är en fakultativ anaerob gram-positiv coccus och en av de vanligaste organismerna som finns i PLA.
Snabb diagnos av PLA är kritisk, för även om diagnos och terapi förbättras förblir dödligheten på 10%. 5,7 Smittsamma komplikationer av koloskopi i allmänhet är sällsynta, men återigen är också orsakssambandet troligen underkänt. Koloskopi har varit inblandad i åtminstone några få fall av PLA.12-14 Men övergående systemisk bakteriemi, som ses hos 4% av koloskopier, verkar inte öka risken för infektion i sig.15 Snarare antas infektionen i PLA spridas via verkliga mikroperforationer.
Även om det är känt att upprörda perforeringar är relativt sällsynta (mindre än 0,1% av koloskopier), är inte förekomsten och patofysiologin av mikroperforationer helt kända.16-17 Beväpnad med kunskap om detta kliniska enhet, en kliniker som framkallar en god historia och har ett högt misstänksamhetsindex, kan snabbare diagnostisera PLA hos en patient med ny koloskopi.
Infektion
Det är allmänt accepterat att övergående bakteriemi efter koloskopi inträffar i ungefär 4% av förfarandena, även om intervallet rapporteras som 0-25%, och riskfaktorer för bakteriemi definieras inte.18 Högre frekvenser av bakteriemi uppträder under rutinmässiga dagliga aktiviteter såsom tandborstning och tuggmat. Även om tecken eller symtom på systemisk infektion hos patienter med övergående bakteriemi är sällsynta kan patienter känna feber, frossa och klagomål som imiterar allt från övre luftvägar till buksinfektioner.18
Även om övergående bakteriemi är en accepterad risk för koloskopi , det finns ingen bevisad fördel för rutinmässig antibiotikaprofylax, och de flesta patienter har inte tagit antibiotika peri-procedur.18 Nuvarande riktlinjer från American Society for Gastroenterology (ASGE) håller med American Heart Association (AHA) och rekommenderar mot antibiotikaprofylax för patienter som genomgår rutinmässig koloskopi.19
Det kan vara svårt att skilja symtom på övergående bakteriemi från verklig infektion.18 I allmänhet garanterar patienter med infektiösa symtom dagarna efter koloskopi laboratorieundersökningar inklusive blodkulturer, och beroende på indexet för misstankar för perforering, abdominal avbildning.20-21 Om misstanke om perforering är låg eller diagnoserna s utesluts kan IV-hydrering och antibiotika ges om det är motiverat av patientens kliniska status.
Blödning
Blödning efter polypektomi kan vara antingen omedelbar eller fördröjd. Omedelbar blödning är förknippad med polypektomitekniker som inte använder kauteri eller när blandad ström används för proceduren. Försenad blödning ses oftare i ED, eftersom omedelbar blödning ofta upptäcks vid ingreppstidpunkten och behandlas av endoskopisten. Försenad blödning kan ses upp till 7 dagar efter ingreppet. Det antas inträffa på grund av slöjning av en kardinal som täckte ett blodkärl eller på grund av förlängning av zonen för termisk nekros till icke-skadad vävnad, vilket kan leda till blödning om det involverar ett blodkärl. 19,22
Flera stora studier har rapporterat blödning i 1 till 6 per 1000 koloskopier (0,1% -0,6%). 22 En studie som analyserade över 50 000 koloskopier fann dock att frekvensen av GI-blödning var signifikant annorlunda beroende på om polypektomi utfördes. Blödning efter polypektomi uppträder vid 1-2%, med högre frekvenser sett med borttagning av större polyper. Risken för blödning efter polypektomi kan ökas hos patienter med trombocytopeni eller koagulopatier.23
Kända riskfaktorer för blödning efter koloskopi inkluderar polypstorlek, antal polyper som avlägsnats, tidigare antikoagulantanvändning eller polyp histologi.22 Märkligt nog fann flera, stora studier inte aspirinanvändning associerad med blödning efter polypektomi.24-26
Patienter med fördröjd blödning kan uppvisa tecken på blödning eller anemi, inklusive trötthet, svaghet , blekhet, kraftig blödning eller blodproppar vid torkning, takykardi, bröstsmärta och andfåddhet.Patienter kan beskriva hematochezia eller melena, beroende på platsen för blödningen.
Initial hantering av en patient med misstänkt blödning innefattar adressering av grundläggande luftvägar, andning och cirkulation med 2 stora borrningar, kristalloidvätskor och hjärtövervakning. Patienter med grov lägre gastrointestinal blödning kan snabbt kompensera och bör ha en aktiv typ och en skärm om transfusion krävs.
Avbildning är inte alltid nödvändig, och om möjligt bör beslutet om avbildning tas tillsammans med gastrointestinalt rådfråga, helst läkaren som utförde koloskopi. Upprepad koloskopi är ofta det diagnostiska och terapeutiska förfarandet. American College of Radiology ger högsta lämplighetsgrad för koloskopi, även om den också inkluderar CTA i buken / bäckenet och Tc-99m RBC-scan buk / bäcken som möjligt lämpliga steg i diagnosen.27
Om patienten är instabil och den utförande endoskopisten är inte tillgänglig, ED-läkaren bör konsultera allmän interventionell radiologi (IR), GI och kirurgi.
Perforering
Koloskopisk perforering (CP) är en av de allvarligaste och fruktade komplikationerna av koloskopi. Även om det är sällsynt, resulterar CP i hög sjuklighet och dödlighet. 28-32 Perforering kan bero på mekaniska krafter mot tarmväggen, barotrauma eller elektrokauteri och kan leda till abscessbildning, fistelbildning, intra-abdominal sepsis, förlängd sjukhusvistelse och till och med död.
CP förekommer i cirka 0,016% av diagnostiska koloskopier men kan ses hos upp till 5% av terapeutiska koloskopier.33-35 Beroende på vad som faktiskt gjordes under koloskopi kan risken för perforering vara högre eller lägre än genomsnittet, så att få den operativa rapporten eller historiken från endoskopisten kan vara till hjälp vid bestämning av risk.
Risk för CP vid olika koloskopiska ingrepp: 1,36-37
-Screeningskoloskopi: 0,01-0,1%
-Anastomotisk strängningsutvidgning: 0-6%
-Crohns sjukdom strängningsutvidgning: 0-18%
-Stent placering: 4%
-Colonic dekompressionsrörsplacering: 2%
-Colonic endoskopisk slemhinnoresektion 0-5%
Bortsett från händelserna under procedur, specifika riskfaktorer för CP inkluderar avancerad ålder, multipel comorbiditet, divertikulos, obstruktion, resektion av polyper, polyper som är större än 1 cm i storlek eller de som finns i rätt kolon, nedsatt rörlighet i kolon, befintlig svaghet i kolonväggen , tidigare ofullständigt försök till koloskopi, eller endoskopisterfarenhet.20
Patienter med CP kan uppleva plötslig, förvärrad buksmärta, följt av den falskt betryggande fullständiga försvagningen av smärta när perforeringen dekomprimerar det inflammerade organet. När maginnehållet fortsätter att spilla in i bukhinnan, utvecklas förvärrad smärta och bukhinnesymtom. Symtomen kommer dock att variera beroende på perforeringens plats och storlek, graden av fekal sippring i bukhinnan, och patientens ålder och comorbiditeter.
Perforationer kan särskilt vara retroperitoneal, motsvarande plats för stigande och fallande kolon och lever- och mjälteböjningar. Även om det vanligaste symptomet på kolonperforering är buksmärta, kan äldre patienter få ett trubbigt svar. Andra symtom inkluderar feber, illamående, kräkningar, dyspné, bröstsmärta, scapulär smärta och nacksmärta. Speciellt retroperitoneala perforeringar kan ha minimala eller atypiska symtom, och vitala tecken kan visa takykardi och feber, men kan också vara normala.20
Initial hantering av en misstänkt perforering inkluderar uppmärksamhet på luftvägar, andning, cirkulation med 2 IV-hål med stora hål, kristalloidvätskor och hjärtmonitor. Labs inklusive CBC, CMP, lipas, typ och skärm erhållas bör erhållas. Patienten ska vara strikt NPO med empiriska IV-antibiotika. Statisk avbildning med CT-buk / bäcken eller röntgen i buken om instabil bör beställas tillsammans med ett statligt kirurgiskt samråd.21
Post-polypektomisyndrom
Post-polypektomisyndrom, även känt som post-polypektomi elektrokoagulationssyndrom eller transmural brännsyndrom, resultat av elektrokoagulationsskada på tarmväggen, vilket skapar en transmural brännskada och fokal peritonit utan uppriktig perforering.38 Den rapporterade incidensen varierar från 3 per 100.000 (0,003%) till 1 av 1000 (0,1% ). Post-polypektomisyndrom rapporterades hos 6 patienter av 16 318 koloskopier utförda mellan 1994 och 2002 i ett stort integrerat hälsosystem.39 Riskfaktorer för denna ovanliga komplikation är okända.
Patienter med post-polypektomisyndrom vanligtvis närvarande inom 12 timmar efter koloskopi med feber, takykardi och buksmärtor. Symtomsdebut kan dock fördröjas med upp till 5–7 dagar efter ingreppet. 40 Patienter har ofta leukocytos och kan uppvisa styvhet och takykardi, som alla efterliknar kolonperforering.41
Men till skillnad från perforering, som kan kräva framväxande kirurgi, hanteras patienter med post-polypektomisyndrom i allmänhet konservativt med intravenös vätska, smärtkontroll och gradvis förbättring av kosten, med eller utan antibiotika riktade mot gram- negativa och anaeroba patogener.42 Mindre allvarliga fall kan till och med hanteras polikliniskt med orala antibiotika och klara vätskor i 1-2 dagar. 42-43
Eftersom dessa patienter kan skilja sig från patienter med perforering, varje patient som misstänks för post-polypektomisyndrom garanterar laboratorier och avbildning. Vid post-polypektomisyndrom uppvisar CT-skanning vanligtvis fokal förtjockning av tjocktarmsväggen med omgivande fettsträngning utan extramural luft, men i milda fall kan CT vara negativ.42 Oavsett avbildningsresultat, som med perforering, om post-polypektomisyndrom misstänks, bör patienten ha en kirurgisk konsultation.
Pärlor
- Koloskopi är ett allmänt använt screeningtest hos patienter över 50 år. Komplikationer kan vara tidiga eller fördröjda. EM-läkare bör vara medvetna om de möjliga komplikationerna och deras förväntade tidslinje för att korrekt diagnostisera och hantera eventuell komplikation som presenteras.
- Komplikationer inkluderar blödning, perforering, post-polypektomisyndrom, infektion, gasexplosion och pyogen leverabscess.
- Historik om patientfaktorer och själva proceduren (underliggande tillstånd, läkemedel, om polyper avlägsnades, om kauteri användes, om det fanns omedelbar blödning) kan vägleda diagnos och hantering i ED.
- Pyogen leverabscess kan uppstå 1-2 veckor efter koloskopi med smärta och feber i höger övre kvadrant.
- Mycket av tjocktarmen är retroperitonealt. Retroperitoneala perforeringar kan orsaka vaga och atypiska symtom, så misstankens index måste vara högt.
- Post-polypektomisyndrom kan härma perforering och kan vanligtvis differentieras genom avbildning.
Referenser / ytterligare läsning:
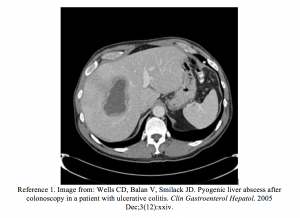
- Wells CD, Balan V, Smilack JD. Pyogen leverabscess efter koloskopi hos en patient med ulcerös kolit. Clin Gastroenterol Hepatol. 2005 dec; 3 (12): xxiv.
- Whitlock, E.P., Lin, J.S., Liles, E. et al. Screening för kolorektal cancer: en riktad, uppdaterad systematisk granskning av Task Force för förebyggande tjänster. Ann Intern Med. 2008; 149: 638–658.
- Warren JL, Klabunde CN, Mariotto AB, Meekins A, Topor M, Brown ML, Ransohoff. Biverkningar efter polikopisk koloskopi i Medicare-befolkningen. Ann Intern Med. 2009; 150 (12): 849.
- Johannsen EC, Sifri CD, Madoff LC. Pyogena leverabscesser. Infektion Dis Clin North Am. 2000; 14: 547–63.
- Meddings L, Myers RP, Hubbard J, et al. En befolkningsbaserad studie av pyogena leverabscesser i USA: Incidens, dödlighet och tidsmässiga trender. Am J Gastroenterol. 2010; 105: 117–24.
- Kaplan GG, Gregson DB, Laupland KB. Befolkningsbaserad studie av epidemiologi och riskfaktorer för pyogen leverabscess. Clin Gastroenterol Hepatol. 2004; 2: 1032-8.
- Petri A, Höhn J, Hódi Z, Wolfárd A, Balogh A. Pyogen leverabscess – 20 års erfarenhet. Jämförelse av behandlingsresultat under två perioder. Langenbecks Arch Surg. 2002; 387: 27–31.
- Pang TC, Fung T, Samra J, Hugh TJ, Smith RC. Pyogen leverabscess: En granskning av tio års erfarenhet. Världen J Gastroenterol. 2011; 17: 1622–30.
- Murarka S, Pranav F, Dandavate V. DisseminatedStreptococcus anginosus från sigmoid divertikulit. J Glob Infect Dis. 2011; 3: 79–81.
- Branum GD, Tyson GS, Branum MA, Meyers WC. Leverabscess. Förändringar i etiologi, diagnos och hantering. Ann Surg. 1990 212 december (6): 655-62.
- Gyorffy EJ, Frey CF, Silva J Jr, McGahan J. Pyogen leverabscess. Diagnostiska och terapeutiska strategier. Ann Surg. 1987 206 (6): 699-705.
- Bonenfant F, Rousseau É, Farand P. Streptococcus anginosuspyogen leverabscess efter en screeningkoloskopi. Canadian Journal of Infectious Diseases & Medicinsk mikrobiologi. 2013; 24 (2): e45-e46.
- Ian G. Harnik. Pyogen leverabscess efter malign polypektomi. Dig Dis Sci. 2007; 52: 3524–5.
- Paraskeva KD, Bury RW, Isaacs P.Streptococcus milleri leverabscesser: En ovanlig komplikation efter koloskopisk avlägsnande av ett påverkat fiskben. Gastrointest Endosc. 2000; 51: 357–8.
- Low DE, Shoenut JP, Kennedy JK, et al. Prospektiv bedömning av risken för bakteriemi med koloskopi och polypektomi. Gräva Dis Sci. 1987; 32: 1239–43.
- Becker F, Nusko G, Welke J, Hahn EG, Mansmann U. Uppföljning efter kolorektal polypektomi: En nytta-riskanalys av tyska övervakningsrekommendationer. Int J Colorectal Dis. 2007; 22: 929–39.
- Macrae FA, Tan KG, Williams CB. Mot säkrare koloskopi: En rapport om komplikationerna av 5000 diagnostiska eller terapeutiska koloskopier. Mage. 1983; 24: 376–83.
- Nelson, D.B.Infektionssjukdomskomplikationer av GI-endoskopi: del II, exogena infektioner. Gastrointest Endosc. 2003; 57: 695–711.
- Khashab, M.A., Chithadi, K.V., Acosta, R.D. et al. Antibiotikaprofylax för GI-endoskopi. ASGE Standards of Practice Committee. Gastrointest Endosc. 2015; 81: 81-89.
- Lohsiriwat V. Kolonoskopisk perforering: Incidens, riskfaktorer, hantering och resultat. World Journal of Gastroenterology: WJG. 2010; 16 (4): 425-430.
- American College of Radiology ACR Appropriateness Criteria: Acute (Nonlocalized)
- Ko, C.W. och Dominitz, J.A. Komplikationer av koloskopi: storlek och förvaltning. Gastrointest Endosc Clin N Am. 2010; 20: 659–671.
- Warren JL, Klabunde CN, Mariotto AB, et al. Biverkningar efter polikopisk koloskopi i Medicare-befolkningen. Ann Intern Med 2009; 150: 849-57.
- Hui, A.J., Wong, R.M., Ching, J.Y. et al. Risk för koloskopisk polypektomi-blödning med antikoagulantia och trombocytagenter: analys av 1657 fall. Gastrointest Endosc. 2004; 59: 44–48.
- Sawhney, M.S., Salfiti, N., Nelson, D.B. et al. Riskfaktorer för allvarlig fördröjd blödning med efterpolypektomi. Endoskopi. 2008; 40: 115–119
- Yousfi, M., Gostout, C.J., Baron, T.H. et al. Postpolypektomi nedre gastrointestinal blödning: potentiell roll för aspirin. Am J Gastroenterol. 2004; 99: 1785–1789.
- American College of Radiology ACR-lämplighetskriterier: Radiologisk hantering av blödning i nedre mag-tarmkanalen. https://acsearch.acr.org/docs/69457/Narrative/ (Åtkomst 16 juli 2017).
- Lohsiriwat V, Sujarittanakarn S, Akaraviputh T, Lertakyamanee N, Lohsiriwat D, Kachinthorn U. Kolonoskopisk perforering: En rapport från Endoscopy Training Center i World Gastroenterology Organization i Thailand. Världen J Gastroenterol. 2008; 14: 6722–6725.
- Iqbal CW, Cullinane DC, Schiller HJ, Sawyer MD, Zietlow SP, Farley DR. Kirurgisk hantering och resultat av 165 koloskopiska perforeringar från en enda institution. Arch Surg. 2008; 143: 701–706; diskussion 706-707.
- Teoh AY, Poon CM, Lee JF, Leong HT, Ng SS, Sung JJ, Lau JY. Resultat och prediktorer för dödlighet och stombildning vid kirurgisk hantering av koloskopiska perforeringar: en multicenteröversikt. Arch Surg. 2009; 144: 9–13.
- Lüning TH, Keemers-Gels ME, Barendregt WB, Tan AC, Rosman C. Kolonoskopiska perforeringar: en översyn av 30 366 patienter. Surg Endosc. 2007; 21: 994–997.
- Mai CM, Wen CC, Wen SH, Hsu KF, Wu CC, Jao SW, Hsiao CW. Iatrogen kolperforering genom koloskopi: en dödlig komplikation för patienter med hög bedövningsrisk. Int J Colorectal Dis. 2010 apr; 25 (4): 449-54.
- Rathgaber SW, Wick TM. Kolonoskopifullständighet och komplikationsgrader i en gastroenterologipraxis i samhället. Gastrointest Endosc. 2006; 64: 556–562.
- Damore LJ, Rantis PC, Vernava AM, Longo WE. Koloskopiska perforeringar. Etiologi, diagnos och hantering. Dis Colon Rectum. 1996; 39: 1308–1314.
- Repici A, Pellicano R, Strangio G, Danese S, Fagoonee S, Malesci A. Endoskopisk mukosresektion för tidig kolorektal neoplasi: patologisk bas, procedurer och resultat. Dis Colon Rectum. 2009; 52: 1502–1515.
- Chukmaitov A, Bradley CJ, Dahman B, et al. Förening av polypektomitekniker, endoskopvolym och anläggningstyp med koloskopikomplikationer. Gastrointest Endosc. 2013; 77: 436.
- Fisher DA, Maple DT, et al. Komplikationer av koloskopi. ASGE Standards of Practice Committee Gastrointest Endosc. 2011; 74: 745. Buksmärta och feber eller misstänkt abdominal abscess; Variant 1: Postoperativ patient med feber. https://acsearch.acr.org/docs/69356/Narrative/ (Åtkom 17 juli 2017).
- Hirasawa K, Sato C, Makazu M, et al. Koagulationssyndrom: Försenad perforering efter endoskopisk kolorektal behandling. World Journal of Gastrointestinal Endoscopy. 2015; 7 (12): 1055-1061.
- Levin TR, Zhao W, Conell C, Seeff LC, Manninen DL, Shapiro JA, Schulman J. Komplikationer av koloskopi i ett integrerat vårdsystem. Ann Intern Med. 2006; 145 (12): 880.
- Kim HW. Vad skiljer sig mellan postpolypektomifeber och postpolypektomikoagulationssyndrom? Clin Endosc. 2014; 47 (3): 205–6.
- Lager C, Ihle P, Sieg A, Schubert I, Hoffmeister M, Brenner H Biverkningar som kräver sjukhusvistelse inom 30 dagar efter poliklinisk screening och icke-screening koloskopi. Gastrointest Endosc. 2013 mar; 77 (3): 419-29.
- Sethi A, sång LMWK. Biverkningar relaterade till endoskopisk endoskopisk slemhinnoresektion och polypektomi. Gastrointest Endosc Clin N Am. 2015; 25 (1): 55–69.
- Benson BC, Myers JJ, Laczek JT. Postpolypectomy elektrokoagulationssyndrom: En efterliknande av kolonperforering. Fall Rep Emerg Med. 2013; 2013 687931.