Maligne intravaskuläre Entzündung
Sepsis wurde als Prozess einer malignen intravaskulären Entzündung bezeichnet . Normalerweise sorgt eine starke, komplexe, immunologische Kaskade für eine sofortige Schutzreaktion auf die Invasion von Mikroorganismen beim Menschen. Eine unzureichende immunologische Abwehr kann die Etablierung einer Infektion ermöglichen. Eine übermäßige oder schlecht regulierte Reaktion kann den Wirt jedoch durch eine schlecht angepasste Freisetzung von selbst erzeugten entzündlichen Verbindungen schädigen (siehe Abbildung unten).
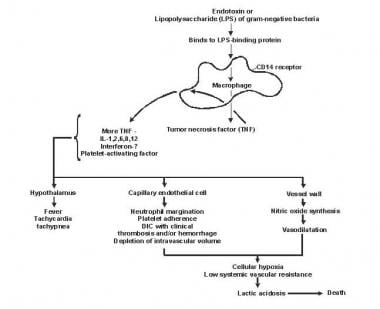 Pathogenese von Sepsis und Multiorganversagen.
Pathogenese von Sepsis und Multiorganversagen. Lipid A und andere Bakterienprodukte setzen Zytokine und andere Immunmodulatoren frei, die die klinischen Manifestationen der Sepsis vermitteln. Interleukine, Tumornekrosefaktor (TNF) -α, Interferon-Gamma (IFN-γ) und andere koloniestimulierende Faktoren werden innerhalb von Minuten oder Stunden nach Wechselwirkungen von Monozyten und Makrophagen mit Lipid A schnell produziert / div>
Die Freisetzung entzündlicher Mediatoren wird zu einem selbststimulierenden Prozess und die Freisetzung anderer solcher Mediatoren, einschließlich Interleukin (IL) -1, Thrombozytenaktivierungsfaktor, IL-2, IL-6, IL-8, IL-10 und Stickoxid (NO) erhöhen die Zytokinspiegel weiter. Dies führt zu einer fortgesetzten Aktivierung von polymorphkernigen Leukozyten (PMNs), Makrophagen und Lymphozyten; Proinflammatorische Mediatoren rekrutieren mehr dieser Zellen. Alle diese Prozesse erzeugen einen Zustand destruktiver immunologischer Dissonanz.
Sepsis wird als autodestruktiver Prozess beschrieben, der eine Verlängerung der normalen pathophysiologischen Reaktion auf eine Infektion ermöglicht, um ansonsten normale Gewebe und Ergebnisse einzubeziehen in MODS. Organfunktionsstörungen oder Organversagen können das erste klinische Zeichen einer Sepsis sein, und kein Organsystem ist gegen die Folgen der entzündlichen Exzesse der Sepsis immun. Die Mortalität steigt mit zunehmendem Organversagen.
Obwohl unkontrolliert, liegen in der Regel systemische Hinweise auf eine proinflammatorische und entzündungshemmende Hochregulation vor, was darauf hindeutet, dass die Homöostase der Wirtsabwehr versagt ist der letzte Weg von der Sepsis zum MODS und nicht die einfache durch Hypotonie verursachte Verletzung des Endorgans, wie sie bei einem hämorrhagischen Schock auftreten kann. Das Überleben nach schwerer Sepsis mit MODS ist normalerweise mit einer allgemeinen Verringerung sowohl der proinflammatorischen als auch der entzündungshemmenden Reaktion verbunden.
Kürzlich wurde eine neuartige Hypothese aufgestellt, dass das Überleben nach schwerer Sepsis a erfordert Verallgemeinerte Herunterregulierung der Immunantwort des Körpers, der energetischen Funktionen und der damit verbundenen Organleistung. Somit kann MODS durch die adaptive Reaktion des Wirts auf überwältigende Entzündungen eine Entzündung beseitigen, ohne dauerhaften Schaden für das Endorgan zu verursachen. Wie unten diskutiert, zeigen alle Organe eine generalisierte Hyporesponsivität, die eindeutig gesundheitsschädlich ist, aber eine Überlebensstrategie bei schwerer Sepsis markieren kann.
Funktionsstörung der Organsysteme
Kreislaufstörung
Eine signifikante Störung der Autoregulation des Kreislaufs ist typisch für Sepsis. Vasoaktive Mediatoren verursachen eine Vasodilatation und erhöhen die mikrovaskuläre Permeabilität an der Infektionsstelle. NO spielt eine zentrale Rolle bei der Vasodilatation des septischen Schocks. Es kann auch eine beeinträchtigte Sekretion von Vasopressin auftreten, die eine anhaltende Vasodilatation ermöglichen kann.
Bei der Sepsis treten Änderungen sowohl der systolischen als auch der diastolischen ventrikulären Leistung auf. Durch die Verwendung des Frank-Starling-Mechanismus wird das Herzzeitvolumen häufig erhöht, um den Blutdruck bei systemischer Vasodilatation aufrechtzuerhalten. Patienten mit bereits bestehenden Herzerkrankungen können ihr Herzzeitvolumen nicht angemessen steigern.
Regional stört die Sepsis die Normalverteilung des systemischen Blutflusses zu den Organsystemen. Folglich erhalten Kernorgane möglicherweise keine angemessene Sauerstoffzufuhr, und das Ergebnis ist eine sogenannte regionale Hypoperfusion.
Die Mikrozirkulation ist das Hauptzielorgan für Verletzungen bei Sepsis, da es sich um ein Gefäßendothel handelt universell von den zirkulierenden Entzündungsmediatoren betroffen. Obwohl unklar ist, ob Mikrozirkulationsstörungen die Ursache oder ein unschuldiger Zuschauer der Endorganverletzung sind, wird eine deutliche mikrovaskuläre Dysfunktion beobachtet. Eine Abnahme der Anzahl perfundierter Kapillaren ist zu beobachten, obwohl bei Anwendung von Vasodilatator-Therapien eine vollständige mikrovaskuläre Rekrutierung erfolgt. Mitochondriale Dysfunktion tritt ebenfalls auf und ist häufig mit verringerten Gradienten des mitochondrialen Transmembranpotentials verbunden, die notwendig sind, um die oxidative Phosphorylierung voranzutreiben. Das Endergebnis ist eine offensichtliche Unfähigkeit der Endorgane, Sauerstoff maximal zu extrahieren.
Die Debatte geht weiter darüber, ob dieses Versagen des Energiestoffwechsels ein adaptiver zytoprotektiver Mechanismus ist, der dem Winterschlaf ähnelt oder die primäre mitochondriale Pathologie widerspiegelt. Dies sind Bereiche aktiver Forschung, die derzeit jedoch nicht in klare Richtlinien für die klinische Praxis umgesetzt werden. Eine erhöhte Kapillarendothelpermeabilität führt zu einem weit verbreiteten proteinreichen Gewebeödem.
Septischer Schock und SIRS sind durch eine reversible Myokarddepression gekennzeichnet, die sich als resistent gegen Katecholamin und Flüssigkeitsverabreichung erweisen kann. Der zirkulierende „myokardiale depressive Faktor“, der wahrscheinlich die synergistischen Wirkungen von TNF-α, IL-1β, anderen Zytokinen und NO darstellt, ist an der Pathogenese beteiligt. Die beiden Merkmale dieser akuten Stress-Myokard-Depression sind eine beeinträchtigte adrenerge Reaktionsfähigkeit und eine diastolische Dysfunktion, die dazu führen relative Katecholaminresistenz und kleine statt erweiterte Herzen. Makrovaskuläre Myokardischämie und Hypoperfusion sind unwahrscheinlich.
Bei schwerer Sepsis und septischem Schock verursachen Mikrozirkulationsstörungen und mitochondriale Depressionen regionale Gewebeprobleme. und regionale Dysoxie bleibt daher bestehen. Dieser Zustand wird als Mikrozirkulations- und Mitochondrien-Distress-Syndrom (MMDS) bezeichnet. Sepsis-induzierte entzündliche autoregulatorische Dysfunktion bleibt bestehen und der Sauerstoffbedarf wird nicht durch die Versorgung gedeckt, was zu MODS führt.
Umverteilung des intravaskulären Flüssigkeitsvolumens infolge eines verringerten arteriellen Gefäßtonus und einer verminderten venösen Rückkehr aus dem venösen di Die Freisetzung und Freisetzung von myokardial depressiven Substanzen führt zu einer Hypotonie.
Lungenfunktionsstörung
Endothelschäden im Lungengefäßsystem führen zu Störungen Kapillarblutfluss und verbesserte mikrovaskuläre Permeabilität, was zu interstitiellen und alveolären Ödemen führt. Der Einschluss von Neutrophilen in die pulmonale Mikrozirkulation initiiert und verstärkt die Schädigung der Alveolarkapillarmembranen. Akute Lungenverletzung und akutes Atemnotsyndrom (ARDS) sind häufige Manifestationen dieser Effekte. In der Tat sind Sepsis und Lungenentzündung die häufigsten Ursachen für ARDS.
Gastrointestinale Dysfunktion
Der Magen-Darm-Trakt (GI) kann helfen, die Verletzung der Sepsis zu verbreiten. Das Überwachsen von Bakterien im oberen GI-Trakt kann in die Lunge abgesaugt werden, was zu einer nosokomialen oder Aspirationspneumonie führt. Die normale Barrierefunktion des Darms kann beeinträchtigt werden, was die Translokation von Bakterien, Endotoxinen und normalen Verdauungsproteasen in den systemischen Kreislauf ermöglicht und die septische Reaktion verlängert.
Septischer Schock kann dazu führen paralytischer Ileus, der zu einer Verzögerung der enteralen Ernährung führen kann. Es wird angenommen, dass eine übermäßige NO-Produktion der Erreger des Sepsis-induzierten Ileus ist. Die optimale Nahrungsaufnahme wird angesichts des hohen Protein- und Kalorienbedarfs beeinträchtigt. Betäubungsmittel und Muskelrelaxantien können die Motilität des GI-Trakts weiter verschlechtern.
Leberfunktionsstörung
Infolge der Rolle, die die Leber spielt Bei der Wirtsabwehr können die durch Leberfunktionsstörungen verursachten abnormalen Synthesefunktionen sowohl zur Einleitung als auch zum Fortschreiten der Sepsis beitragen. Das retikuloendotheliale System der Leber fungiert als erste Verteidigungslinie bei der Beseitigung von Bakterien und ihren Produkten. Eine Leberfunktionsstörung führt zu einem Überlaufen dieser Produkte in den systemischen Kreislauf.
Leberversagen („schockierte Leber“) kann sich durch Erhöhungen der Leberenzyme und des Bilirubins, Gerinnungsstörungen und Nichtausscheidung von Toxinen wie Ammoniak, die zu einer Verschlechterung der Enzephalopathie führen.
Nierenfunktionsstörung
Akute Nierenverletzung (AKI) Oft begleitet Sepsis. Verschiedene Ursachen für AKI wurden berichtet, und die Ursache wird typischerweise als multifaktoriell angesehen. Der Mechanismus von AKI ist komplex, beinhaltet jedoch wahrscheinlich eine Abnahme des effektiven intravaskulären Volumens infolge systemischer Hypotonie, direkter Nieren-Vasokonstriktion, Freisetzung von Zytokinen. und Aktivierung von Neutrophilen durch Endotoxine und andere Peptide, die zur Nierenschädigung beitragen. Dennoch zeigen die meisten Tierstudien, dass der Nierenblutfluss bei Sepsis erhöht und nicht verringert wird, obwohl dies mit einer beeinträchtigten tubulären Funktion und einem Mangel an signifikanten histologischen Hinweisen auf tu verbunden ist buläre Verletzung.
Funktionsstörung des Zentralnervensystems
Die Beteiligung des Zentralnervensystems (ZNS) an der Sepsis führt zu Enzephalopathie und peripheren Erkrankungen Neuropathie. Die Pathogenese ist schlecht definiert, hängt aber wahrscheinlich mit der systemischen Hypotonie zusammen, die zu einer Hypoperfusion des Gehirns führen kann.
Koagulopathie
Subklinische Koagulopathie, signalisiert durch eine leichte Erhöhung der Thrombinzeit (TT) oder aktivierte partielle Thromboplastinzeit (aPTT) oder eine moderate Verringerung von die Thrombozytenzahl ist äußerst häufig; Es kann sich jedoch auch eine offen disseminierte intravaskuläre Koagulation (DIC) entwickeln. Protease-aktivierte Rezeptoren (PARs), insbesondere PAR 1, bilden die molekulare Verbindung zwischen Gerinnung und Entzündung. PAR1 übt zytoprotektive Wirkungen aus, wenn es durch aktiviertes Protein C oder niedrig dosiertes Thrombin stimuliert wird, übt jedoch störende Wirkungen auf die Endothelzellbarrierefunktion aus, wenn es durch hoch dosiertes Thrombin aktiviert wird.
Mechanismen der Organfunktionsstörung und -verletzung
Die genauen Mechanismen der Zellverletzung und der daraus resultierenden Organfunktionsstörung bei Sepsis sind nicht vollständig bekannt. MODS ist mit einer weit verbreiteten Endothel- und Parenchymzellverletzung verbunden, von der einige durch die folgenden 4 vorgeschlagenen Mechanismen erklärt werden können.
Hypoxische Hypoxie
Die septische Kreislaufläsion stört die Sauerstoffversorgung des Gewebes, verändert die metabolische Regulation der Sauerstoffzufuhr im Gewebe und trägt zur Funktionsstörung der Organe bei. Mikrovaskuläre und endotheliale Anomalien tragen zum septischen Mikrozirkulationsdefekt bei Sepsis bei. Die reaktiven Sauerstoffspezies, lytischen Enzyme und vasoaktiven Substanzen (z. B. NO und endotheliale Wachstumsfaktoren) führen zu einer Mikrozirkulationsverletzung, die durch die Unfähigkeit der Erythrozyten verstärkt wird, sich in der septischen Mikrozirkulation zurechtzufinden.
Direkte Zytotoxizität
Endotoxin, TNF-α und NO können den mitochondrialen Elektronentransport schädigen und zu einem gestörten Energiestoffwechsel führen. Dies wird als zytopathische oder histotoxische Anoxie bezeichnet, eine Unfähigkeit, Sauerstoff zu nutzen, selbst wenn er vorhanden ist.
Apoptose
Apoptose ( programmierter Zelltod) ist der Hauptmechanismus, durch den dysfunktionelle Zellen normalerweise eliminiert werden. Die proinflammatorischen Zytokine können die Apoptose in aktivierten Makrophagen und Neutrophilen verzögern, aber andere Gewebe (z. B. Darmepithel) können eine beschleunigte Apoptose erfahren. Daher spielt die Störung der Apoptose eine entscheidende Rolle bei der Gewebeverletzung der Sepsis.
Immunsuppression
Die Wechselwirkung zwischen proinflammatorischer und entzündungshemmende Mediatoren können zu einem Ungleichgewicht zwischen ihnen führen. Eine Entzündungsreaktion oder ein Immundefekt können vorherrschen oder beides kann vorhanden sein.
Wirtsreaktion und andere Faktoren, die das Ergebnis beeinflussen
Klinische Merkmale, die sich auf den Schweregrad beziehen Die Sepsis umfasst die Reaktion des Wirts auf eine Infektion, den Ort und die Art der Infektion, den Zeitpunkt und die Art der antimikrobiellen Therapie, den betreffenden Organismus, die Entwicklung eines Schocks, die Grunderkrankung, den langfristigen Gesundheitszustand des Patienten und die Anzahl der gescheiterten Patienten Organe. Faktoren, die zu Sepsis und septischem Schock führen, sind möglicherweise nicht wesentlich für die Bestimmung des endgültigen Ergebnisses.
Die Reaktion des Wirts auf Sepsis ist sowohl durch proinflammatorische Reaktionen als auch durch entzündungshemmende immunsuppressive Reaktionen gekennzeichnet. Die Richtung, das Ausmaß und die Dauer dieser Reaktionen werden sowohl von Wirtsfaktoren (z. B. genetische Merkmale, Alter, gleichzeitig bestehende Krankheiten, Medikamente) als auch von Pathogenfaktoren (z. B. mikrobielle Belastung, Virulenz) bestimmt.
Entzündungsreaktionen werden durch Wechselwirkung zwischen pathogenassoziierten molekularen Mustern, die von Pathogenen exprimiert werden, und Mustererkennungsrezeptoren ausgelöst, die von Wirtszellen an der Zelloberfläche exprimiert werden (tollartige Rezeptoren und C-Typ) Lectinrezeptoren), im Endosom (TLRs) oder im Zytoplasma (Retinsäure-induzierbare Gen 1-ähnliche Rezeptoren und Nucleotid-bindende Oligomerisierungsdomänen-ähnliche Rezeptoren).
Die Folge einer übertriebenen Entzündung ist eine Schädigung des Kollateralgewebes und ein nekrotischer Zelltod, was zur Freisetzung von schädigungsassoziierten molekularen Mustern führt, sogenannten Gefahrenmolekülen, die die Entzündung zumindest aufrechterhalten teilweise durch Einwirkung auf dieselben Mustererkennungsrezeptoren, die durch Krankheitserreger ausgelöst werden.