US Pharm. 2018; 43 (7): 22-26.
ZUSAMMENFASSUNG: Statine sind eine Klasse von Medikamenten, die häufig zur primären und sekundären Prävention von kardiovaskulären Ereignissen eingesetzt werden. Mit sechs generisch verfügbaren Statinen kann die Auswahl eines geeigneten Wirkstoffs auf der Grundlage von arzneimittelspezifischen Faktoren bestimmt werden, einschließlich Dosierungsüberlegungen, Arzneimittelwechselwirkungen und unerwünschten Ereignissen. Auf der Grundlage von Daten aus wichtigen klinischen Studien, unterschiedlichen Richtlinien und aktuellen Managementempfehlungen für zwei wichtige unerwünschte Ereignisse im Zusammenhang mit der Verwendung von Statin können individuelle Pläne für die Patientenversorgung entwickelt werden.
Der Eckpfeiler der Behandlung mit Dyslipidämie ist die Verwendung von 3-Hydroxy-3-methylglutaryl-Coenzym-A-Reduktase-Inhibitoren, besser bekannt als Statine. Mit einer Vielzahl von generischen Optionen auf dem Markt und starken Beweisen für ihre Verwendung gehören Statine zu den am häufigsten verschriebenen Medikamenten der Welt.1 Die häufige Verwendung dieser Wirkstoffe hat jedoch zu einer kontinuierlichen Überprüfung ihrer Sicherheit und einer anhaltenden Debatte über ihre Verwendung geführt Rolle in der Therapie. Dieser Artikel, der sich auf generische Statine konzentriert, wird die Debatte über die Rolle von Statinen in der Therapie hervorheben, die ordnungsgemäße Verwendung erörtern und Hinweise auf zwei schwerwiegende unerwünschte Ereignisse untersuchen.
Von den sieben verschiedenen Statinen auf dem Markt sind sechs sind generisch erhältlich (TABELLE 1) .2-7 Drei verfügbare Markenformulierungen sind Pitavastatin (Livalo), Simvastatin-Suspension zum Einnehmen (FloLipid) und Lovastatin mit verlängerter Freisetzung (Altoprev) .8-10 Die Rolle von Markenwirkstoffen in der Therapie ist begrenzt die weit verbreitete Verfügbarkeit generischer Optionen.
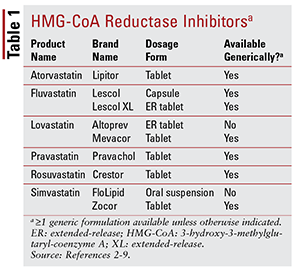
Atorvastatin und Simvastatin sind auch generisch in verfügbar mehrere Kombinationsprodukte. Dazu gehören die Kombination von Atorvastatin und Amlodipin, einem Kalziumkanalblocker (CCB), der für Bluthochdruck angezeigt ist, und die Kombination von Simvastatin und Ezetimib, einem intestinalen Cholesterinabsorptionshemmer, der auch für Hypercholesterinämie angezeigt ist.11,12 Formulierte Statin- und Niacinprodukte (Niacin / Lovastatin und Niacin / Simvastatin) wurden 2016 vom Markt genommen, da keine Beweise dafür vorlagen, dass die Zugabe von Niacin bei mit Statin behandelten Patienten die kardiovaskulären (CV) Ergebnisse weiter reduziert, als dies bei Statinen allein der Fall ist.13
BEHANDLUNGSEMPFEHLUNGEN
Statine haben sich wiederholt als wirksam erwiesen, um den LDL-Cholesterin- (LDL-C) und Triglyceridspiegel zu senken und gleichzeitig den HDL-Cholesterinspiegel (HDL-C) zu erhöhen.14 Darüber hinaus wurde gezeigt, dass sie sich signifikant verbessern Patientenorientierte Ergebnisse, wie z. B. wichtige CV-Ereignisse (CVEs), sowohl in der Primär- als auch in der Sekundärprävention.15-19
Mehrere stark diskutierte Behandlungsrichtlinien diskutieren die Rolle von Statinen bei der Behandlung von Hy Perlipidämie. Dazu gehören die Richtlinie 2013 des American College of Cardiology / American Heart Association (ACC / AHA) und die Richtlinie der American Academy of Clinical Endocrinology (AACE) 2017.14,20 Beide Richtlinien legen nahe, dass nach der Umsetzung von Änderungen des Lebensstils, einschließlich der Raucherentwöhnung, die Richtlinien eingehalten werden Als Trainingsprogramm und nach einer herzgesunden Ernährung sind Statine eine Erstlinientherapie zur primären und sekundären Prävention von CV-Erkrankungen (CVD) .14,20 Die Richtlinien unterscheiden sich jedoch darin, wie bestimmt werden kann, welche Statine für welche geeignet sind Patienten.
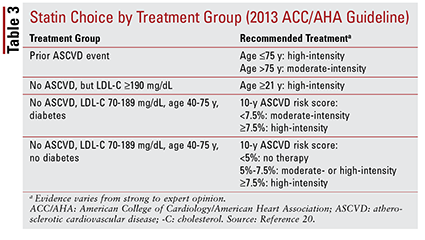
Mit der ACC / AHA-Richtlinie 2013 wurden vier Behandlungsgruppen für die Statintherapie eingeführt:
1. Patienten mit vorheriger atherosklerotischer CVD (ASCVD), einschließlich Patienten mit einem früheren Ereignis (dh akutem Koronarsyndrom, Myokardinfarkt in der Vorgeschichte, stabiler oder instabiler Angina pectoris, koronarer oder anderer arterieller Revaskularisation, Schlaganfall, vorübergehendem ischämischem Anfall oder vermuteter peripherer arterieller Erkrankung atherosklerotischer Ursprung).
2. Patienten ohne Vorgeschichte eines ASCVD-Ereignisses mit einem LDL-C-Spiegel von 190 mg / dl oder höher. Das Alter ist keine Grundlage für den Ausschluss von diesem Kriterium.
3. Patienten im Alter von 40 bis 75 Jahren mit Diabetes, aber ohne Vorgeschichte eines ASCVD-Ereignisses und einem LDL-C-Spiegel zwischen 70 und 189 mg / dl.
4. Patienten im Alter von 40 bis 75 Jahren ohne Diabetes, bei denen in der Vorgeschichte kein ASCVD-Ereignis aufgetreten ist und deren LDL-C-Spiegel zwischen 70 und 189 mg / dL.20
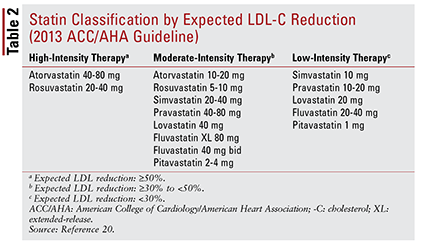
Die ACC / AHA-Richtlinie führte auch die Idee ein, Statine zu gruppieren nach Intensität (dh ihrer erwarteten Fähigkeit zur Senkung des LDL-C) (TABELLE 2) .20 Basierend auf der Behandlungsgruppe (wie oben definiert) empfiehlt die Leitlinie spezifische Statinintensitäten für bestimmte klinische Situationen (TABELLE 3) .20 Mehrere Behandlungsgruppen erfordern die Berechnung eines ASCVD-Risikoscores unter Verwendung eines ASCVD-Risikoschätzers. Dieses Online-Tool berücksichtigt Alter, Geschlecht, Rasse, systolischen Blutdruck, Gesamtcholesterin, HDL-C und die Krankengeschichte des Patienten, die für die Behandlung von Bluthochdruck, Diabetes oder Rauchen von Bedeutung sind.21 Sobald alle Eingaben eingegeben wurden, werden die 10 des Patienten eingegeben -Jahresrisiko für ein ASCVD-Ereignis wird berechnet.
Diese Empfehlungen gelten nicht automatisch für bestimmte Untergruppen von Patienten. Beispielsweise sollte die Verwendung von Statinen bei älteren Erwachsenen mit Vorsicht angegangen werden. Obwohl die Verwendung von Statin zur Sekundärprävention bei älteren Patienten einen signifikanten Nutzen bringt, ist die Verwendung zur Primärprävention unklar.22-24 Darüber hinaus wurde bei Patienten mit Herzinsuffizienz nicht der gleiche Nutzen aus der Statintherapie wie bei Patienten ohne Herzinsuffizienz festgestellt.25 Basierend Zu diesen Befunden gehören zu den Behandlungsempfehlungen die Begrenzung der Einleitung von hochintensiven Statinen auf Patienten unter 75 Jahren und möglicherweise die Vermeidung von Statinen bei Patienten mit Herzinsuffizienz.20 Insgesamt ist die Entscheidung, Statine in diesen Gruppen zu verwenden, nicht eindeutig und sollte dies beinhalten ein fortlaufendes Gespräch zwischen Anbieter und Patient über mögliche Risiken und Vorteile der Therapie.20
Entgegen der ACC / AHA-Empfehlung von 2013, die Therapie gemäß der Klassifizierung der Behandlungsgruppen einzuleiten, empfiehlt die AACE-Richtlinie 2017, dass einzelne Patienten behandelt werden Behandlung basierend auf Laborbefunden.14 Nach dieser Richtlinie wird das Patientenrisiko durch eine Vielzahl wichtiger, zusätzlicher a bestimmt nd nichttraditionelle Risikofaktoren. Einzelpersonen werden dann in eine von fünf Risikogruppen mit jeweils einem entsprechenden LDL-C- und Nicht-HDL-C-Ziel eingeteilt (TABELLE 4). Basierend auf den aktuellen Werten und individuellen Zielen sollten Statine allein oder in Kombination mit anderen Wirkstoffen basierend auf der erwarteten Fähigkeit zur Senkung von LDL-C oder Nicht-HDL-C initiiert werden.14

Die Kombinationsbehandlung mit der Zugabe eines zweiten Wirkstoffs zur laufenden Statintherapie bleibt ein etwas kontroverses Thema. Während frühere Studien und Leitlinien die Zugabe anderer Wirkstoffe zur Hintergrund-Statin-Therapie minimierten, unterstützen neuere Studien und Konsenserklärungen – einschließlich einer von ACC / AHA – die Verwendung von Ezetimib, Evolocumab oder Alirocumab, von denen die letzten beiden Proproteinkonvertase-Subtilisin sind / Kexin-Typ-9-Inhibitoren als Zusatztherapie zur Sekundärprävention.20,26-31 Allerdings bleiben Statine sowohl in der Primär- als auch in der Sekundärprävention eine universelle Erstlinientherapie. Die endgültige Rolle anderer spezifischer Wirkstoffe bleibt unklar.
STATINAUSWAHL
Die Wahl der Statintherapie beginnt mit dem vom Arzt bevorzugten Behandlungsansatz, unabhängig davon, ob dies die ACC / AHA-Methode zur Statinbehandlung ist Gruppen oder die AACE-Methode von LDL-C- oder Nicht-HDL-C-Zielen. Von dort aus müssen die Eigenschaften jedes Statins berücksichtigt werden, um die beste Option für den einzelnen Patienten zu bestimmen. Nicht alle Statine sind gleich, und es gibt verschiedene Hauptunterschiede, die die Patientenauswahl beeinflussen können, einschließlich Überlegungen zur Dosierung, Arzneimittelwechselwirkungen und unerwünschten Ereignissen (UE).
Dosierung
Obwohl die meisten Statine dies können Ohne Rücksicht auf die Mahlzeiten sollte Lovastatin mit sofortiger Freisetzung (IR) wegen erhöhter Bioverfügbarkeit zusammen mit dem Abendessen eingenommen werden.4 Das Gegenteil gilt jedoch für Lovastatin mit verlängerter Freisetzung, das aufgrund der verminderten Bioverfügbarkeit nicht zusammen mit Nahrungsmitteln eingenommen werden sollte .8 Obwohl alle Statine einmal täglich verabreicht werden können, müssen IR-Fluvastatin und Lovastatin möglicherweise zweimal täglich verabreicht werden.3,4 Schließlich können zu jeder Tageszeit Atorvastatin, Pravastatin und Rosuvastatin, Fluvastatin, Lovastatin und verabreicht werden Simvastatin sollte abends eingenommen werden.3,4,7 Insbesondere Simvastatin zeigte abends eine signifikant andere Wirksamkeit als morgens.32
Wechselwirkungen mit anderen Medikamenten
Jedes Statin hat ein anderes Bedenken hinsichtlich Arzneimittel-Arzneimittel- und Arzneimittel-Lebensmittel-Wechselwirkungen aufgrund der spezifischen Wege, über die jeder metabolisiert wird (TABELLE 5). Es gibt zu viele Arzneimittelwechselwirkungen, um sie im Detail zu diskutieren. Daher werden im Folgenden nur einige wenige beschrieben.
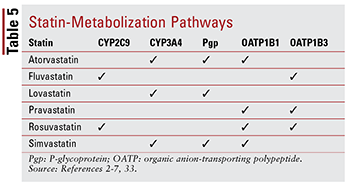
Fibrate: Obwohl die Kombination Es wurde nicht gezeigt, dass ein Fibrat und ein Statin die klinischen Ergebnisse signifikant verändern. Patienten können weiterhin Gemfibrozil, Fenofibrat oder Fenofibrinsäure zusammen mit einem Statin verschrieben werden, um eine schwer unkontrollierte Hypertriglyceridämie zu bekämpfen.14,20,26,33 Aufgrund dieser beiden Klassen sind mit muskelbedingter Toxizität verbunden, eine Kombinationstherapie erhöht dieses Risiko im Vergleich zu beiden Therapien allein signifikant.33 Diese additive Toxizität tritt bei Gemfibrozil häufiger auf als bei anderen Fibraten.33 Daher ist die Anwendung von Gemfibrozil bei Simvastatin kontraindiziert und sollte bei anderen vermieden werden Statine.7,20 Wenn ein Statin und ein Fibrat zusammen verwendet werden, wird Fenofibrat oder Fenofibrinsäure bevorzugt.20,33 Wenn jedoch Gemfibrozil verwendet werden muss, Fluvastatin – oder bei sorgfältiger Überwachung Atorvastatin oder Rosuvastatin (maximal 10 mg täglich) ) – ist der Agent der Wahl.33
Amiodaron: Dieses für Kammerflimmern indizierte Antiarrhythmikum ist ein bekannter Inhibitor des P-Glykoproteins (Pgp) und des CYP450-Enzymsystems, insbesondere CYP3A4 und in geringerem Maße CYP2C9.33,34 As a Daher gibt es empfohlene Höchstdosierungen für Lovastatin (maximal 40 mg täglich) und Simvastatin (maximal 20 mg täglich) bei Anwendung mit Amiodaron.4,7,33 Obwohl Atorvastatin über CYP3A4 metabolisiert wird, ist keine Dosisanpassung erforderlich (ähnlich wie bei anderen Statinen). da die Daten keine schwerwiegenden Nebenwirkungen nahe legen, wenn Atorvastatin und Amiodaron gleichzeitig angewendet werden.2,33
CCBs: Es wurde gezeigt, dass sowohl Dihydropyridin (Amlodipin) als auch Nicht-Dihydropyridin-CCBs (Diltiazem, Verapamil) bedeutsame Wechselwirkungen mit Statinen aufweisen . Ähnlich wie Amiodaron hemmen Amlodipin, Diltiazem und Verapamil CYP3A4.33,35-37. Amlodipin hat auch eine hemmende Wirkung auf Pgp.33,35. Basierend auf den in der Literatur angegebenen Nebenwirkungen wird eine maximale Tagesdosis von 20 mg für Lovastatin empfohlen, wenn Anwendung mit Amlodipin, Diltiazem oder Verapamil.4,33 Es wird auch empfohlen, dass Simvastatin bei Anwendung mit Amlodipin 20 mg nicht überschreitet. Bei Verwendung mit Diltiazem und Verapamil sollte jedoch eine niedrigere Dosis von 10 mg verabreicht werden.7,33 Keine spezifische Dosierung Es gibt Empfehlungen für Atorvastatin, obwohl Vorsicht geboten ist, wenn es mit einem der Nicht-Dihydropyridin-CCBs verabreicht wird.2,33
Nebenwirkungen
Statine werden im Allgemeinen gut vertragen; Die Abbruchraten bleiben jedoch hoch.38 Der Abbruch der Statintherapie und das Versäumnis, die Statintherapie nach dem Auftreten unerwünschter Arzneimittelwirkungen wieder aufzunehmen, sind mit erhöhten CVE-Raten verbunden.39 Bedenken der Patienten hinsichtlich der Statinsicherheit angesichts zweier wichtiger statinbedingter Nebenwirkungen – Myotoxizität und neu auftretender Diabetes – können zum Absetzen des Statins führen.
Myotoxizität: Statine sind seit langem mit muskelbedingter Toxizität verbunden, einschließlich Myalgie (Muskelschmerzen ohne erhöhte Kreatinkinase) und Myopathie (allgemeiner Begriff für Muskel) Krankheit) und Myositis (Muskelentzündung), von denen die letzten beiden signifikante CK-Erhöhungen beinhalten.40,41 Alle Statine warnen vor der seltenen, aber schwerwiegenden Nebenwirkung der Rhabdomyolyse.2-7 Häufig wird jedoch Statinen eine Myotoxizität zugeschrieben aufgrund des Nocebo-Effekts; Das heißt, eine Person glaubt, dass ein Medikament Schaden anrichtet und anschließend das Medikament den erwarteten Schaden verursacht.42,43 Um das beste Ergebnis zu erzielen, müssen Apotheker mit dieser häufig berichteten Nebenwirkung und ihrer ordnungsgemäßen Behandlung vertraut sein.
Es ist falsch anzunehmen, dass alle Berichte über Muskelsymptome auf den Nocebo-Effekt zurückzuführen sind. Eine ordnungsgemäße Überprüfung der Krankengeschichte des Patienten (PMH), eine Beschreibung der Schmerzen und ein Zusammenhang mit der Statintherapie sind unerlässlich.44 Erstens ermöglicht eine Untersuchung der PMH auf CK-Erhöhungen und andere mögliche Ursachen für Muskelschmerzen oder -schwäche dem Kliniker, alternative Behandlungen durchzuführen zugrunde liegende Pathophysiologie oder korrekte Faktoren, die den Statinstoffwechsel verändern können. Häufige Ursachen sind Alter, Arzneimittelwechselwirkungen, beeinträchtigte Nieren- oder Leberfunktion, erhöhte körperliche Aktivität und Vitamin-D-Mangel.20,41
Als nächstes sollte der Arzt die Präsentation des Patienten mit häufig auftretenden statininduzierten Symptomen vergleichen . Statin-induzierte Muskeltoxizität tritt normalerweise als Schmerz, Empfindlichkeit, Krämpfe und Schwäche auf, normalerweise in den Beinmuskeln.20,41 Diese Symptome sind in der Regel nach dem Training schlimmer und klingen nicht ab, ohne dass das störende Mittel abgesetzt wird.41
Der letzte Schritt besteht darin, festzustellen, ob ein kausaler Zusammenhang zwischen Symptomen und Statinkonsum besteht. Bei Verdacht auf ein Statin als Ursache für leichte bis mittelschwere Symptome wird ein vorübergehender Entzug empfohlen. Wenn sich die Symptome nach ca. 2 Wochen nicht bessern, ist das Statin wahrscheinlich nicht die Ursache und sollte in der ursprünglichen Dosis erneut eingeleitet werden. Wenn sich die Symptome jedoch bessern, sollte ein erneuter Versuch mit demselben Statin bei derselben oder einer niedrigeren Dosis durchgeführt werden. Wenn dann ähnliche Symptome auftreten, sollte das Statin als Ursache vermutet und abgesetzt werden. Nach Auflösung der Symptome sollte eine niedrige Dosis eines alternativen Statins eingeleitet und auf die maximal tolerierte Dosis titriert werden.20,41 Die Akzeptanz und das Verständnis des Patienten für diesen Prozess sind wichtig, da der Nocebo-Effekt ansonsten zu weiteren wahrgenommenen Reaktionen führen kann.
Es gibt verschiedene andere Strategien zur Behandlung und Vorbeugung dieser Symptome. Erstens kann der Arzt aufgrund einer höheren Wahrscheinlichkeit von Symptomen entscheiden, die lipophilsten Statine (Lovastatin und Simvastatin) zugunsten von hydrophileren Statinen (Fluvastatin, Pravastatin und Rosuvastatin) zu vermeiden.44 Simvastatin 80 mg sollte niemals als neu eingeleitet werden Therapie bei jedem Patienten aufgrund einer ungewöhnlich hohen Häufigkeit von statinassoziierten Muskelsymptomen.7,45 Alternative Therapien wie Coenzym Q10 haben keinen konsistenten Nutzen gezeigt, können jedoch bei Patienten mit psychisch induzierten Symptomen in Betracht gezogen werden.41,44,46 Schließlich kann eine Dosierung über einen längeren Zeitraum in Betracht gezogen werden, bei der Statin-Medikamente mehrmals wöchentlich und nicht einmal täglich dosiert werden. Dieser Ansatz verbessert die Adhärenz und die Lipidprofile bei Patienten mit früherer Statin-Intoleranz.47-49
Neu auftretender Diabetes: Eine wichtige UE im Zusammenhang mit dem Statinkonsum ist neu auftretender Diabetes. Es wurde gezeigt, dass Statine das Risiko einer Diabetesentwicklung erhöhen, obwohl einige wichtige Vorbehalte bestehen.50 Erstens ist das wahre Risiko jedes einzelnen Statins noch unbekannt, obwohl dies als Klasseneffekt angesehen werden kann.51,52 In der größten Meta – Bisher hatte Pravastatin das geringste Risiko, Simvastatin und Atorvastatin ein mäßiges Risiko und Rosuvastatin das höchste Risiko, neu auftretenden Diabetes zu verursachen.53 Keiner dieser Befunde war jedoch statistisch signifikant.53 Zusätzlich der Befund, dass Diabetes Das Risiko steigt, wenn die Statindosis inkonsistent ist.54
Statin-induzierter Diabetes tritt am häufigsten bei Personen auf, die bereits ein hohes Risiko für die Entwicklung von Diabetes haben.50,54 Dies schließt ältere Patienten und Patienten mit Prädiabetes oder Stoffwechsel ein Syndrom.50,55 Ein konsistenter Befund war, dass für jeden neuen Fall von durch Statine verursachtem Diabetes mehrere CVEs bei Patienten mit höherem Risiko verhindert werden können.50 Daher sollten Apotheker einen beraten xious Statinkonsumenten mit mittlerem oder hohem Risiko für CV-Komplikationen, dass das Risiko, an Diabetes zu erkranken, durch die Vorteile der CV-Risikominderung mehr als ausgeglichen wird. Das Nutzen-Risiko-Verhältnis ist jedoch bei Patienten mit einem sehr geringen CVE-Risiko unklar.50
SCHLUSSFOLGERUNG
Obwohl die Statintherapie nicht ohne Risiken ist, hat sie Vorteile bei der Reduzierung der CV-Ergebnisse machte es zum Eckpfeiler der CVE-Prävention. Die verfügbaren Richtlinien unterscheiden sich stark, aber die einzige Konstante ist, dass Statine bei fast jedem Patienten eine Erstlinientherapie zur Primär- und Sekundärprävention sein sollten. Die weit verbreitete generische Verfügbarkeit von Statinen hat diese Wirkstoffe zunehmend zugänglicher gemacht. Wenn der Apotheker versteht, dass nicht alle Statine gleich sind, kann er dazu beitragen, für jeden Patienten das bestmögliche Ergebnis zu erzielen.
1. IMS Institut für Gesundheitsinformatik. Verwendung und Ausgaben von Arzneimitteln in den USA: Rückblick auf 2015 und Ausblick auf 2020. https://morningconsult.com/wp-content/uploads/2016/04/IMS-Institute-US-Drug-Spending-2015.pdf. Zugriff am 18. März 2018.
2. Packungsbeilage Lipitor (Atorvastatin). New York, NY: Pfizer, Inc; Juni 2017.
3. Packungsbeilage Lescol / Lescol XL (Fluvastatin). East Hanover, NJ: Novartis Pharmaceuticals Corp; August 2017.
4. Packungsbeilage Mevacor (Lovastatin). Whitehouse Station, NJ: Merck & Co, Inc; Februar 2014.
5. Packungsbeilage Pravachol (Pravastatin). Princeton, NJ: Bristol-Myers Squibb Company; Juli 2016.
6. Packungsbeilage Crestor (Rosuvastatin). Wilmington, DE: AstraZeneca Pharmaceuticals LP; August 2017.
7. Packungsbeilage Zocor (Simvastatin). Whitehouse Station, NJ: Merck & Co, Inc; Februar 2015.
8. Packungsbeilage Altoprev (Lovastatin). Zug, Schweiz: Covis Pharma; April 2017.
9. Packungsbeilage FloLipid (Simvastatin). Brooksville, FL: Salerno Pharmaceuticals LP; Juli 2017.
10. Packungsbeilage Livalo (Pitavastatin). Montgomery, AL: Kowa Pharmaceuticals America, Inc; November 2016.
11. Packungsbeilage Caduet (Amlodipin / Atorvastatin). New York, NY: Pfizer Inc; Oktober 2017.
12. Packungsbeilage Vytorin (Ezetimib / Simvastatin). Whitehouse Station, NJ: Merck & Co, Inc; Februar 2018.
13. AbbVie Inc.; Entzug der Zulassung neuer Arzneimittelanträge für Advicor und Simcor. www.federalregister.gov/documents/2016/04/18/2016-08894/abbvie-inc-withdrawal-of-approval-of-new-drug-applications-for-advicor-and-simcor. Zugriff am 18. März 2018.
14. Jellinger PS, Handelsman Y, PD Rosenblit et al. Richtlinien der American Association of Clinical Endocrinologists und des American College of Endocrinology zur Behandlung von Dyslipidämie und zur Vorbeugung von Herz-Kreislauf-Erkrankungen. Endocr Pract. 2017; 23 (Ergänzung 2): 1-87.
15. LaRosa JC, Grundy SM, Waters DD et al. Intensive Lipidsenkung mit Atorvastatin bei Patienten mit stabiler Koronarerkrankung. N Engl J Med. 2005; 352: 1425–1435.
16. Ridker PM, Danielson E., Fonseca FA, et al. Rosuvastatin zur Vorbeugung von Gefäßereignissen bei Männern und Frauen mit erhöhtem C-reaktivem Protein. N Engl J Med. 2008; 359: 2195-2207.
17. Mihaylova B., Emberson J., Blackwell L. et al. Die Auswirkungen der Senkung des LDL-Cholesterins unter Statintherapie bei Menschen mit geringem Risiko für Gefäßerkrankungen: Metaanalyse einzelner Daten aus 27 randomisierten Studien. Lanzette. 2012; 380: 581–590.
18. Baigent C, Landray MJ, Reith C, et al. Die Auswirkungen der Senkung des LDL-Cholesterins mit Simvastatin plus Ezetimib bei Patienten mit chronischer Nierenerkrankung (Studie zum Herz- und Nierenschutz): eine randomisierte, placebokontrollierte Studie. Lanzette. 2011; 377: 2181–2192.
19. Cannon CP, Braunwald E., McCabe CH, et al.Intensive versus moderate Lipidsenkung mit Statinen nach akuten Koronarsyndromen. N Engl J Med. 2004; 350: 1495-1504.
20. Stone NJ, Robinson JG, Lichtenstein AH et al. ACC / AHA-Richtlinie 2013 zur Behandlung von Cholesterin im Blut zur Verringerung des atherosklerotischen kardiovaskulären Risikos bei Erwachsenen: Ein Bericht der Task Force des American College of Cardiology / American Heart Association zu Richtlinien für die Praxis. Verkehr. 2014; 129 (25 Supplement 2): S1-S45.
21. American College of Cardiology. ASCVD Risk Estimator Plus. http://tools.acc.org/ASCVD-Risk-Estimator. Zugriff am 18. März 2018.
22. Wenger NK, Lewis SJ, Herrington DM et al. Ergebnisse der Anwendung von hoch- oder niedrigdosiertem Atorvastatin bei Patienten ab 65 Jahren mit stabiler koronarer Herzkrankheit. Ann Intern Med. 2007; 147: 1-9.
23. Shepherd J., Blauw G. J., Murphy MB, et al. Pravastatin bei älteren Personen mit einem Risiko für Gefäßerkrankungen (PROSPER): eine randomisierte kontrollierte Studie. Lanzette. 2002; 360: 1623-1630.
24. Teng M., Lin L., Zhao YJ, et al. Statine zur Primärprävention von Herz-Kreislauf-Erkrankungen bei älteren Patienten: systematische Überprüfung und Metaanalyse. Alternde Drogen. 2015; 32: 649-661.
25. Kjekshus J., Apetrei E., Barrios V. et al. Rosuvastatin bei älteren Patienten mit systolischer Herzinsuffizienz. N Engl J Med. 2007; 357: 2248-2261.
26. Ginsberg HN, Elam MB, Lovato LC et al. Auswirkungen der kombinierten Lipidtherapie bei Typ-2-Diabetes mellitus. N Engl J Med. 2010; 362: 1563–1574.
27. Kastelein JJ, Akdim F., Stroes ES, et al. Simvastatin mit oder ohne Ezetimib bei familiärer Hypercholesterinämie. N Engl J Med. 2008; 358: 1431–1443.
28. Cannon CP, Blazing MA, Giugliano RP et al. Ezetimib ergänzt die Statintherapie nach akuten Koronarsyndromen. N Engl J Med. 2015; 372: 2387-2397.
29. Sabatine MS, Giugliano RP, Keech AC et al. Evolocumab und klinische Ergebnisse bei Patienten mit Herz-Kreislauf-Erkrankungen. N Engl J Med. 2017; 376: 1713–1722.
30. Lloyd-Jones DM, Morris PB, Ballantyne CM et al. 2017 fokussiertes Update des ACC Expert Consensus Decision Pathway 2016 zur Rolle von Nicht-Statin-Therapien zur Senkung des LDL-Cholesterins bei der Behandlung des Risikos für atherosklerotische Herz-Kreislauf-Erkrankungen: Ein Bericht der Task Force des American College of Cardiology über Expert Consensus Decision Pathways. J Am Coll Cardiol. 2017; 70: 1785–1822.
31. ODYSSEY-Ergebnisse: Die Ergebnisse legen nahe, dass die Verwendung des PCSK9-Inhibitors die CV-Ereignisse und LDL-C bei ACS-Patienten reduziert. American College of Cardiology. www.acc.org/latest-in-cardiology/articles/2018/03/05/15/53/sat-9am-odyssey-outcomes-cv-outcomes-with-alirocumab-after-acs-acc-2018. Zugriff am 20. Juni 2018.
32. Wallace A, Chinn D, Rubin G. Simvastatin morgens im Vergleich zu abends einnehmen: randomisierte kontrollierte Studie. BMJ. 2003; 327: 788.
33. Wiggins BS, Saseen JJ, Seite RL et al. Empfehlungen für das Management klinisch signifikanter Arzneimittel-Wechselwirkungen mit Statinen und ausgewählten Wirkstoffen bei Patienten mit Herz-Kreislauf-Erkrankungen: eine wissenschaftliche Stellungnahme der American Heart Association. Verkehr. 2016; 134: e468-e495.
34. Packungsbeilage Pacerone (Amiodaron). Maple Grove, MN: Upsher-Smith Laboratories LLC; Juli 2017.
35. Packungsbeilage Norvasc (Amlodipin). New York, NY: Pfizer Inc; Oktober 2017.
36. Packungsbeilage Cardizem (Diltiazem). Bridgewater, NJ: Valeant Pharmaceuticals; November 2016.
37. Packungsbeilage Calan (Verapamil). New York, NY: Pfizer Inc; September 2017.
38. Riaz H., Khan AR, Khan MS, et al. Metaanalyse von placebokontrollierten randomisierten kontrollierten Studien zur Prävalenz der Statin-Intoleranz. Am J Cardiol. 2017; 120: 774–781.
39. Zhang H., Plutzky J., Shubina M., Turchin A. Fortsetzung der Statinverordnungen nach Nebenwirkungen und Patientenergebnissen: eine Kohortenstudie. Ann Intern Med. 2017; 167: 221-227.
40. Tomaszewski M, Stepien KM, Tomaszewska J, Czuczwar SJ. Statin-induzierte Myopathien. Pharmacol Rep. 2011; 63: 859 & ndash; 866.
41. Stroes ES, PD Thompson, A Corsini et al. Statin-assoziierte Muskelsymptome: Auswirkungen auf die Statintherapie – Erklärung des Konsensgremiums der European Atherosclerosis Society zu Bewertung, Ätiologie und Management. Eur Heart J. 2015; 36: 1012–1022.
42. Gupta A., Thompson D., Whitehouse A. et al. Unerwünschte Ereignisse im Zusammenhang mit einer nicht blinden, aber nicht mit einer verblindeten Statintherapie in der anglo-skandinavischen Studie zu kardialen Ergebnissen – Lipidsenkender Arm (ASCOT-LLA): eine randomisierte doppelblinde, placebokontrollierte Studie und ihre nicht randomisierte, nicht blinde Verlängerung Phase. Lanzette. 2017; 389: 2473–2481.
43. Pedro-Botet J, Rubiés-Prat J. Statin-assoziierte Muskelsymptome: Vorsicht vor dem Nocebo-Effekt. Lanzette. 2017; 389: 2445–2446.
44. Laufs U., Filipiak K. J., Gouni-Berthold I. et al. Praktische Aspekte bei der Behandlung von statinassoziierten Muskelsymptomen (SAMS). Atheroscler Suppl. 2017; 26: 45-55.
45. FDA Drug Safety Communication: Neue Einschränkungen, Kontraindikationen und Dosisbeschränkungen für Zocor (Simvastatin) zur Verringerung des Risikos von Muskelverletzungen. www.fda.gov/Drugs/DrugSafety/ucm256581.htm. Zugriff am 18. März 2018.
46.Banach M., Serban C., Sahebkar A. et al. Auswirkungen von Coenzym Q10 auf die statininduzierte Myopathie: eine Metaanalyse randomisierter kontrollierter Studien. Mayo Clin Proc. 2015; 90: 24–34.
47. Goldberg AS, DeGorter MK, Ban MR et al. Wirksamkeit und Plasmadrogenkonzentrationen bei nicht täglicher Gabe von Rosuvastatin. Kann J Cardiol. 2013; 29: 915–919.
48. Matalka MS, Ravnan MC, Deedwania PC. Ist eine alternative tägliche Atorvastatin-Dosis bei der Behandlung von Patienten mit Hyperlipidämie wirksam? Der alternative Tag versus tägliche Dosierung der Atorvastatin-Studie (ADDAS). Am Heart J. 2002; 144: 674–677.
49. Copher HR, Stewart RD. Tägliche Dosierung versus abwechselnde Dosierung von Simvastatin bei Patienten mit Hypercholesterinämie. Pharmakotherapie. 2002; 22: 1110–1116.
50. Rochlani Y., Kattoor AJ., Pothineni NV. Et al. Ausgewogenes Verhältnis zwischen Primärprävention und statininduzierter Diabetes mellitus-Prävention. Am J Cardiol. 2017; 120: 1122–1128.
51. Corrao G., Ibrahim B., Nicotra F. et al. Statine und das Diabetesrisiko: Evidenz aus einer großen bevölkerungsbasierten Kohortenstudie. Diabetes-Behandlung. 2014; 37: 2225-2232.
52. Lim S, Oh PC, Sakuma I, Koh KK. Wie man kardiorenometabolische Vorteile und Risiken von Statinen in Einklang bringt. Atherosklerose. 2014; 235: 644–648.
53. Navarese EP, Buffon A., Andreotti F. et al. Metaanalyse des Einflusses verschiedener Arten und Dosen von Statinen auf den neu auftretenden Diabetes mellitus. Am J Cardiol. 2013; 111: 1123–1130.
54. Crandall JP, Mather K., Rajpathak SN, et al. Statinkonsum und Risiko, an Diabetes zu erkranken: Ergebnisse des Diabetes-Präventionsprogramms. BMJ Open Diabetes Res Care. 2017; 5: e000438.
55. Ganda OP. Statin-induzierter Diabetes: Inzidenz, Mechanismen und Auswirkungen. F1000Res. 2016; 5.