US Pharm. 2013; 38 (11) (Oncology suppl): 3-6.
SAMMENFATNING: Anæmi er en almindelig komplikation hos kræftpatienter. Det kan være forårsaget af enten selve tumoren eller det anvendte terapeutiske regime. Alvorligheden og prævalensen af tilstanden varierer afhængigt af en række faktorer. Behandlingen sigter mod at øge blodets iltbærende kapacitet, reducere træthed og forbedre patientens samlede livskvalitet. Erytropoiesestimulerende midler, jerntilskud og røde blodcelletransfusioner er alle blevet anbefalet i forskellige omgivelser. Mens disse har vist sig gavnlige hos nogle patienter, er den optimale terapeutiske model endnu ikke fastlagt.
Anæmi er en væsentlig årsag til sygelighed hos patienter med kræft, forbundet med dårlig fysisk ydeevne, prognose og terapeutisk resultat.1 Ifølge World HealthOrganization ( WHO) defineres anæmi som et hæmoglobin (Hb) niveau på < 12 g / dL hos ikke-gravide kvinder og < 13 g / dL hos mænd ≥15 år.2
Epidemiologi
Anæmi er en af de hyppigste manifestationer hos patienter med kræft. Faktisk er det blevet vist, at 30% til 90% af alle kræftpatienter er anæmiske, et tal, der er afhængigt af typen af kræft og definitionen af anvendt anæmi.3 Incidensen og sværhedsgraden af anæmien afhænger af et antal faktorer, som er anført i TABEL 1.4,5

Etiologi
Hovedårsagen til anæmi hos kræftpatienter er dobbelt: selve kræften og den terapi, der anvendes til behandling af kræft. Kræftceller, der infiltrerer knoglemarven, kan direkte undertrykke matopoiesis og forårsage anæmi. Desuden frigiver kræftcellerne cytokiner, der kan føre til jernbinding, hvilket reducerer produktionen af røde blodlegemer (RBC). Tumorer kan resultere i kronisk blodtab fra tumorstedet, hvilket fører til progressiv anæmi fra kræft og organskader.6
Dette problem forstærkes af blodtab, ernæringsmangel, hæmolyse, endokrine lidelser, arvelig sygdom, nyreinsufficiens eller tilstedeværelsen af inflammatoriske cytokiner associeret med kræft og kronisk sygdom.4,6 Kræftpatienter har tendens til at miste deres appetit, hvilket fører til ernæringsmæssige mangler. Hos patienter med gastrointestinale (GI) tumorer fører malabsorption af næringsstoffer også til mangler. Hæmolyse skyldes immunmedierede antistoffer eller ændringer i koagulationsevne. Som et resultat er anæmi en almindelig comorbiditet hos patienter, der for nylig er diagnosticeret med kræft. Næsten halvdelen af de patienter, der er diagnosticeret med gynækologisk kræft, og en tredjedel af patienterne, der er diagnosticeret med ikke-Hodgkin-lymfom, har anæmi ved diagnosen.
Desuden er myelosuppression en af bivirkningerne ved kemoterapi og en signifikant medvirkende faktor til anæmi . Især strålebehandling til skelettet forårsager også hæmatologisk toksicitet og dermed anæmi.6
Symptomer
De mest almindelige symptomer på anæmi er træthed, dyspneaupon anstrengelse, hjertebanken, depression, hjertesvigt, nedsat kognitiv funktion, svimmelhed og hjertesvigt.7,8
Diagnose
Omfanget af problemet med anæmi hos kræftpatienter forstærkes af suboptimale diagnostiske tiltag, manglen på en standarddefinition og kendsgerning, at årsagen ofte er multifaktoriel. 6,9 En detaljeret historie, der registrerer varigheden og tiden til symptomerne, tilstedeværelsen af comorbide forhold, familiehistorie og historien om eksponering for antineoplastiske lægemidler og stråling bør tages. Afysisk undersøgelse for at kontrollere synkope, dyspnø, hovedpine, svimmelhed, brystsmerter, træthed, unormal menstruation hos kvinder og bleghed bør udføres.6
National Cancer Comprehensive Network anbefaler, at der udføres aCBC for patienter med en Hb < 11 g / dL eller en reduktion i HB-antal på 2 g / dL. Dette er nyttigt til bestemmelse af, om cytopenier er til stede. En visuel gennemgang af perifert blodudstrygning for at bekræfte RBC’ernes størrelse, form og farve.6 anbefales også.6
Patofysiologi
Anæmi er resultatet af en kombination af nedsat cirkulerende erytrocytter , reduceret pakket cellevolumen og reducerede Hb-niveauer.6 Dette kan forekomme gennem forskellige patofysiologiske mekanismer, herunder overskydende blodtab, øget ødelæggelse af RBC’er og nedsat edderkrop.
Erythropoietin (EPO), vitamin B12, folinsyre og jern er afgørende for erythropoiesis. Erythropoietin styrer tematurering, differentiering og overlevelse af erythroidceller under denne proces.10 EPO produceres primært af nyrerne og transporteres til knoglemarven.11
Unormal jernmetabolisme eller tilbageholdelse af jern i makrofager reducerer mængden af jern, der er tilgængeligt forerythropoiesis.Den ændrede metabolisme af jern er primært forårsaget af hepcidin, et protein, der nedsætter absorptionen af jern i tarmene såvel som frigivelsen af jern fra makrofagerne. Produktion af hepcidin øges af cytokiner frigivet fra tumorer, hvorved mængden af cirkulerende jern nedsættes. Det er også blevet vist, at produktionen af cytokiner såsom interleukin (IL) -6 øges af visse kemoterapeutiske regimer.5 Gentagne cyklusser med kemoterapi kan forværre reduktionen af erytropoies kumulativt.7
Da iltafgivelsen er nedsat, kroppens vævsceller bliver hypoxiske, hvilket resulterer i en række fysiologiske reaktioner, når kroppen forsøger at få eller opretholde vævsoxygenering.
Det menes, at den normale anvendelse af jerncancerpatienter kan afbrydes af en interaktion mellem tumorcellerne og værtens eget immunsystem. Denne interaktion fører til opregulering af specifikke inflammatoriske cytokiner såsom IL-1, gammainterferon og tumornekrosefaktor alfa (TNF-α), som mindskede differentieringen af erythroidforløbere i knoglemarven, interfererer med normal jernudnyttelse og hæmmer normal hypoxi- drivenerythropoietin produktion. Nefrotoksiske kemoterapeutiske midler kan forværre problemet ved at forårsage nedsat nyrefunktion.
I kronisk anæmi har tumorer vist sig at frigive ananæmi-inducerende faktor, et molekyle der reducerer levetiden for erythrocytter. Dette forværrer anæmi til det punkt, hvor erythropoiesiscannot kompensere for den ringere overlevelse af RBC’er.12
Risikofaktorer for anæmi i kræft
Følgende risikofaktorer er blevet identificeret for anæmi i kræft9:
- Myelosuppressiv kemoterapi eller strålebehandling
- Lavt Hb-niveau (10-12 g / dL) ved initiering af cytotoksisk kemoterapi
- Administration af platin- indeholdende regimer, hvilket også øger behovet for transfusionsunderstøttelse.
Behandling
Bortset fra en samlet forbedring af patientens livskvalitet er behandling af anæmi vigtig for et antal Årsager.Anemi kompromitterer tilførslen af tilstrækkelige mængder ilt til allceller, herunder tumorceller.7 Da lavt vævsoxygenering er forbundet med en reduceret følsomhed af tumorer over for stråling og andre former for kemoterapi, reduceres effekten af disse behandlinger i anæmi.13,14
Målet med terapi bør være at øge oxygentransport blodets kapacitet og behandle den underliggende årsag. Underliggende forhold såsom ernæringsmæssige mangler er lettere at behandle end andre, såsom okkult blodtab. Forskellige muligheder er tilgængelige for behandling af kræftpatienter med anæmi. Disse inkluderer15:
- Passende supplerende behandling med folinsyre og / eller vitamin B12 for at rette ernæringsmangler
- Erythropoiesis-stimulating agents (ESAs)
- Jerntilskud
- Blodtransfusioner, som er indiceret til patienter med akut alvorligt blodtab. For patienter, hvis anæmi er kronisk, foretrækkes erytropoietiske midler.
Erythropoiesis-stimulerende midler: ESA’er, herunder rekombinant human erythropoietin alfa (rHuEPO; Procrit, Epogen) og darbepoetin alfa (Aranesp), var traditionelt udviklet til behandling af anæmi hos patienter med kronisk nyresvigt. De har påvist lignende effektivitet og begrænsninger, når de anvendes uforlignelige doser til kræftpatienter med anæmi. 5 ESA’er er indiceret til behandling af patienter, hvis endogene EPO-niveauer er normalt lave, da ESA-virkningsmåde og immunologiske og hæmatologiske virkninger svarer til dem af endogen EPO. 9 Studier udført på rHuEPO har vist, at det forbedrer patienters Hblevels og livskvalitet og mindsker transfusionskravene.15,16 Det er blevet foreslået, at ESA’er også forbedrer den kognitive funktion af patienter, der får kemoterapi.17
En systemisk gennemgang udført af American Cancer Societyshows, at optimal klinisk fordel ved erytropoietisk behandling af kemoterapi-induceret anæmi kan opnås gennem tidlig intervention.18Der er klart en fordel ved at bruge ESA’er; dog bør alle andre årsager til anæmi undersøges og korrigeres inden brug af ESAtherapy.
Darbepoetin og rHuEPO er begge indiceret til behandling af anæmi hos patienter med ikke-myeloide maligniteter i whomanæmi er relateret til kemoterapi.5 American Society ofHematology (ASH) og American Society of Clinical Oncology (ASCO) anbefaler, at behandling påbegyndes, når Hb-niveauer falder til under 10 g / dL, og dosis reduceres, hvis der er en minimumsforøgelse på 1 g / dL i Hblevels med 2 uger.19 Formålet med terapien skal være at forøge Hb til den laveste koncentration for at undgå transfusion. Hvis den minimale stigning på 1 til 2 g / dL Hb ikke opnås efter 6 til 8 ugers behandling, bør ESA-behandlingen stoppes.18 Selv om det er vanskeligt at forudsige patientrespons på disse terapier med de aktuelle data, har det vist sig, at ca. 50% til 60% af patienterne viser en stigning på 2 g / dL i Hb, når de behandles med rHuEPO.9 ESA-behandling bør seponeres, når kemoterapiforløbet.20,21
Den anbefalede dosis til darbepoetin alfa er 2,25 mcg / kg som en ugentlig subkutan (SC) injektion. Hvis Hb-niveauerne ikke stiger mindst 1 g / dL efter 6 uger, bør dosis øges til 4,5mcg / kg. Hvis Hb-niveauerne stiger mere end 1 g / dL i en 2-ugers periode, overstiger Hb 12 g / dL, bør darbepoetin-dosis reduceres med 40%. 20 Darbepoetin bør stoppes, hvis Hb-niveauer stiger over 13 g / dL. 9
Den anbefalede dosis af rHuEPO er 40.000 E administreret SC en gang ugentligt eller 150 U / kg administreret SC tre gange om ugen indlæggere, hvis Hb-niveauer er under 10 g / dL. Doseringen af rHuEPO skal reduceres med 25%, hvis Hb-niveauet stiger > 1 g / dL i en hvilken som helst 2-ugers periode eller når det niveau, der er nødvendigt for at undgå RBC-transfusion.21
ESA’er er pakket i et hætteglas, der ikke bør ryster, da de vil denaturere. 20,21 Hætteglassets indhold bør ikke fortyndes eller samles.
Risiciene ved ESA-behandling bør også være taget intoconsideration. ESA antages at øge ugunstige kardiovaskulære begivenheder, øge risikoen for venøs tromboembolisme, forkorte tiden til tumorprogression og reducere overlevelse hos anæmiske kræftpatienter gennem forskellige mekanismer.22,23 Af denne grund frarådes brugen af ESA’er hos kræftpatienter, der ikke gennemgår behandling med kemoterapi eller strålebehandling.24 Alle ESA’er kommer med en blackbox-advarsel om at øge risikoen for død, myokardieinfarkt, slagtilfælde, venøs tromboemboli, trombose af vaskulær adgang og tumorprogression og gentagelse.20,21 ESA APPRISE OncologyProgram er oprettet af FDA til at rådgive patienter, pårørende og sundhedspersonale om sikker brug af ESA’er.25
Jerntilskud: Jerntilskud, helst parenteralt, er indiceret til patienter med lave niveauer af offerritin (< 30 ng / ml), transferrinmætning (TSAT < 15%) og lav (< 26 pg / celle ) reticulocyte Hb conten t (CHr). To typer irondeficiency er blevet anerkendt hos anæmiske kræftpatienter:
- Absolut jernmangel (AID), der opstår ved kronisk blødning på grund af for eksempel GI eller gynækologiske læsioner, blodtab fra operation, ernæring mangler og anæmi ved kronisk sygdom (ACD). Det er defineret som et serumferritinniveau på < 30 mcg / L og nedsat TSAT på < 15% .1
- Funktionel jernmangel (FID), der opstår efter fortsat brug af erythropoietin. Det er den mest almindelige årsag til utilstrækkelig respons på ESA-behandling, især hos patienter med nyresvigt. Derfor vil de fleste patienter i ESA-behandling i sidste ende kræve jerntilskud.6
Jerntilskud blev introduceret, da ESA-behandling alene viste dårlige responsrater hos kemoterapibehandlede patienter.1 Effekten af en kombination af IV jern- og ESA-terapi blev testet, og jernens rolle i funktionel jernmangel blev fastslået.1 Mens de nuværende beviser understøtter brugen af IV-jerntilskud for at forbedre hæmoglobinrespons hos anæmiske patienter med kræft, er der behov for prospektive undersøgelser af den langsigtede effektivitet og sikkerhed af IV-jern Derudover skal der etableres optimale doseringsregimer.5 Jern kan administreres oralt eller som parenteralformuleringer af jerndextran med lav molekylvægt (LMW), ferricgluconat og jernsucrose. Parenteralt administreret jern har et bedre respons sammenlignet med oral jern.6 Sidstnævnte anvendes derfor sjældent til kræftpatienter med anæmi og diskuteres ikke i denne artikel. Testdoser anbefales til jerndextran. Patienter, der har udvist tidligere følsomhed over for jerndextran eller andre IV-jernpræparater, eller dem, der har flere lægemiddelallergier, skal også administreres en testdosis. TABEL 2 viser doseringsregimen til IV jerntilskud.6
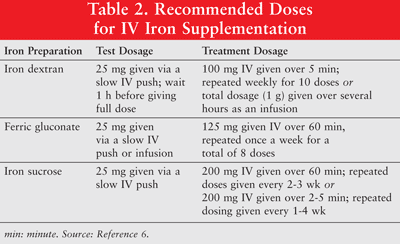
Parenteralt jern er forbundet med hypotension, kvalme, opkastning og / eller diarré, smerte, hypertension, dyspnø, pruritus, hovedpine og svimmelhed. Desuden kan det være ubelejligt at administrere og koste.9 Da højde-molekylvægt (HMW) jerndextran er forbundet med en højere forekomst af bivirkninger end LMW jerndextran, foretrækkes sidstnævnte generelt.6
Rød Blodcelletransfusion: RBC er det foretrukne blodprodukt til transfusioner for at korrigere anæmi i tilfælde af akut anæmi efter blødning. Visse patienter kan kræve en infusion, der er negativ af cytomegalovirus.Målet med at bruge en RBC-transfusion er at behandle eller forhindre mangel på blodets iltbærende kapacitet, og transfusion er normalt ikke indiceret, hvis patientens Hblevel er ≥10 g / dL.6
RBC-transfusioner tilbyder fordelen ved en hurtig stigning i Hb- og hæmatokritniveauer umiddelbart efter infusion. Det anslås, at en transfusion på 300 ml (1 enhed) rene RBC’er vil resultere i en gennemsnitlig stigning på 1 g / dL Hb eller 3% hæmatokrit hos en anden videnskabelig voksen, der ikke oplever samtidig blodtab. Dette fører til en samlet hurtig forbedring i træthed.6
Patientens blod skal krydskompateres til ABO-kompatibilitet, før RBC’erne kan transfunderes. Hvis patienten har brug for gentagne infusioner, kan risikoen for bivirkninger minimeres ved brug af leukocytreducerende blod og præmedicinering med anantihistamin eller acetaminophen.6
RBC-transfusion er ikke uden risici, herunder potentialet for transfusionstransmitteret infektiøs agenter, transfusionsreaktioner, alloimmunisering og immunsuppression.9 Andre risici ved transfusion inkluderer kongestiv hjertesvigt, øgede trombotiske hændelser og jernoverbelastning.6 Det er dog værd at bemærke, at patienter, der har behov for RBC-infusioner i den periode, der kun svarer til kemoterapibehandling, er meget usandsynligt oplever jernoverbelastning.6
Fremtidige perspektiver
Nye strategier til håndtering af anæmi hos kræftpatienter forfølges i øjeblikket. Mens der ikke er nogen erstatning for menneskelig blod, er forskere i færd med at udvikle produkter, der har iltbærende kapacitet af RBC’er. I rørledningen er Hb-baserede oxygenbærere og perfluorcarboner.5
Konklusion
Alt i alt er den optimale tilgang til anæmi som et vigtigt spørgsmål inden for onkologi endnu ikke etableret. Manglende sammenhæng mellem sundhedsudbydere, en klar definition af anæmi i kræft og diagnostiske kriterier bidrager alle til dette problem.
1. Steinmetz HT. Rollen af intravenøst jern i behandlingen af anæmi hos kræftpatienter. Ther Adv Hematol. 2012; 3: 177-191.
2. deBenoist B, McLean E, Egli I, et al. Verdensomspændende anæmi 1993-2005: WHO’s globale database om anæmi. Genève, Schweiz: Verdenssundhedsorganisationen; 2008.
3. Knight K, Wade S, Balducci L. Prævalens og resultater af anæmi i kræft: en systematisk gennemgang af litteraturen. Am J Med. 2004; 116 (suppl 7A): 11S-26S.
4. Schwartz RN. Anæmi hos patienter med kræft: forekomst, årsager, påvirkning, styring og brug af behandlingsretningslinjer og protokoller. Am J Health Syst Pharm. 2007; 64 (3 suppl 2): S5-S13; quiz S28-S30.
5. Calabrich A, Katz A.Håndtering af anæmi hos kræftpatienter. Fremtidens Oncol. 2011; 7: 507-517.
6. Rodgers GM, Becker P, Blinder M, et al. Kræft- og kemoterapiinduceret anæmi. J Natl Compr Canc Netw. 2012; 10: 628-653.
7. Groopman JE, Itri LM. Kemoterapi-induceret anæmi hos voksne: forekomst og behandling. J Natl Cancer Inst. 1999; 91: 1616-1634.
8. Ludwig H, Strasser K. Symptomatologi af anæmi. Semin Oncol. 2001; 28: 7-14.
9. Gillespie TW. Anæmi i kræft. Kræft sygepleje. 2003; 26: 119-128.
10. Koeller JM. Kliniske retningslinjer for behandling af kræftrelateret anæmi. Farmakoterapi. 1998; 18: 156-169.
11. Cazzola M, Mercuriali F, Brugnara C. Brug af rekombinant humant erythropoietin uden for uremieindstillingen. Blod. 1997; 89: 424-867.
12. Nowrousian MR, Kasper C, Oberhoff C, et al. Patofysiologi af kræftrelateret anæmi. I: Smith JF, Boogaerts MA, Ehmer B, red. Erythropoietin i kræftstøttende behandling. New York, NY: Marcel Dekker; 1997: 13-34.
13. Vaupel P, Dunst J, Engert A, et al. Virkninger af rekombinant humant erythropoietin (rHuEPO) på tumorkontrol hos patienter med kræftinduceret anæmi. Onkologie. 2005; 28: 216-221.
14. Zhao KL, Liu G, Jiang GL, et al. Forbindelse af hæmoglobinniveau med sygelighed og dødelighed hos patienter med lokalt avanceret øsofagealt karcinom, der gennemgår strålebehandling – en sekundæranalyse af tre på hinanden følgende kliniske fase III-forsøg. Clin Oncol (R Coll Radiol). 2006; 18: 621-627.
15. Glaspy JA. Udviklingen af erytropoietiske midler inden for onkologi. Ekspertopin Emerg Drugs. 2005; 10: 553-567.
16. Adamson JW, Spivak JL. Fysiologisk grundlag for farmakologisk anvendelse af rekombinant humant erythropoietin i kirurgi og kræftbehandling. Kirurgi. 1994; 115: 7-15.
17. Ferrario E, Ferrari L, Bidoli P, et al. Behandling af kræftrelateret anæmi med epoetin alfa: en gennemgang. 2004, Kræft Behandle Rev. 2004; 30: 563-575.
18. Lyman GH, Glaspy J. Er der kliniske fordele med tidlig erytropoietisk intervention for kemoterapi-induceret anæmi? Asystematisk gennemgang. Kræft. 2006; 106: 223-233.
19. Rizzo JD, Brouwers M, Hurley P, et al. AmericanSociety of Clinical Oncology / American Society of Hematology klinisk praksis retningslinjeopdatering om brugen af epoetin og darbepoetin hos voksne patienter med kræft. J Clin Oncol. 2010; 28: 4996-5010.
20. Aranesp (darbepoetin alfa) ordineringsinformation.Thousand Oaks, CA: Amgen Inc; Maj 2012.
21. Procrit (epoetin alfa) ordineringsinformation. Horsham, PA: Janssen Products, LP; Juli 2012.
22. Beutel G, Ganser A. Risici og fordele ved erythropoiesis-stimulerende stoffer i kræfthåndtering. Semin Hematol. 2007; 44: 157-165.
23. Fenner MH, Ganser A. Erythropoietin i kræftrelateret anæmi. Curr Opin Oncol. 2008; 20: 685-689.
24. Smith RE Jr, Aapro MS, Ludwig H, et al. Darbepoetinalfa til behandling af anæmi hos patienter med aktiv kræft, der ikke modtager kemoterapi eller strålebehandling: resultater af en fase III, multicenter, randomiseret, dobbeltblind, placebokontrolleret undersøgelse. J Clin Oncol. 2008; 26: 1040-1050.
25. ESA APPRISE Oncology Program. Amgen og Janssen Products, LP. www.esa-apprise.com. Adgang til 13. oktober 2013.