Sænkning af damptryk
Som beskrevet i kapitlet om væsker og faste stoffer er ligevægtsdamptrykket i en væske det tryk, der udøves af dets gasformige fase, hvor fordampning og kondensation finder sted i lige store hastigheder:
\ text {liquid} \ rightleftharpoons \ text {gas}
Opløsning af et ikke-flygtigt stof i en flygtig væske resulterer i en sænkning af væskens damptryk. Dette fænomen kan rationaliseres ved at overveje effekten af tilsatte opløste molekyler på væskens fordampnings- og kondensationsprocesser. For at fordampe skal opløsningsmiddelmolekyler være til stede på overfladen af opløsningen. Tilstedeværelsen af opløst stof mindsker overfladearealet, der er tilgængeligt for opløsningsmiddelmolekyler, og reducerer derved hastigheden af opløsningsmiddelfordampning. Da kondensationshastigheden ikke er påvirket af tilstedeværelsen af opløst stof, er nettoresultatet, at fordampning-kondensations ligevægt opnås med færre opløsningsmiddelmolekyler i dampfasen (dvs. ved et lavere damptryk) (figur 1). Selvom denne kinetiske fortolkning er nyttig, tager den ikke højde for flere vigtige aspekter af den kolligative karakter af damptrykssænkning. En mere stringent forklaring involverer egenskaben entropi, et emne for diskussion i et senere tekstkapitel om termodynamik. For at forstå nedsættelsen af en væskes damptryk er det tilstrækkeligt at bemærke, at den større entropi af en opløsning sammenlignet med dens separate opløsningsmiddel og opløst stof tjener til effektivt at stabilisere opløsningsmidlet og hindre deres fordampning. Et lavere damptryk resulterer og et tilsvarende højere kogepunkt som beskrevet i næste afsnit af dette modul.
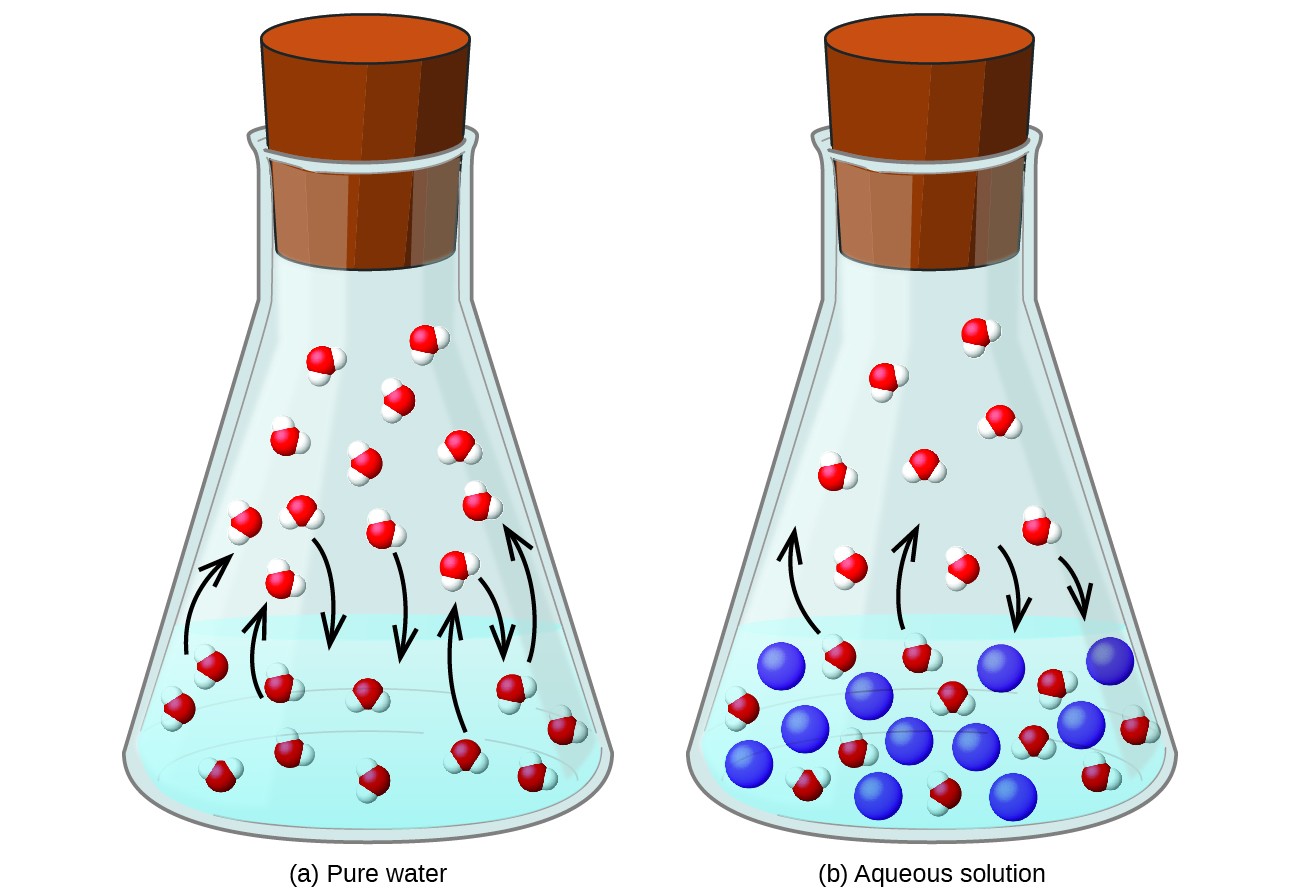
Figur 1. Tilstedeværelsen af ikke-flygtige opløste stoffer sænker en opløsnings damptryk ved at hindre fordampningen af opløsningsmiddelmolekyler.
Forholdet mellem dampens tryk på opløsningskomponenterne og koncentrationerne af disse komponenter er beskrevet af Raoults lov: Det delvise tryk, der udøves af en hvilken som helst komponent i en ideel opløsning, er lig med damptrykket for den rene komponent ganget med dens molfraktion i opløsningen.
{P} _ {\ text {A}} = {X} _ {\ text {A}} {P} _ {\ text {A}} ^ {\ star}
Når man minder om, at det samlede tryk i en gasformig blanding er lig med summen af partialtrykket for alle dets komponenter (Daltons lov om deltryk), er det samlede damptryk, der udøves af en opløsning indeholdende i komponenter
{ P} _ {\ text {løsning}} = \ sum _ {i} {P} _ {i} = \ sum _ {i} {X} _ {i} {P} _ {i} ^ {\ stjerne}
Et ikke-flygtigt stof er et stof, hvis damptryk er ubetydeligt (P ^ {\ star} ≈ 0), og så damptrykket over en opløsning, der kun indeholder ikke-flygtige opløste stoffer, skyldes kun opløsningsmidlet:
{P} _ {\ text {løsning}} = {X} _ {\ tekst {opløsningsmiddel}} {P} _ {\ tekst {opløsningsmiddel}} ^ {\ stjerne}
Destillation af løsninger
Destillation er en teknik til at adskille komponenterne i blandinger, der anvendes bredt både i laboratoriet og i industrielle omgivelser. Det bruges til at raffinere råolie, til at isolere gæringsprodukter og til at rense vand. Denne adskillelsesteknik involverer den kontrollerede opvarmning af en prøveblanding for selektivt at fordampe, kondensere og opsamle en eller flere komponenter af interesse. Et typisk apparat til destillationer i laboratorieskala er vist i figur 2.

Figur 2. En typisk laboratoriedestillationsenhed er vist i (a) et fotografi og (b) et skematisk diagram over komponenterne. (kredit a: modifikation af arbejde af “Rifleman82” / Wikimedia commons; kredit b: modifikation af arbejde af “Slashme” / Wikipedia)
Olieraffinaderier bruger storskala fraktioneret destillation til at adskille komponenter af råolie. Råolie opvarmes til høje temperaturer ved bunden af en høj fraktioneringskolonne, der fordamper mange af de komponenter, der stiger inden i kolonnen. Da fordampede komponenter når tilstrækkeligt kølige zoner under deres opstigning, kondenseres de og opsamles. De opsamlede væsker er enklere blandinger af kulbrinter og andre råolieforbindelser, der har passende sammensætning til forskellige anvendelser (f.eks. Dieselbrændstof, petroleum, benzin) som vist i figur 3.

Figur 3. Råolie er en kompleks blanding, der adskilles ved stor fraktioneret destillation for at isolere forskellige enklere blandinger.
Kogepunktsforhøjelse
Som beskrevet i kapitlet om væsker og faste stoffer er en væskes kogepunkt den temperatur, hvor dens damptryk er lig med det omgivende atmosfæriske tryk.Da dampopløsningen i en opløsning sænkes på grund af tilstedeværelsen af ikke-flygtige opløste stoffer, er det grund til at opløsningens kogepunkt efterfølgende øges. Sammenlignet med rent opløsningsmiddel vil en opløsning derfor kræve en højere temperatur for at opnå et givet damptryk, inklusive en ækvivalent med den i den omgivende atmosfære. Forøgelsen i kogepunktet observeret, når ikke-flygtigt opløst stof opløses i et opløsningsmiddel, ΔTb, kaldes kogepunktshøjde og er direkte proportional med molkoncentrationen af opløste arter:
\ Delta {T} _ {\ text {b}} = {K} _ {\ text {b}} m
hvor Kb er kogepunktets højdekonstant, eller ebullioskopisk konstant og m er molal koncentration (molalitet) af alle opløste arter.
Kogepunktshøjdekonstanter er karakteristiske egenskaber, der afhænger af opløsningsmidlets identitet. Værdierne for Kb for flere opløsningsmidler er anført i tabel 1.
I hvilket omfang et opløsningsmiddels damptryk sænkes, og kogepunktet hæves, afhænger af det samlede antal opløste partikler til stede i en given mængde af opløsningsmiddel, ikke med hensyn til partiklernes masse eller størrelse eller kemiske identitet. En 1 m vandig opløsning af saccharose (342 g / mol) og en 1 m vandig opløsning af ethylenglycol (62 g / mol) udviser det samme kogepunkt, fordi hver opløsning har et mol opløste partikler (molekyler) pr. Kg opløsningsmiddel .
Eksempel 6: Kogepunktet for en jodopløsning
Find kogepunktet for en opløsning af 92,1 g iod, I2 i 800,0 g chloroform, CHCl3 forudsat at jodet er ikke-flygtigt, og at løsningen er ideel.
Tjek din læring
Hvad er kogepunktet for en opløsning på 1,0 g glycerol, C3H5 (OH) 3, i 47,8 g vand? Antag en ideel løsning.
Deponering af frysepunkt

Figur 4. Stensalt ( NaCl), calciumchlorid (CaCl2) eller en blanding af de to bruges til at smelte is. (kredit: modifikation af arbejde af Eddie Welker)
Løsninger fryser ved lavere temperaturer end rene væsker. Dette fænomen udnyttes i “afisning” -ordninger, der bruger salt (figur 4), calciumchlorid eller urinstof til at smelte is på veje og fortove og i brugen af ethylenglycol som et “frostvæske” i bilradiatorer. Havvand fryser ved en lavere temperatur end ferskvand, og derfor forbliver de arktiske og antarktiske have ufrossne, selv ved temperaturer under 0 ° C (ligesom kropsvæsker fra fisk og andre koldblodige havdyr, der lever i disse oceaner).
Faldet i en fortyndet opløsnings frysepunkt sammenlignet med det rene opløsningsmiddel, ΔTf, kaldes frysepunktsnedtrykket og er direkte proportionalt med molkoncentrationen af det opløste stof
\ Delta {T} _ {\ text {f}} = {K} _ {\ text {f}} m
hvor m er den molale koncentration af det opløste stof i opløsningsmidlet og Kf kaldes frysepunktsdepressionskonstant (eller kryoskopisk konstant). Ligesom for stigningskonstanter for kogepunkt er disse karakteristiske egenskaber, hvis værdier afhænger af opløsningsmidlets kemiske identitet. Værdierne for Kf for flere opløsningsmidler er anført i tabel 1.
Kolligative egenskaber og afisning
Natriumchlorid og dets gruppe 2-analoger calcium og magnesiumchlorid bruges ofte til afisvejsveje og fortove på grund af det faktum, at en opløsning af et hvilket som helst af disse salte har et frysepunkt lavere end 0 ° C, frysepunktet for rent vand. Gruppe 2-metalsalte blandes ofte med det billigere og lettere tilgængelige natriumchlorid (“rock salt”) til brug på veje, da de har tendens til at være noget mindre ætsende end NaCl, og de giver en større fordybning af frysepunktet , da de adskiller sig for at give tre partikler pr. formlenhed snarere end to partikler som natriumchloridet.
Fordi disse ioniske forbindelser har tendens til at fremskynde korrosionen af metal, ville de ikke være et klogt valg at bruge i frostvæske til radiatoren i din bil eller til at afisere et fly inden start.Til disse anvendelser anvendes ofte kovalente forbindelser, såsom ethylen eller propylenglycol. Glykolerne, der anvendes i radiatorvæske, sænker ikke kun væskens frysepunkt, men de hæver kogepunktet, hvilket gør væsken nyttig både vinter og sommer. Opvarmede glykoler sprøjtes ofte på flyets overflade inden start i dårligt vejr om vinteren for at fjerne is, der allerede er dannet, og forhindre dannelsen af mere is, hvilket ville være særlig farligt, hvis det dannes på flyets kontrolflader (figur 5).

Figur 5. Nedfrysning af frysepunkt udnyttes til at fjerne is fra (a) veje og (b) flyets kontrolflader.
Fasediagram for en løsning
De kolligative virkninger på damptryk, kogepunkt og frysepunkt beskrevet i det foregående afsnit er praktisk opsummeret ved at sammenligne fasediagrammerne for en ren væske og en opløsning afledt af denne væske. Fasediagrammer for vand og en vandig opløsning er vist i figur 6.
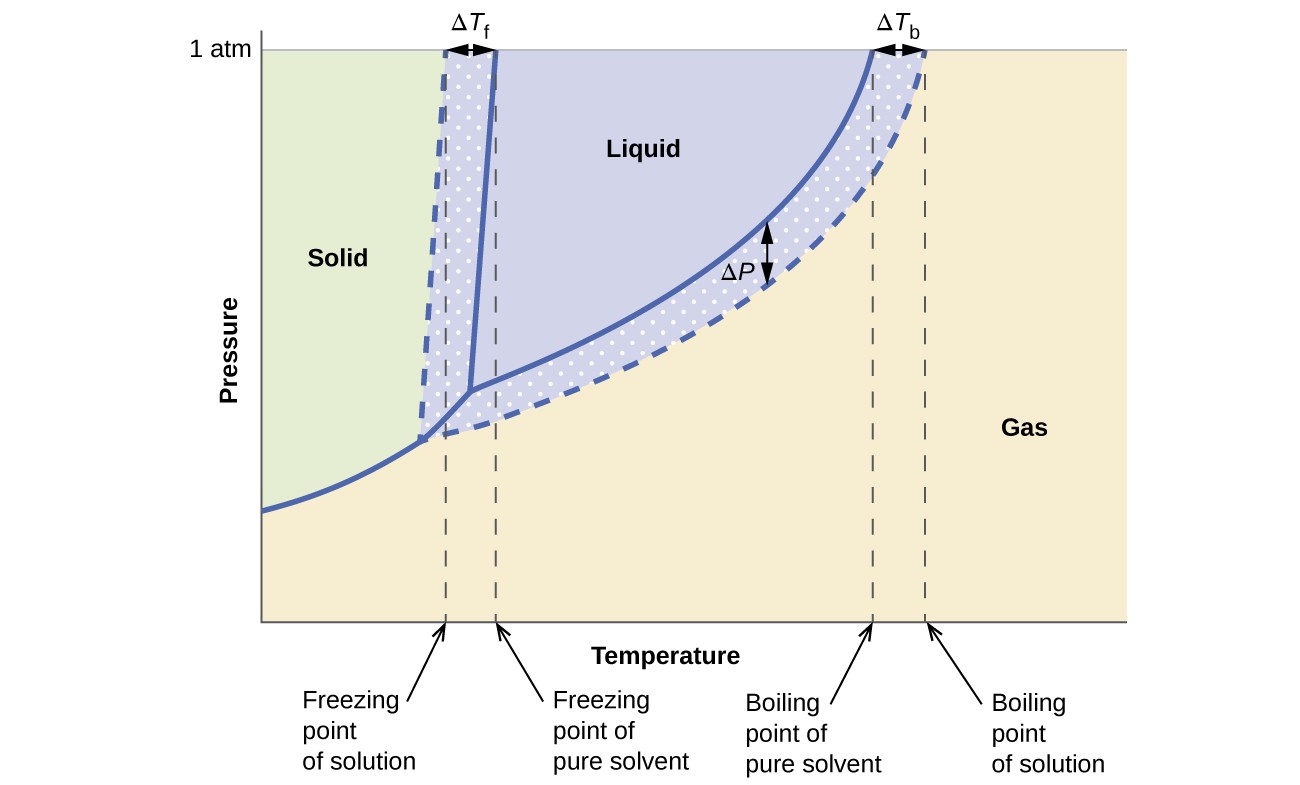
Figur 6. Disse faser diagrammer viser vand (faste kurver) og en vandig opløsning af ikke-elektrolyt (stiplede kurver).
Væske-dampkurven for opløsningen er placeret under den tilsvarende kurve for opløsningsmidlet, der viser dampen tryknedsættelse, ΔP, der skyldes opløsning af ikke-flygtigt opløst stof. Følgelig observeres opløsningens kogepunkt ved et hvilket som helst tryk ved en højere temperatur end den for det rene opløsningsmiddel, hvilket afspejler kogepunktsforhøjelsen, ATb, forbundet med tilstedeværelsen af ikke-flygtig opløsningsmiddel. Fast-væske-kurven for opløsningen forskydes til venstre for den for det rene opløsningsmiddel, der repræsenterer frysepunktsnedtrykket, ATb, der ledsager dannelse af opløsning. Endelig bemærk, at fastgaskurverne for opløsningsmidlet og dets opløsning er identiske. Dette er tilfældet for mange opløsninger, der omfatter flydende opløsningsmidler og ikke-flygtige opløste stoffer. Ligesom ved fordampning, når en opløsning af denne slags er frosset, er det faktisk kun opløsningsmiddelmolekylerne, der gennemgår væske til fast overgang og danner rent fast opløsningsmiddel, der udelukker opløste arter. De faste og gasformige faser består derfor kun af opløsningsmiddel, og overgange mellem disse faser er således ikke udsat for kolligative virkninger.
Osmose og osmotisk tryk af opløsninger
Et antal naturlige og syntetiske materialer udviser selektiv permeation, hvilket betyder, at kun molekyler eller ioner af en bestemt størrelse, form, polaritet, ladning osv. er i stand til at passere gennem (gennemtrængning) af materialet. Biologiske cellemembraner giver elegante eksempler på selektiv gennemtrængning i naturen, mens dialyseslanger, der bruges til at fjerne metabolisk affald fra blod, er et mere forenklet teknologisk eksempel. Uanset hvordan de kan fremstilles, betegnes disse materialer generelt som semipermeable membraner.
Overvej apparatet illustreret i figur 7, hvor prøver af rent opløsningsmiddel og en opløsning er adskilt af en membran, der kun opløsningsmiddel molekyler kan trænge igennem. Opløsningsmiddelmolekyler vil diffundere over membranen i begge retninger. Da koncentrationen af opløsningsmiddel er større i det rene opløsningsmiddel end opløsningen, vil disse molekyler diffundere fra opløsningsmiddelsiden af membranen til opløsningssiden i en hurtigere hastighed, end de vil i omvendt retning. Resultatet er en nettooverførsel af opløsningsmiddelmolekyler fra det rene opløsningsmiddel til opløsningen. Diffusionsdrevet overførsel af opløsningsmiddelmolekyler gennem en semipermeabel membran er en proces kendt som osmose.
Figur 7. (a) En opløsning og et rent opløsningsmiddel adskilles oprindeligt af en osmotisk membran. (b) Netto overførsel af opløsningsmiddelmolekyler til opløsningen sker, indtil dets osmotiske tryk giver lige store overførselshastigheder i begge retninger.
Når osmose udføres i et apparat som det, der er vist i figur 7 , øges volumenet af opløsningen, når den fortyndes ved akkumulering af opløsningsmiddel. Dette får niveauet af opløsningen til at stige, hvilket øger dets hydrostatiske tryk (på grund af vægten af søjlen af opløsning i røret) og resulterer i en hurtigere overførsel af opløsningsmiddelmolekyler tilbage til den rene opløsningsmiddelside. Når trykket når en værdi, der giver en omvendt opløsningsmiddeloverførselshastighed svarende til osmosehastigheden, ophører bulkoverførslen af opløsningsmidlet. Dette tryk kaldes det osmotiske tryk (Π) af opløsningen. Det osmotiske tryk af en fortyndet opløsning er relateret til dets opløste molaritet, M og absolutte temperatur, T ifølge ligningen
\ Pi = MRT
hvor R er den universelle gaskonstant.
Hvis en opløsning placeres i et apparat som det, der er vist i figur 8, reverserer osmosen ved at anvende et tryk, der er større end det osmotiske tryk, opløsningen og skubber opløsningsmiddelmolekyler fra opløsningen ind i det rene opløsningsmiddel. Denne teknik til omvendt osmose bruges til storskala afsaltning af havvand og i mindre skalaer til at producere ledningsvand med høj renhed til drikke.
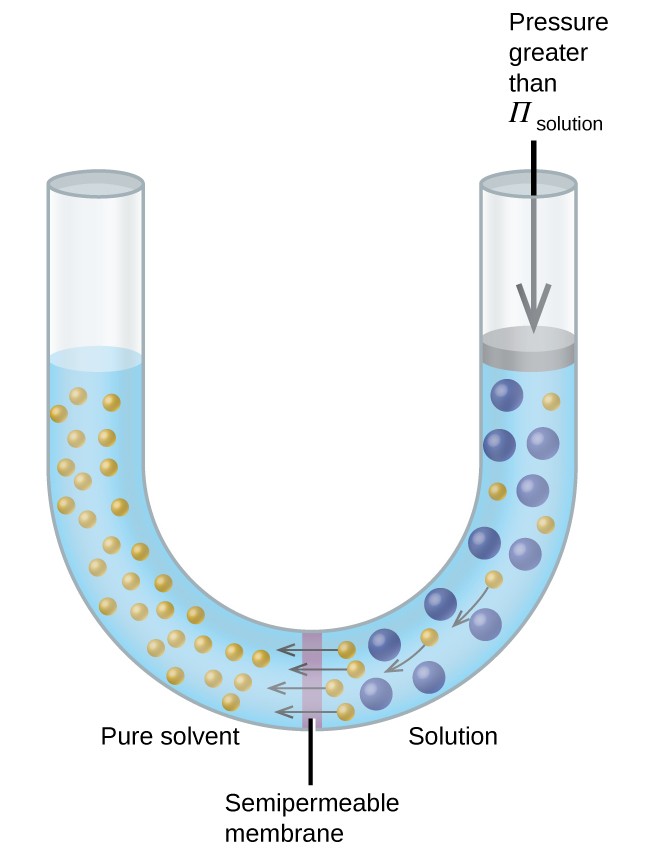
Figur 8. Anvendelse af et tryk, der er større end det osmotiske tryk i en opløsning, vil vende osmosen. Opløsningsmiddelmolekyler fra opløsningen skubbes ind i det rene opløsningsmiddel.
Omvendt osmose Vandrensning
I processen med osmose tjener diffusion til at flytte vand gennem en semipermeabel membran fra en mindre koncentreret opløsning til en mere koncentreret opløsning. Osmotisk tryk er den mængde tryk, der skal anvendes på den mere koncentrerede opløsning for at få osmose til at stoppe. Hvis der anvendes større tryk, vil vandet gå fra den mere koncentrerede opløsning til en mindre koncentreret (mere ren) opløsning. Dette kaldes omvendt osmose. Omvendt osmose (RO) bruges til at rense vand i mange applikationer, fra afsaltningsanlæg i kystbyer, til vandrensningsmaskiner i købmandsforretninger (figur 9) og mindre husholdningsenheder med omvendt osmose. Med en håndbetjent pumpe kan små RO-enheder bruges i tredjelandes lande, katastrofeområder og i redningsbåde. Vores militære styrker har en række generatorstyrede RO-enheder, der kan transporteres i køretøjer til fjerntliggende steder.

Figur 9. Omvendte osmosesystemer til oprensning af drikkevand er vist her på (a) små og (b) store skalaer. (kredit a: modifikation af arbejde af Jerry Kirkhart; kredit b: modifikation af arbejde af Willard J. Lathrop)
Eksempler på osmose er tydelige i mange biologiske systemer, fordi celler er omgivet af semipermeable membraner. Gulerødder og selleri, der er blevet slappe, fordi de har mistet vand, kan gøres sprøde igen ved at placere dem i vand. Vand bevæger sig ind i gulerod eller selleri celler ved osmose. En agurk placeret i en koncentreret saltopløsning mister vand ved osmose og absorberer noget salt for at blive en sylteagurk. Osmose kan også påvirke dyreceller. Opløsningskoncentrationer er især vigtige, når opløsninger injiceres i kroppen. Opløsninger i kropscellevæsker og blodserum giver disse opløsninger et osmotisk tryk på ca. 7,7 atm. Opløsninger injiceret i kroppen skal have det samme osmotiske tryk som blodserum; de skal være isotoniske med blodserum. Hvis en mindre koncentreret opløsning, en hypotonisk opløsning, injiceres i tilstrækkelig mængde til at fortynde blodserumet, passerer vand fra det fortyndede serum ind i blodcellerne ved osmose, hvilket får cellerne til at ekspandere og briste. Denne proces kaldes hæmolyse. Når en mere koncentreret opløsning, en hypertonisk opløsning, injiceres, mister cellerne vand til den mere koncentrerede opløsning, krymper og dør muligvis i en proces kaldet crenation. Disse effekter er illustreret i figur 10.
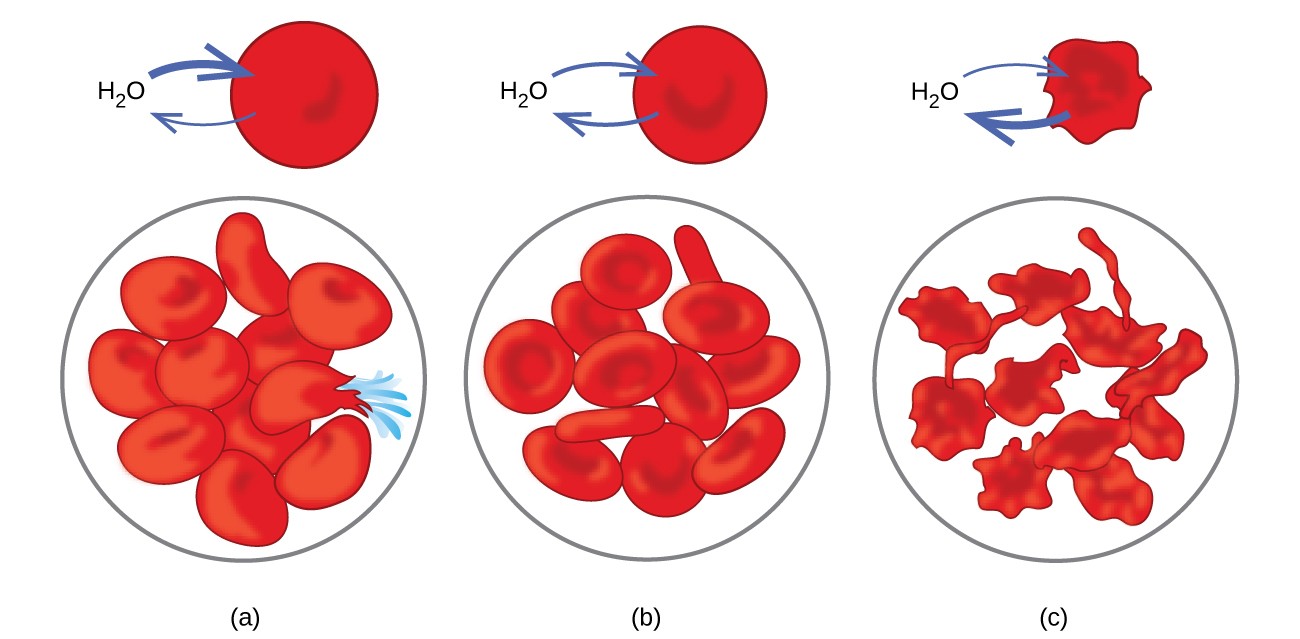
Figur 10. Røde blodlegemer er vandgennemtrængelige og vil (a) svulme op og muligvis briste i en hypoton opløsning; (b) opretholde normal volumen og form i en isotonisk opløsning; og (c) skrumpe sammen og muligvis dø i en hypertonisk opløsning. (kredit a / b / c: modifikationer af arbejde af “LadyofHats” / Wikimedia commons)
Bestemmelse af molmasser
Osmotisk tryk og ændringer i frysepunkt, kogepunkt punkt og damptryk er direkte proportionale med koncentrationen af opløst stof. Derfor kan vi bruge en måling af en af disse egenskaber til at bestemme den molære masse af opløst stof ud fra målingerne.
Som tidligere nævnt i dette modul afhænger en opløsnings kolligative egenskaber kun af antallet, ikke af identiteten, af opløste opløste arter. Koncentrationsbetingelserne i ligningerne for forskellige kolligative egenskaber (frysepunktsdepression (kogepunktsforhøjelse, osmotisk tryk) vedrører alle opløste arter, der er til stede i opløsningen. For de opløsninger, der hidtil er betragtet i dette kapitel, har de opløste stoffer været ikke-elektrolytter, der opløses fysisk uden dissociation eller anden ledsagende proces. le, der opløser, giver et opløst opløst opløst molekyle. Opløsningen af en elektroyte er imidlertid ikke så enkel som illustreret af de to almindelige eksempler nedenfor:
I betragtning af det første af disse eksempler og forudsat fuldstændig dissociation indeholder en 1,0 m vandig opløsning af NaCl 2,0 mol ioner (1,0 mol Na + og 1.0 mol Cl−) pr. Kg vand, og dets frysepunktsnedgang forventes at være
Når denne opløsning faktisk fremstilles, og dens nedtrykning af frysepunktet måles, opnås der dog en værdi på 3,4 ° C. Lignende uoverensstemmelser observeres for andre ioniske forbindelser, og forskellene mellem de målte og forventede kolligative egenskabsværdier bliver typisk mere signifikante, når koncentrationen af opløste stoffer stiger. Disse observationer antyder, at ionerne af natriumchlorid (og andre stærke elektrolytter) ikke adskilles fuldstændigt i opløsning.
For at redegøre for dette og undgå de fejl, der ledsager antagelsen om total dissociation, er en eksperimentelt målt parameter navngivet i ære for den nobelprisvindende tyske kemiker Jacobus Henricus van’t Hoff bruges. Van’t Hoff-faktoren (i) er defineret som forholdet mellem opløste partikler i opløsning og antallet af opløste formlenheder:
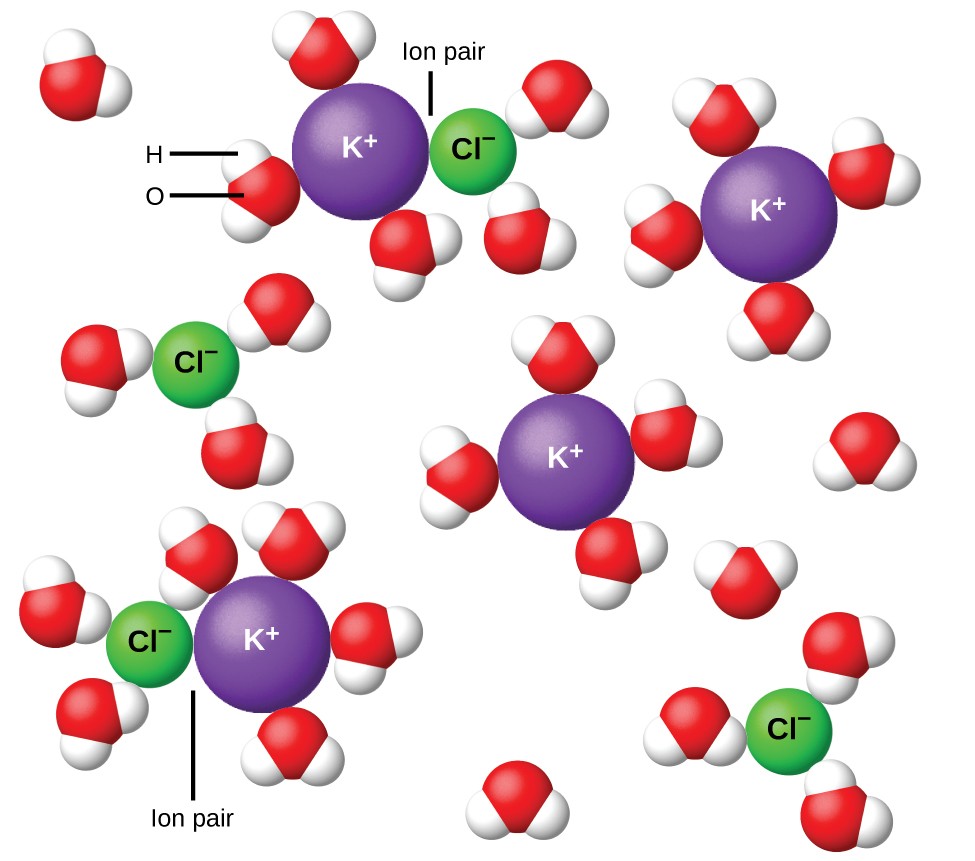
Figur 11. Ioner bliver mere og mere adskilt, jo mere fortyndet opløsningen, og de resterende interioniske attraktioner bliver mindre.
I 1923 foreslog kemikerne Peter Debye og Erich Hückel en teori til forklaring af den tilsyneladende ufuldstændige ionisering af stærke elektrolytter. De foreslog, at selvom interionisk tiltrækning i en vandig opløsning er meget stærkt reduceret ved opløsning af ioner og den isolerende virkning af det polære opløsningsmiddel, er det ikke fuldstændig ophævet. De resterende attraktioner forhindrer ionerne i at opføre sig som helt uafhængige partikler (figur 11). I nogle tilfælde kan en positiv og negativ ion faktisk røre ved, hvilket giver en solvatiseret enhed kaldet et ionpar. Således er aktiviteten eller den effektive koncentration af en hvilken som helst bestemt type ion mindre end den, der er angivet ved den aktuelle koncentration. Ioner bliver mere og mere adskilt, jo mere fortyndet opløsningen, og de resterende interioniske attraktioner bliver mindre og mindre. I ekstremt fortyndede opløsninger er ionernes effektive koncentrationer (deres aktiviteter) i det væsentlige lig med de faktiske koncentrationer. Bemærk, at van’t Hoff-faktorerne for elektrolytterne i tabel 2 er for 0,05 m opløsninger, hvor koncentrationen værdien af i for NaCl er 1,9 i modsætning til en idealværdi på 2.
Eksempel 11: Frysepunktet for en opløsning af en elektrolyt
Koncentrationen af ioner i havvand er omtrent den samme som i en opløsning indeholdende 4,2 g NaCl opløst i 125 g vand. Antag, at hver af ionerne i NaCl-opløsningen har samme virkning på frysepunktet for vand som et ikke-elektrolytmolekyle, og bestem frysetemperaturen, opløsningen (som er omtrent lig med frysetemperaturen for havvand).
Tjek din læring
Antag, at hver af ionerne i calciumchlorid, CaCl2, har den samme virkning på frysepunktet for vand som et ikke-elektrolytmolekyle. Beregn frysepunktet for en opløsning af 0,724 g CaCl2 i 175 g vand.
Prøv det
- Kød kan klassificeres som fersk (ikke frossen), selvom det er gemt på −1 ° C. Hvorfor fryser kød ikke ved denne temperatur?
- En organisk forbindelse har en sammensætning på 93,46% C og 6,54% H i masse. En opløsning af 0,090 g af denne forbindelse i 1,10 g kamfer smelter ved 158,4 ° C. Smeltepunktet for ren kamfer er 178,4 ° C. Kf for kamfer er 37,7 ° C / m. Hvad er molekylformlen for det opløste stof? Vis dine beregninger.
- Et salt er kendt for at være et alkalimetalfluorid. En hurtig tilnærmet bestemmelse af frysepunktet indikerer, at 4 g af saltet opløst i 100 g vand producerer en opløsning, der fryser ved omkring -1,4 ° C. Hvad er saltets formel? Vis dine beregninger.
Ordliste
aktivitet: effektiv koncentration af ioner i opløsning; det er lavere end den faktiske koncentration på grund af ioniske interaktioner.
kogepunktshøjde: højde af kogepunktet for en væske ved tilsætning af en opløsningsmiddel
kogepunkts højdekonstant: proportionalitetskonstant i ligningen, der relaterer kogepunktsforhøjelse til opløst molalitet; også kendt som den ebullioskopiske konstante
kolligative egenskab: egenskab ved en opløsning, der kun afhænger af koncentrationen af en opløst stof
crenation: proces, hvorved biologiske celler skrumpes på grund af vandtab ved osmose
nedtrykning af frysepunkt: sænkning af frysepunktet for en væske ved tilsætning af et opløst stof
frysepunktsnedtrykningskonstant: (også kryoskopisk konstant) proportionalitetskonstant i ligningen frysepunktsdepression for opløst molalitet
hæmolyse: brud på røde blodlegemer på grund af ophobning af overskydende vand ved osmose
hypertonisk: med større osmotisk tryk
hypotonisk : med mindre osmotisk tryk
ionpar: solvatiseret anion / kationpar holdes sammen ved moderat elektrostatisk tiltrækning
isotonisk: med lige osmotisk tryk
molalitet (m) : en koncentrationsenhed defineret som forholdet mellem antallet af mol opløst stof og opløsningsmidlets masse i kg
molfraktion (X): forholdet mellem en opløsningskomponents molmængde og det samlede antal mol af alle opløsningskomponenter
osmose: diffusion af opløsningsmiddelmolekyler gennem en semipermeabel membran
osmotisk tryk (Π ): modsat tryk, der kræves for at forhindre bulkoverførsel af opløsningsmiddelmolekyler gennem en semipermeabel membran damptryk i ren tilstand
semipermeabel membran: en membran, der selektivt tillader passage af visse ioner eller molekyler
van’t Hoff-faktor (i): forholdet mellem antallet af mol af partikler i en opløsning til antallet af mol formlenheder opløst i opløsningen
- En ikke-elektrolyt vist til sammenligning. Li

