Når du ser det periodiske system, hvad kommer du i tankerne? Brikkerne på et scrabblebræt? Måske tænker du på din gymnasiekemi. Måske tænker du på det farverige bord pudset på væggen i en forelæsningssal på college. Måske husker du, at din yndlingslærer har fyret noget foran klasseværelset. Jeg er assisterende professor i kemi ved University of Richmond, og når jeg hører sætningen “det periodiske system” tænker jeg på livet.
Jeg tænker på, hvordan molekylerne og kemikalierne, der omgiver os, og dikterer vores hverdag. aktiviteter består af elementerne på bordet – de opretholder vores liv, de bringer skønhed til verden, og de er livsvigtige inden for medicin.
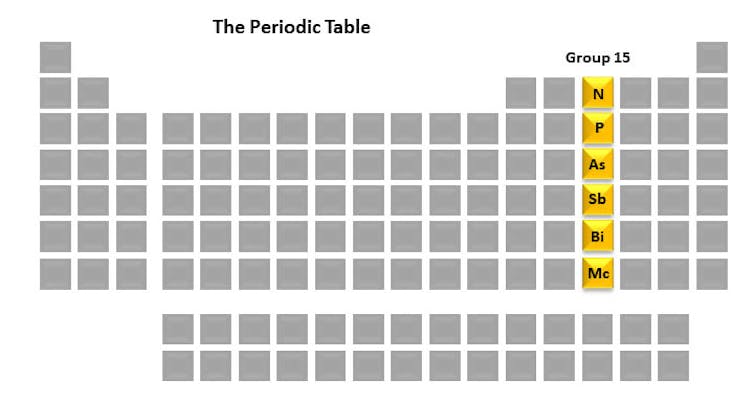
Hver kolonne i det periodiske system kaldes en gruppe. Hvert medlem af gruppen har et lignende arrangement af elektroner, som kan resultere i lignende kemiske egenskaber. Gruppe 15-elementer – nitrogen, fosfor, arsen, antimon, bismut og moscovium – er interessante for mig på grund af deres afgørende rolle i livet såvel som i mit forskningslaboratorium. Et element, vi studerer, er fosfor på grund af dens integrerede rolle i cellernes skæbne.
Men før vi kommer ind på disse detaljer, skal vi se kort på hver af gruppe 15-elementerne. De er et unikt sæt i deres historie, anvendelser og egenskaber.
Gruppe 15 – at give liv og forårsage død
Kvælstof (N) i sin atmosfæriske form (N₂) udgør ca. 78% af den luft, vi indånder. Når bakterier, der lever i planterødder, omdanner den til en brugbar form gennem en proces kaldet nitrogenfiksering, bliver denne elementære form for nitrogen inkorporeret i mange forbindelser, der er nødvendige for livet – for eksempel proteiner og DNA. Nederst i søjlen er Moscovium (Mc), hvilket er interessant, fordi det ikke rigtig findes i naturen. Det er et radioaktivt element, der kun kan genereres i et laboratorium og overlever i mindre end et sekund.
Arsen (As) kan være kendt for dig på grund af dets tilknytning til forgiftninger. I 1494 blev Pico della Mirandola, en italiensk humanistisk filosof under renæssancen, forgiftet af arsen, selvom detaljerne omkring hans tidlige død stadig drøftes. I lang tid blev det antaget, at Napoleon Bonaparte døde af eksponering for arsen i 1821, men efter omfattende sammenligninger af konserverede hårprøver fra forskellige stadier i hans liv konkluderede forskerne, at de øgede niveauer af arsen sandsynligvis skyldtes datidens konserveringsteknikker. For nylig vurderede Verdenssundhedsorganisationen, at arsenholdigt forurenet drikkevand i Bangladesh resulterede i over 9.000 dødsfald i 2001. Hvordan arsen gift og dræbte ikke forstås fuldstændigt, men der er ingen tvivl om, at elementet forårsager ødelæggelse af vitale organer i det menneskelige menneske krop.

Når elementantimonet (Sb) kombineres med tre iltatomer til dannelse af antimontrioxid, bruges det i vid udstrækning som et flammehæmmende middel til møbler, tæpper , forhæng, gummi, plast og klæbemidler. Mængderne af dette molekyle i disse husholdningsprodukter har tendens til at være meget små, og disse niveauer af antimon betragtes som sikre.
Bismuth (Bi) er et metal, der findes i samme række i det periodiske system som et antal giftige metaller; forbindelser indeholdende vismut er imidlertid uskadelige. Vismutforbindelser kan findes i kosmetik på grund af deres karakteristiske og ønskelige sølvfarvede glans. Selvom du ikke har brugt vismutholdige produkter til personlig pleje, har du sandsynligvis stødt på det i det velkendte antacida Peptobismol®, der bruges til at behandle mavebesvær, eller den 4. juli, når du ser fyrværkeri. Det er en vismutforbindelse, der forårsager de knitrende lyde fra drageægfyrværkeriet.
Sidst, men ikke mindst, af elementerne i gruppe 15 er fosfor (P). Det blev opdaget i 1669 af alkymisten Hennig Brandt og opkaldt fra det græske ord “phosphoros”, hvilket betyder lysbringer. Det er fordi, når den grundlæggende form interagerer med atmosfærisk ilt, frembringer den et strålende lys. Kemikere fandt ud af, hvordan man udnytter kraften i denne reaktion til udvikling af tændstikker. Det røde tip på en tændstik indeholder stadig en form for fosfor i dag.
Fosfater – regulerer kræftcelle skæbne
Ud over gnister genereret af elementet , findes fosfor i en forbindelse kendt som et fosfat: fosfor bundet til fire iltatomer.Når et fosfatmolekyle er knyttet til et protein i celler, kan det tænde eller aktivere proteinet, så det kan udføre sin funktion i cellen – som stimulerende vækst.
Når fosfatet ikke længere er bundet til proteinet, holder cellerne op med at vokse. Du kan tænke på det næsten som de matches der er beskrevet ovenfor – når fosfatet er der, kan tændstikket antænde og forretningen kan fortsætte. Når fosfatet fjernes, er tændstikket bare en pind, og der gives ikke noget lys; ikke så meget arbejde kan ske i mørket.
I kræftceller er fosfatstatus ude af kontrol. Forestil dig en masse tændte tændstikker og et meget lyst rum, der kan resultere i en strøm af aktivitet. Denne aktivitet kan have alvorlige konsekvenser for celler. For eksempel kan ureguleret vækst og migration føre til kræft.
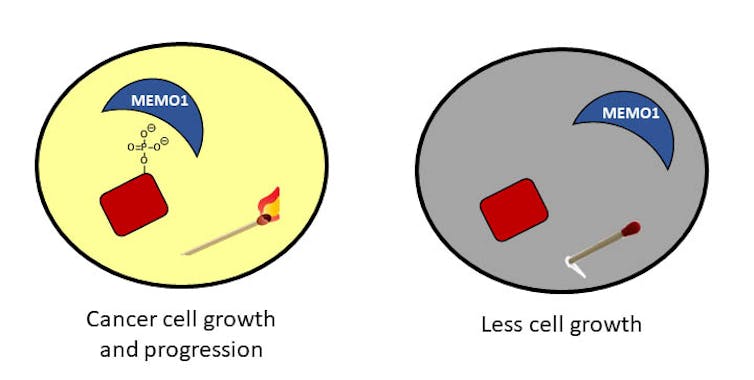
I mit laboratorium ved University of Richmond er vi interesseret i at forstå disse fosfater og især et protein, der interagerer med dem. Dette protein, kaldet MEMO1, findes i store mængder hos brystkræftpatienter og hjælper fosfaterne med altid at være bundet til proteiner. Vi forsøger at forstå, hvordan MEMO1 interagerer med disse fosfater og udvikler strategier til at forstyrre disse interaktioner.
Vi håber, at vores arbejde afslører en måde, hvorpå vi kan fjerne fosfaterne til at stoppe den ukontrollerede vækst af celler – med andre ord at sprænge tændstikkerne.
Så næste gang du hører ordene “periodisk system”, tænk venligst på livet. Tænk på de molekyler, du møder hvert øjeblik hver dag, tænk på medicinen, der holder dig sund, og tænk på dem af os, der arbejder for at forstå, hvordan du holder dig på den måde .