Streptokokker er en stor gruppe af gram-positive, ikke-motile, ikke-sporedannende kokker omkring 0,5 -1,2 µm i størrelse. De vokser ofte parvis eller kæder og er negative for oxidase og katalase.
S pyogenes har tendens til at kolonisere de øvre luftveje og er meget virulent, da det overvinder værtsforsvarssystemet. De mest almindelige former for S pyogenes sygdom inkluderer luftvejsinfektioner og hudinfektioner, hvor forskellige stammer normalt er ansvarlige for hver form.
S pyogenes cellevæg er meget kompleks og kemisk forskelligartet. De antigene komponenter i cellen er virulensfaktorerne. De ekstracellulære komponenter, der er ansvarlige for sygdomsprocessen, inkluderer invasiner og exotoksiner. Den yderste kapsel er sammensat af hyaluronsyre, som har en kemisk struktur, der ligner værtsbindevæv, hvilket gør det muligt for bakterien at undslippe genkendelse af værten som et krænkende middel. Således undgår bakterien fagocytose ved neutrofiler eller makrofager, så den koloniseres. Lipoteichoesyre og M-proteiner placeret på cellemembranen krydser gennem cellevæggen og rager uden for kapslen.
Epitelcelleinvasion
Et kendetegn ved S pyogenes er organismenes evne til at invadere epitelceller. Manglende penicillin til at udrydde S pyogenes fra patienterne, især dem, der bærer S pyogenes, er i stigende grad blevet rapporteret. Resultaterne fra en undersøgelse antydede stærkt, at hvis bærertilstanden er resultatet af intraepitelcellestreptokokkeroverlevelse, kan manglen på penicillin til at dræbe indtagne S pyogener være relateret til en mangel på effektiv penicillinindtrængning i epitelceller. Disse observationer kan have kliniske implikationer for forståelse af bærere og håndtering af S pyogenes-infektion.
Bakterielle virulensfaktorer
Cellevæggets antigener inkluderer kapselpolysaccharid (C-stof ), peptidoglycan og lipoteichoinsyre (LTA), R- og T-proteiner og forskellige overfladeproteiner, herunder M-protein, fimbriale proteiner, fibronectin-bindende proteiner (fx protein F) og cellebundet streptokinase.
C-substansen er sammensat af en forgrenet polymer af L-rhamnose og N-acetyl-D-glucosamin. Det kan have en rolle i øget invasiv kapacitet. R- og T-proteinerne anvendes som epidemiologiske markører og har ingen kendt rolle i virulens.
En anden virulensfaktor, C5A-peptidase, ødelægger de kemotaktiske signaler ved at spalte komplementkomponenten i C5A.
M-protein, den vigtigste virulensfaktor er et makromolekyle, der er inkorporeret i fimbriae til stede på cellemembranen, der rager ud på den bakterielle cellevæg. Det er den primære årsag til antigent skift og antigent drift blandt GAS. (Se billedet nedenfor.)
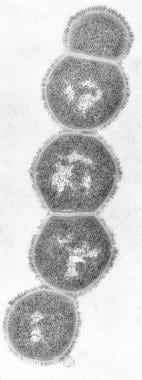 Streptococcus gruppe A infektioner. M-protein.
Streptococcus gruppe A infektioner. M-protein. M-protein binder værten fibrinogen og blokerer bindingen af komplement til den underliggende peptidoglycan. Dette muliggør overlevelse af organismen ved at hæmme fagocytose. Stammer, der indeholder en overflod af M-protein, modstår fagocytose, formerer sig hurtigt i humane væv og indleder sygdomsprocessen. Efter en akut infektion udvikles typespecifikke antistoffer mod M-proteinaktivitet i nogle tilfælde.
Selvom sådanne antistoffer beskytter mod infektion med en homolog M-proteintype, giver de ingen immunitet mod andre M-typer. Denne observation er en af de faktorer, der repræsenterer en væsentlig teoretisk hindring for S pyogenes-vaccindesignet, fordi mere end 80 M serotyper er blevet beskrevet til dato.
Fællesskabsbaserede udbrud af bestemte streptokoksygdomme har tendens til at være forbundet med visse M-typer; derfor har M-serotypning været meget værdifuldt for epidemiologiske undersøgelser.
Bakterielle adhærensfaktorer
Mindst 11 forskellige overfladekomponenter i GAS er blevet foreslået for at spille en rolle i vedhæftning. I 1997 foreslog Hasty og Courtney, at GAS udtrykker forskellige arrays af adhæsiner i forskellige miljømæssige nicher. Baseret på deres gennemgang medierer M-protein adhæsion til HEp-2-celler, men ikke til bukkale celler, hos mennesker, mens FBP54 medierer adhæsion til bukkale celler, men ikke til HEp-2-celler. Protein F medierer adhæsion til Langerhans-celler, men ikke til keratinocytter.
En af de foreslåede teorier med hensyn til adhæsionsprocessen er en 2-trins model. Det indledende trin i at overvinde den elektrostatiske frastødning af bakterierne fra værten medieres af LTA, som tilvejebringer svag, reversibel vedhæftning. Det andet trin tager form af fast, irreversibel vedhæftning medieret af vævsspecifikt M-protein, protein F eller FBP54, blandt andre.Når først adhærens har fundet sted, modstår streptokokker fagocytose, formerer sig og begynder at invadere det lokale væv.
GAS viser enorm og molekylær mangfoldighed under udvikling, drevet af vandret transmission mellem forskellige stammer. Dette gælder også, når de sammenlignes med andre streptokokker. Erhvervelse af profager tegner sig for meget af mangfoldigheden og giver ikke kun virulens via fagassocierede virulensfaktorer, men øger også bakterieoverlevelse mod værtsforsvar.
Ekstracellulære produkter og toksiner
Forskellige ekstracellulære vækstprodukter og toksiner produceret af GAS er ansvarlige for værtscelleskader og inflammatorisk respons.
Hæmolysiner
S pyogenes uddyber 2 forskellige hæmolysiner. Disse proteiner er ansvarlige for den zone af hæmolyse, der observeres på blodagarplader, og er også vigtige i patogenesen af vævsskader i den inficerede vært. Streptolysin O er toksisk for en lang række celletyper, inklusive myokardium, og er stærkt immunogen. Bestemmelsen af antistofresponserne på dette protein (antistreptolysin O-titer) er ofte nyttig i serodiagnosen af nylig infektion.
Streptolysin S er en anden virulensfaktor, der er i stand til at skade polymorfonukleære leukocytter og subcellulære organeller. I modsætning til streptolysin O ser det imidlertid ikke ud til at være immunogent.
Pyrogene eksotoksiner
Familien med streptokokker pyrogene eksotoksiner (SPE’er) inkluderer SPE’er A, B, C og F. Disse toksiner er ansvarlige for udslæt af skarlagensfeber. Andre patogene virkninger forårsaget af disse stoffer inkluderer pyrogenicitet, cytotoksicitet og forstærkning af følsomheden over for endotoksin. SPE B er en forløber for en cysteinprotease, en anden determinant for virulens.
Streptokokisolater i gruppe A associeret med streptokok TSS koder for bestemte SPE’er (dvs. A, C, F), der er i stand til at fungere som superantigener. Disse antigener inducerer en markant feberrespons, inducerer proliferation af T-lymfocytter og inducerer syntese og frigivelse af multiple cytokiner, inklusive tumornekrosefaktor, interleukin-1 beta og interleukin-6. Denne aktivitet tilskrives superantigenets evne til samtidig at binde til V-beta-regionen i T-cellereceptoren og til klasse II-hovedhistokompatibilitetsantigener af antigenpræsenterende mononukleære celler, hvilket resulterer i udbredt, ikke-specifik T-celleproliferation og øget produktion af interleukin-2.
Nukleaser
Fire antigenisk adskilte nukleaser (A, B, C, D) hjælper med flytning af pus og hjælp til at generere substrat for vækst.
Andre produkter
Andre ekstracellulære produkter inkluderer NADase (leukotoksisk) , hyaluronidase (som fordøjer værtsbindevæv, hyaluronsyre og organismen “s egen kapsel), streptokinaser (proteolytisk) og streptodornase AD (deoxyribonukleaseaktivitet).
Proteinase, amylase og esterase er yderligere streptokokvirulensfaktorer, skønt rollen af disse proteiner i patogenesen ikke er fuldt forstået.
Suppur ativt sygdomsspektrum
Streptokokfaryngitis
S pyogenes forårsager op til 15-30% af tilfældene med akut faryngitis. Frank sygdom forekommer baseret på graden af bakteriel virulens efter kolonisering af de øvre luftveje. Nøjagtig diagnose er afgørende for passende antibiotiske valg.
Impetigo
Pyoderma er den mest almindelige form for hudinfektion forårsaget af GAS . Også kaldet streptokok impetigo eller impetigo contagiosa, det forekommer oftest i tropiske klimaer, men kan også være meget udbredt i nordlige klimaer, især i sommermånederne. Risikofaktorer, der disponerer for denne infektion, inkluderer lav socioøkonomisk status; lavt niveau af generel hygiejne og lokal skade på huden forårsaget af insektbid, fnat, atopisk dermatitis og mindre traumer. Kolonisering af ubrudt hud går forud for udviklingen af pyoderma med ca. 10 dage.
Streptokokpyoderma kan forekomme hos børn, der tilhører visse befolkningsgrupper og i overfyldte institutioner. Transmissionsformerne er direkte kontakt, miljøforurening og husfluer. Stammerne af streptokokker, der forårsager pyoderma, adskiller sig fra dem, der forårsager ekssudativ tonsillitis.
Bakterietoksinerne forårsager proteolyse af epidermale og subepidermale lag, så bakterierne spredes hurtigt langs hudlagene og derved forårsage blærer eller purulente læsioner. Den anden almindelige årsag til impetigo er Staphylococcus aureus.
Lungebetændelse
Invasiv GAS kan forårsage lungeinfektion, ofte med hurtig progression til nekrotiserende lungebetændelse.
Nekrotiserende fasciitis
Nekrotiserende fasciitis er forårsaget af bakteriel invasion i det subkutane væv med efterfølgende spredning gennem overfladisk og dyb fascial fly. Spredning af GAS understøttes af bakterietoksiner og enzymer (fx lipase, hyaluronidase, collagenase, streptokinase), interaktioner mellem organismer (synergistiske infektioner), lokale vævsfaktorer (f.eks. Nedsat blod- og iltforsyning) og generelle værtsfaktorer (f.eks. , immunkompromitteret tilstand, kronisk sygdom, kirurgi).
Da infektionen spreder sig dybt langs de fasciale planer, opstår vaskulær okklusion, vævsiskæmi og nekrose. Selvom GAS ofte isoleres i tilfælde af nekrotiserende fasciitis, er denne sygdomstilstand ofte polymikrobiel.
Otitis media and sinusitis
Disse er almindelige suppurative komplikationer af streptokok tonsillopharyngitis. De er forårsaget af spredning af organismer via det eustakiske rør (otitis media) eller ved direkte spredning til bihulerne (sinusitis).
Ikke-suppurativt sygdomsspektrum
Akut reumatisk feber
ARF er en forsinket, ikke-suppurativ følge af GAS tonsillopharyngitis. Efter faryngitis går en latent periode på 2-3 uger, før tegn eller symptomer på ARF vises. Sygdommen præsenterer med forskellige kliniske manifestationer, herunder arthritis, carditis, chorea, subkutane knuder og erythema marginatum.
Reumatisk feber kan være resultatet af værtsgenetiske disposition. Sygdomsgenet kan transmitteres enten på en autosomal-dominerende måde eller på en autosomal-recessiv måde med begrænset gennemtrængning. Dog er sygdomsgenet endnu ikke identificeret.
Betydelige beviser understøtter sammenhængen mellem gruppe A streptokokinfektioner i de øvre luftveje og ARF, selvom kun visse M-gruppe serotyper (dvs. 1, 3, 5, 6, 18, 24) er forbundet med denne komplikation. Meget slimhindede stammer, især stammer af M type 18, har dukket op i adskillige samfund forud for reumatisk feber. Gigtfeber observeres hyppigst hos børn i alderen 5-15 år (den aldersgruppe, der er mest modtagelig for GAS-infektioner).
Angrebsfrekvensen efter infektion i øvre luftveje er ca. 3% til personer med ubehandlet eller utilstrækkelig behandlet infektion. Den latente periode mellem GAS-infektionen og begyndelsen af reumatisk feber varierer fra 2-4 uger. I modsætning til poststreptokok glomerulonephritis (PSGN), som kan følge enten faryngitis eller streptokok pyoderma, kan reumatisk feber kun forekomme efter en infektion i de øvre luftveje.
På trods af dybden af viden, der er blevet akkumuleret om den molekylære mikrobiologi af Streptococcus pyogenes, forbliver patogenesen af ARF ukendt. En direkte effekt af et streptokok ekstracellulært toksin, især streptolysin O, kan ifølge nogle hypoteser være ansvarlig for patogenesen af ARF. Observationer om, at streptolysin O er kardiotoksisk i dyremodeller understøtter denne hypotese, men det har været vanskeligt at forbinde denne toksicitet med den valvulære skade, der er observeret i ARF.
En mere populær hypotese er, at en unormal værtsimmunrespons på en eller anden komponent i gruppe A Streptococcus er ansvarlig. M-proteinet fra GAS deler visse aminosyresekvenser med nogle humane væv, og dette er blevet foreslået som en kilde til krydsreaktivitet mellem organismen og den humane vært, der kunne føre til et immunopatologisk immunrespons. Antigen lighed mellem det gruppespecifikke polysaccharid af S pyogenes og glycoproteiner fundet i humane og bovine hjerteklapper er også blevet anerkendt, og patienter med ARF har forlænget persistens af disse antistoffer sammenlignet med kontroller med ukompliceret faryngitis. Andre GAS-antigener ser ud til at krydsreagere med hjertesarkolemmamembraner.
I løbet af værtens immunrespons over for GAS kan værtens antigener, som et resultat af denne molekylære efterligning, forveksles med fremmede; dette fører til en inflammatorisk kaskade med resulterende vævsskade. Hos patienter med ARF med Sydenham chorea er almindelige antistoffer mod antigener fundet i S pyogenes-cellemembranen og den caudate kerne i hjernen, hvilket yderligere understøtter konceptet med et afvigende autoimmunt respons i udviklingen af ARF.
Interessen for, om sådanne autoimmune responser spiller en rolle i patogenesen af syndromet kendt som pædiatriske autoimmune neuropsykiatriske lidelser forbundet med streptokokinfektioner (PANDAS) har været betydelig, selv om yderligere arbejde er nødvendigt for at etablere sammenhængen mellem streptokokinfektioner og disse syndromer.
Poststreptokok glomerulonephritis
Glomerulonephritis kan følge gruppe A streptokokinfektioner i enten svælget eller huden, og forekomsten varierer med udbredelse af såkaldte nefritogene stammer fra gruppe A streptokokker i samfundet. Type 12 er den hyppigste M-serotype, der forårsager PSGN efter faryngitis, og M type 49 er den serotype, der oftest er relateret til pyoderma-associeret nefritis. Den latente periode mellem GAS-infektion og begyndelsen af glomerulonephritis varierer fra 1-2 uger.
Patogenese synes at være immunologisk medieret. Immunglobuliner, komplementkomponenter og antigener, der reagerer med streptokokantisera, er til stede i glomerulus tidligt i løbet af sygdommen, og antistoffer fremkaldt af nefritogene streptokokker postuleres til at reagere med nyrevæv på en sådan måde, at de fremmer glomerulær skade. I modsætning til akut reumatisk feber er gentagelser af PSGN sjældne. Diagnose af PSGN er baseret på klinisk historie, fysiske undersøgelsesresultater og bekræftende bevis for nylig streptokokinfektion.
Toxic shock syndrome
Alvorlige GAS-infektioner associeret med chok og organsvigt er rapporteret med stigende hyppighed, overvejende i Nordamerika og Europa. for så vidt de fleste tilfælde forekommer i forbindelse med infektioner i blødt væv. Streptokok-TSS kan imidlertid også forekomme i forbindelse med andre fokale streptokokinfektioner, herunder faryngeal infektion.
Patogenesen af streptokok-TSS synes delvis at være relateret til visse ( A, C, F) streptokokpyogene eksotoksiner (SPE’er) til at fungere som superantigener.
Scarlet feber
Når et fint, diffust, erytematøst udslæt er til stede i forbindelse med akut streptokokfaryngitis, sygdommen kaldes skarlagensfeber. Udslæt af skarlagensfeber er forårsaget af de pyrogene eksotoksiner (dvs. SPE A, B, C og F). Udslæt afhænger stærkt af toksinekspression; forud eksisterende humoral immunitet over for det specifikke SPE-toksin forhindrer de kliniske manifestationer af skarlagensfeber.
Skarlagensfeber er tilsyneladende blevet mindre almindelig og mindre virulent end i de sidste årtier; imidlertid er forekomsten cyklisk afhængig af forekomsten af toksinproducerende stammer og immunstatus for befolkningen. Transmissionsformer, aldersfordeling af tilfælde og andre epidemiologiske træk svarer til dem for streptokokfaryngitis.
Sygdomme i centralnervesystemet
Det primære bevis for poststreptokok autoimmunt centralnervesystem (CNS) sygdom tilvejebringes ved undersøgelser af Sydenham chorea, den neurologiske manifestation af reumatisk feber. Rapporter om tvangslidelse (OCD), tic-lidelser og andre neuropsykiatriske symptomer, der forekommer i forbindelse med gruppe A beta-hæmolytiske streptokokinfektioner antyder, at forskellige CNS-følgevirkninger kan udløses af poststreptokok autoimmunitet.