- Tilstedeværelsen af høje koncentrationer af antistof (titer > 1: 640) bør gøre en mistænksom for, at en autoimmun lidelse er til stede. I dette scenario anbefaler jeg, at sera derefter testes for antistoffer mod dsDNA, Sm, RNP, Ro (SS-A), La (SS-B) og måske Scl-70. Tilstedeværelsen af antistoffer mod nogen af disse øger sandsynligheden for, at patienten har SLE, MCTD, Sjögrens eller sklerodermi. Nogle laboratorier tester automatisk for disse antistoffer, når ANA-screeningen er positiv. Imidlertid er tilstedeværelsen af disse antistoffer ikke diagnostisk med sygdomme. Hvis der ikke kan stilles nogen indledende diagnose, er det min praksis at overvåge patienten omhyggeligt over tid for udviklingen af en ANA-associeret sygdom og se patienten mindst to gange årligt.
- Kombinationen af lave titere af antistof (< 1:80) og ingen eller få tegn eller symptomer på sygdom antyder en meget mindre sandsynlighed for en autoimmun sygdom. Som et resultat skal disse patienter med lave ANA-titere revurderes mindre hyppigt – årligt, medmindre kliniske symptomer udvikler sig til at antyde en autoimmun sygdom.
- En patient med negativ ANA er højst usandsynligt at have hverken SLE, MCTD , Sjögrens eller sklerodermi. Men hvis der stadig er stærke kliniske beviser for en systemisk autoimmun lidelse, kan man teste for de specifikke antistoffer mod dobbeltstrenget (ds) DNA, Sm, RNP, Ro, La eller Scl-70, skønt, efter min erfaring, de er typisk negative. Ikke desto mindre er det klogt at se sådanne patienter, hvor der er et højt klinisk indeks for mistanke, i det mindste årligt – dog hyppigere, hvis det er klinisk indiceret.
- Antinukleære antistoffer producerer en lang række farvningsmønstre (homogen, diffus , perifer, kant, plettet, nukleolær, anticentromer osv.). Det nukleare farvningsmønster er blevet anerkendt at have en relativt lav følsomhed og specificitet for forskellige autoimmune lidelser. Tilstedeværelsen af antistoffer rettet mod specifikke nukleare antigener er normalt mere nyttig. (Disse antistoffer inkluderer følgende: dsDNA, Sm, RNP, Ro, La eller Scl-70.)
I løbet af de sidste par år har efterforskere og biotekvirksomheder udviklet fast fase immunassays til erstatning af IF ANA-testen.4-23 Begrundelsen bag dette forsøg vedrører IF-teknikkens ydeevneegenskaber. Denne test er meget arbejdskrævende og udsættes for variation på grund af forskellige fortolkninger af teknikere. Også komplicerende test er falmningen af billedet, da det undersøges i et fluorescerende mikroskop. Derudover bruger IF-teknikken seriefortyndinger af patientsera, hvilket vil give resultater, der muligvis ikke er lineære. Variationer i titer to gange er almindelige i den daglige test på den samme prøve; fire gange forskelle siges at være “signifikante.” Derimod er fastfase-immunoanalyser automatiserede og meget reproducerbare. Resultaterne er lineære, og teknikken er mindre arbejdskrævende og dermed billigere at udføre.
På grund af disse overvejelser bør der være økonomiske besparelser i ved anvendelse af en fastfase-immunanalyse til kvantificering af en ANA. I et forsøg på at udvikle fastfase-ANA-immunanalyser har et antal grupper således sat på den faste fase, uanset hvilke antigener der typisk analyseres i de mere specifikke ANA-immunoanalyser (f.eks. DNA, Sm, RNP, Ro / SSA, La / SSB, nukleoprotein, celleekstrakter osv.). I offentliggjorte rapporter er korrelationskoefficienten mellem ANA-titere og disse fastfase-analyser ret god. Således har mange kommercielle firmaer skiftet deres ANA’er til disse fastfase-immunanalyser.4-23 Af bekymring er imidlertid den høje frekvens / procentdel af falske negative resultater hos patienter med kendt SLE og relaterede sygdomme såvel som den fortsatte høje frekvens af “falske positive” (f.eks. en positiv ANA hos nogen uden SLE) i disse undersøgelser. 15-21 Der er behov for yderligere arbejde for at forbedre følsomheden og især specificiteten af disse fastfase-immunanalyser for at sikre, at patienter med SLE og relaterede sygdomme ikke går glip af disse fastfase-immunanalyser.
Antistoffer mod DNA
Antistoffer mod DNA kan primært opdeles i dem, der reagerer med enkeltstrenget (ss) DNA, og dem, der genkender dsDNA.24-26
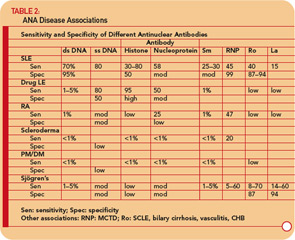
Anti- ssDNA-antistoffer er rapporteret i SLE, reumatoid arthritis, lægemiddelrelateret lupus, raske slægtninge til patienter med SLE og, mindre almindeligt, i andre reumatiske sygdomme. (Se tabel 2, s. 17.) Således har anti-ssDNA begrænset anvendelighed til diagnosen SLE eller andre reumatiske sygdomme. Anti-ssDNA korrelerer ikke godt med sygdomsaktivitet og er derfor ikke nyttige til sygdomsadministration.
Antistoffer mod dsDNA detekteres hyppigst ved fastfase-immunanalyser, men også i nogle laboratorier ved crithidia IF-analysen lejlighedsvis Farr radioimmunoassay.De fleste hospitaler og kommercielle laboratorier gør kun et. Farr-analysen har sandsynligvis den højeste specificitet og den laveste følsomhed af de tre analyser til diagnose af SLE, mens fast-fase-analyser har den højeste følsomhed og den laveste specificitet; crithidia-analysen falder imellem. Farr-analysen har også ulempen ved at bruge radioaktivt materiale, som de fleste laboratorier undgår, og crithidia-testen er meget arbejdskrævende. Jeg foretrækker ELISA-analysen til daglig brug.
Anti-dsDNA er specifikke (95%), men ikke meget følsomme (70%) for SLE, hvilket gør dem meget nyttige til diagnose, når de er positive.9 (Se tabel 2 17.) De findes lejlighedsvis under andre tilstande, herunder reumatoid arthritis, juvenil arthritis, medikamentinduceret lupus, autoimmun hepatitis og endda hos normale personer.
Titere på anti-dsDNA-antistoffer svinger ofte med sygdomsaktivitet, især lupus nefritis, og er derfor nyttige i mange patienter til at følge SLE-forløbet. Hvis en patient har en stigende titer eller meget høj titer, men klinisk er hvilende, behandler jeg ikke den serologiske abnormitet, men betragter det som et advarselstegn, at patienten skal følges nøje og behandles, når noget sker klinisk for at berettige en ændring i terapi. Imidlertid har nogle efterforskere behandlet disse serologiske abnormiteter (især når de er forbundet med lave komplementniveauer) og har rapporteret forbedrede kliniske resultater. Omvendt bruger jeg en faldende titer hos en person, der bliver bedre efter bluss på behandlingen som en guide til at reducere behandlingen (f.eks. Kortikosteroider og / eller immunsuppressive stoffer).
Forbindelsen mellem anti-dsDNA-antistoffer og andre sygdomsmanifestationer af SLE er langt mindre klare. For eksempel er der ingen sammenhæng mellem anti-dsDNA-titer og sygdomsaktivitet af neuropsykiatrisk SLE.
At skelne mellem aktive lupus manifestationer fra infektiøse komplikationer eller toksiske virkninger af lægemidler – og fra ikke-relateret sygdom – er altid en udfordring. Tilstedeværelsen af anti-dsDNA-antistoffer kan være nyttigt hos nogle patienter ved denne skelnen.
Anti-Smith og Anti-Ribonukleoprotein-antistoffer (anti-RNP) detekteres hyppigst ved fastfase-immunoanalyser.24,27
Anti-Sm-antistoffer findes kun hos 10% til 40% af patienterne med SLE, men er meget sjældne hos patienter med andre forhold (dvs. de er ikke følsomme, men er meget specifikke). Måling af anti-Sm-titere kan være nyttig diagnostisk, især på et tidspunkt, hvor anti-DNA-antistoffer ikke kan detekteres. I betragtning af den relativt lave følsomhed af anti-Sm udelukker en negativ værdi imidlertid på ingen måde diagnosen SLE.
Anti-RNP-antistoffer findes hos ca. 40% til 60% af patienterne med SLE, men er ikke specifikke for SLE, da de er et definerende træk ved MCTD. Disse antistoffer kan også forekomme i lave titere og lave frekvenser i andre reumatiske sygdomme, herunder RA og sklerodermi. (Se tabel 2, s. 17.)
Hverken titeren (niveauerne) af anti-Sm eller anti-RNP-antistoffer korrelerer med nogen klinisk aktivitet.
Anti-Ro / SSA og Anti-La / SSB-antistoffer
Antistoffer mod Ro / SSA og La / SSB detekteres hyppigst ved fastfase-immunoanalyser.28,29 Anti-Ro / SSA og anti-La / SSB er blevet påvist i høj frekvens hos patienter med Sjögrens syndrom og i SLE, men også hos patienter med lysfølsom dermatitis og hos 0,1% til 0,5% af raske voksne.
Anti-Ro / SSA-antistoffer findes hos ca. 50% af patienter med SLE. (Se tabel 2, s. 17.) De har været forbundet med lysfølsomhed, subakut kutan lupus, kutan vaskulitis (palpabel purpura), interstitiel lungesygdom, neonatal lupus og medfødt hjerteblok. Anti-Ro / SSA-antistoffer findes hos ca. 75% af patienterne med primært Sjögrens syndrom (se tabel 2, s. 17), og høje titere af disse antistoffer er forbundet med en større forekomst af ekstra kirtelfunktioner, især purpura og vaskulitis. Derimod er Ro / SSA-antistoffer kun til stede hos 10% til 15% af patienter med sekundært Sjögrens syndrom associeret med reumatoid arthritis. Derfor understøtter tilstedeværelsen af Ro / SSA- eller anti-La / SSB-antistoffer hos patienter med mistanke om primært Sjögrens syndrom stærkt diagnosen.
Ca. 50% af patienterne med SLE, der har anti-Ro-antistof, har også anti -La antistof, et nært beslægtet RNA-protein antigen. Tilsvarende har de fleste patienter med Sjögrens syndrom også anti-La (SSB) antistoffer. Det er meget sjældent at finde patienter med anti-La-antistoffer uden anti-Ro-antistoffer.
Efter min mening er indikationerne for bestilling af en anti-Ro / SSA og anti-La / SSB antistof test som følger:
- Kvinder med SLE, der er gravide eller kan blive gravid i fremtiden;
- Kvinder, der tidligere har født et barn med hjerteblok eller myokarditis;
- Patienter med en historie med uforklarlige lysfølsomme hududbrud;
- Patienter, der stærkt mistænkes for at have SLE, men som har en negativ ANA-test; eller
- Patienter med symptomer på xerostomi, keratoconjunctivitis sicca og / eller spyt- og tårekirtelforstørrelse.
Antiribosomalt P-proteinantistoffer
Anti- ribosomale P-proteinantistoffer er blevet påvist hos 10% til 20% af patienterne med SLE i USA og 40% til 50% af de asiatiske patienter med SLE, men sjældent i andre reumatiske sygdomme. 30 Anti-ribosomalt P-proteinantistoffer kan være stærkt specifikt for lupusassocieret psykose, selvom ikke alle undersøgelser har bekræftet dette. Depression og nyre- og leverinddragelse hos patienter med lupus har også været forbundet med anti-ribosomalt P-proteinantistoffer i nogle små undersøgelser.
På grund af den lave følsomhed og dårlig klinisk korrelation ser mange efterforskere – inklusive mig selv – se ringe klinisk anvendelighed i denne test.
Anticentromere antistoffer
Anticentromere antistoffer (ACA’er) findes næsten udelukkende hos patienter med begrænset kutan systemisk sklerose (lcSSc), især hos dem med CREST.31 ACA’er er observeret hos 57% af patienterne med CREST, men er også set hos patienter med andre tilstande, herunder hos nogle patienter med Raynauds fænomen alene. ACA’er detekteres typisk af det karakteristiske IF-mønster på Hep-2-celler.
Anti-Scl-70 (topoisomerase-1) Antistoffer
Ca. 15% til 20% af patienterne med sklerodermi har antistoffer mod et 70 kd protein (topoisomerase-1), der efterfølgende hedder Scl-70.31. Den sædvanlige metode til påvisning er ved ELISA. Tilstedeværelsen af disse antistoffer ser ud til at øge risikoen for lungefibrose hos patienter med sklerodermi og er ret specifik for sygdommen.
Resumé
Hvis man har mistanke om SLE baseret på historien, fysisk undersøgelse og fuldstændig blodtælling (fx leukopeni, trombocytopeni), anmode om en ANA-test. Hvis det er negativt, er det meget usandsynligt, at patienten har SLE, og patienten kan blive beroliget. Hvis titeren er < 1: 160, er SLE usandsynlig, og patienten kan forsikres om, at SLE er usandsynlig, men patienten bør følges med jævne mellemrum. En titer på ≥1: 160 øger sandsynligheden for SLE og relaterede lidelser. Det er dog vigtigt at huske, at 85% af personer med en positiv ANA ikke har SLE. Hvis ANA er positiv, bør man også teste for antistoffer mod dsDNA, Sm, RNP, Ro / SSA og La / SSB. Tilstedeværelsen af disse antistoffer øger sandsynligheden for, at patienten har SLE og relaterede lidelser (se tabel 2, s. 17), og det er nødvendigt, at patienten følges nøje. Påvisning af anti-centromer og anti-Scl-70 antistoffer er meget nyttig til diagnosticering af sklerodermi. Påvisningen af antistoffer mod Ro / SSA og La / SSB er også nyttige til diagnosen Sjögrens syndrom.
Den eneste af disse tests, der er nyttige til at overvåge aktivitet, er anti-dsDNA.
Anerkendelse: Jeg takker arbejdet fra mange forfattere af UpToDate in Medicine, hvis arbejde gav en nyttig ramme for udviklingen af denne artikel såvel som til Dr. Robert Shmerling, David Lee og Donald Bloch, som jeg har skrevet papirer med og kapitler om samme emne.
Dr. Schur er professor i medicin ved Harvard Medical School og divisionen af reumatologi, immunologi og allergi i medicinsk afdeling ved Brigham and Women’s Hospital i Boston.
- Reichlin M. Måling og klinisk betydning af antinukleære antistoffer. Opdateret. Oktober 2008.
- American College of Rheumatology Ad Hoc Committee for Immunologic Testing Guidelines. Retningslinjer for immunologisk laboratorietest i reumatiske sygdomme: En introduktion. Gigt Reum. 2002; 47: 429-433.
- Solomon DH, Kavanaugh AJ, Schur PH, et al. Evidensbaserede retningslinjer for brug af immunologiske tests: Antinuklear antistof-test. Gigt Reum. 2002; 47: 434-444.
- Sinclair D, Saas M, Williams D, Hart M, Goswami R. Kan en ELISA erstatte immunfluorescens til påvisning af anti-nukleare antistoffer? – Den rutinemæssige anvendelse af anti ELISA’er til screening af nukleart antistof. Clin Lab. 2007; 53: 183-191.
- Avaniss-Aghajani E, Berzon S, Sarkissian A. Klinisk værdi af multipleksede perlebaserede immunassays til påvisning af autoantistoffer mod nukleare antigener. Clin Vaccine Immunol. 2007; 14: 505-509.
- Copple SS, Martins TB, Masterson C, Joly E, Hill HR. Sammenligning af tre multipleksede immunassays til påvisning af antistoffer mod ekstraherbare nukleare antistoffer ved anvendelse af klinisk definerede sera. Ann N Y Acad Sci.2007; 1109: 464-472.
- Caramaschi P, Ruzzenente O, Pieropan S, et al. Bestemmelse af ANA-specificitet ved anvendelse af multiplekset fluorescerende mikrosfæreimmunoanalyse hos patienter med ANA-positivitet ved høje titre efter infliximab-behandling: Indledende resultater. Rheumatol Int. 2007; 27: 649-654.
- Biagini RE, Parks CG, Smith JP, Sammons DL, Robertson SA. Analytisk præstation af AtheNA MultiLyte ANA II-analysen i sera fra lupuspatienter med flere positive ANA’er. Anal Bioanal Chem. 2007; 388: 613-618.
- Gonzalez C, Garcia-Berrocal B, Perez M, et al. Laboratoriescreening af bindevævssygdomme ved et nyt automatiseret ENA-screeningsassay (EliA Symphony) hos klinisk definerede patienter. Clin Chim Acta. 2005; 359: 109-114.
- Eissfeller P, Sticherling M, Scholz D, et al. Sammenligning af forskellige testsystemer til samtidig påvisning af autoantistof i bindevævssygdomme. Ann N Y Acad Sci. 2005; 1050: 327-339.
- Smith J, Onley D, Garey C, et al. Bestemmelse af ANA-specificitet ved hjælp af UltraPlex-platformen. Ann N Y Acad Sci. 2005; 1050: 286-294.
- Martins TB, Burlingame R, von Muhlen CA, et al. Evaluering af multiplekset fluorescerende mikrosfæreimmunoanalyse til påvisning af autoantistoffer mod nukleare antigener. Clin Diagn Lab Immunol. 2004; 11: 1054-1059.
- Bernardini S, Infantino M, Bellincampi L, et al. Screening af antinukleære antistoffer: Sammenligning mellem enzymimmunoanalyse baseret på nukleare homogenater, oprensede eller rekombinante antigener og immunfluorescensassay. Clin Chem Lab Med. 2004; 42: 1155-1160.
- Nossent H, Rekvig OP. Antinuklear antistof-screening i dette nye årtusinde: Farvel til mikroskopet? Scand J Rheumatol. 2001; 30: 123-126; diskussion 127-128.
- Lopez-Hoyos M, Rodriguez-Valverde V, Martinez-Taboada V. Udførelse af antinukleært antistof bindevævssygdomsskærm. Ann N Y Acad Sci. 2007; 1109: 322-329.
- Ghillani P, Rouquette AM, Desgruelles C, et al. Evaluering af LIAISON ANA-screeningsassay til antinukleært antistof-test ved autoimmune sygdomme. Ann N Y Acad Sci. 2007; 1109: 407-413.
- Bonilla E, Francis L, Allam F, et al. Immunfluorescensmikroskopi er bedre end fluorescerende perler til påvisning af antinukleært antistofreaktivitet hos patienter med systemisk lupus erythematosus. Clin Immunol. 2007; 124: 18-21.
- Nifli AP, Notas G, Mamoulaki M, et al. Sammenligning af et multiplex, perlebaseret fluorescerende assay og immunfluorescensmetoder til påvisning af ANA og ANCA autoantistoffer i humant serum. J Immunol-metoder. 2006; 311: 189-197.
- Shovman O, Gilburd B, Zandman-Goddard G, et al. Multiplexed AtheNA multi-lyte immunoanalyse til ANA screening i autoimmune sygdomme. Autoimmunitet. 2005; 38: 105-109.
- Ulvestad E. Ydeevneegenskaber og klinisk anvendelighed af en hybrid ELISA til påvisning af ANA. Apmis. 2001; 109: 217-222.
- Olaussen E, Rekvig OP. Screeningstest for antinukleære antistoffer (ANA): Selektiv anvendelse af centrale nukleare antigener som et rationelt grundlag for screening ved ELISA. J Autoimmun. 1999; 13: 95-102.
- Homburger HA, Cahen YD, Griffiths J, Jacob GL. Påvisning af antinukleære antistoffer: Sammenlignende evaluering af enzymimmunoassay og indirekte immunfluorescensmetoder. Arch Pathol Lab Med. 1998; 122: 993-999.
- Gniewek RA, Stites DP, McHugh TM, Hilton JF, Nakagawa M. Sammenligning af antinukleære antistof testmetoder: Immunfluorescensanalyse versus enzymimmunanalyse. Clin Diagn Lab Immunol. 1997; 4: 185-188.
- Reichlin M. Antistoffer mod DNA, SM og RNP. Opdateret. Oktober 2008.
- Hahn BH. Antistoffer mod DNA. Ny Engl J Med. 1998; 338: 1359.
- Kavanaugh AF, Solomon DH, American College of Rheumatology Ad Hoc Committee on Immunologic Testing Guidelines. Retningslinjer for immunologisk laboratorietest i reumatiske sygdomme: Anti-DNA-antistofforsøg. Gigt Reum. 2002; 47: 546-555.
- Benito-Garcia E, Schur PH, Lahita R. Retningslinjer for immunologisk laboratorietest i reumatiske sygdomme: Anti-Sm og Anti-RNP antistofforsøg. Gigt Reum. 2004; 51: 1030-1044.
- Reichlin M. Klinisk betydning af anti-Ro / SSA og anti-La / SSB antistoffer. Opdateret. Oktober 2008.
- Reveille JD, Sherrer YRS, Solomon DH, Schur P, Kavanaugh A. Evidensbaserede retningslinjer for brug af immunologiske laboratorietest: Anti-Ro (SS-A) og La (SS- B): En rapport fra ACR Ad Hoc-udvalget om retningslinjer for immunologisk testning. Indsendt til offentliggørelse.
- Reichlin M. Antiribosomale P-proteinantistoffer. Opdateret. Oktober 2008.
- Denton CP. Klassificering af sklerodermi. Opdateret. Oktober 2008.