US Pharm. 2018; 43 (7): 22-26.
SAMMENFATNING: Statiner er en klasse medicin, der er meget anvendt til primær og sekundær forebyggelse af kardiovaskulære hændelser. Da seks statiner er tilgængelige generelt, kan udvælgelsen af et passende middel bestemmes ud fra lægemiddelspecifikke faktorer, herunder doseringsovervejelser, lægemiddelinteraktioner og bivirkninger. Individuelle planer for patientpleje kan udvikles baseret på data fra vigtige kliniske studier, forskelle i retningslinjer og aktuelle ledelsesanbefalinger for to større bivirkninger forbundet med statinbrug.
Hjørnestenen i behandling med dyslipidæmi involverer brugen af 3-hydroxy-3-methylglutaryl-coenzym En reduktasehæmmere, mere almindeligt kendt som statiner. Med en række generiske muligheder på markedet og stærke beviser, der understøtter deres anvendelse, er statiner nogle af de mest ordinerede lægemidler i verden.1 Imidlertid har hyppig brug af disse stoffer ført til løbende kontrol af deres sikkerhed og løbende debat om deres rolle i terapi. Denne artikel, der fokuserer på generiske statiner, vil fremhæve debatten om statins rolle i terapi, diskutere korrekt brug og udforske beviser omkring to store bivirkninger.
Af de syv forskellige statiner på markedet er seks er tilgængelige generisk (TABEL 1) .2-7 Tre tilgængelige mærkeformuleringer er pitavastatin (Livalo), oral oral simvastatin-suspension (FloLipid) og forlastet frigivelse af lovastatin (Altoprev) .8-10 Mærkernes rolle i behandlingen er begrænset givet den udbredte tilgængelighed af generiske indstillinger.
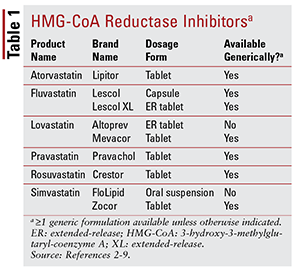
Atorvastatin og simvastatin findes også generisk i flere kombinationsprodukter. Disse inkluderer kombinationen af atorvastatin og amlodipin, en calciumkanalblokker (CCB), der er indiceret til hypertension, og kombinationen af simvastatin og ezetimibe, en tarmkolesterolabsorberende hæmmer, der også er indiceret til hyperkolesterolæmi.11,12 Coformuleret statin- og niacinprodukter (niacin / lovastatin og niacin / simvastatin) blev fjernet fra markedet i 2016 på baggrund af mangel på beviser for, at tilsætning af niacin hos statinbehandlede patienter yderligere reducerer kardiovaskulære (CV) resultater ud over det, der ses med statiner alene.13
BEHANDLINGSANBEFALINGER
Statiner har gentagne gange vist sig effektive til at reducere LDL-kolesterol (LDL-C) og triglyceridniveauer, mens de hæver HDL-kolesterol (HDL-C) niveauer.14 Derudover har de vist sig at forbedre meningsfulde patientorienterede resultater, såsom større CV-hændelser (CVE’er), i både primær og sekundær forebyggelse.15-19
Flere stærkt debatterede behandlingsretningslinjer diskuterer statins rolle i behandling af hy perlipidæmi. Disse inkluderer 2013 American College of Cardiology / American Heart Association (ACC / AHA) retningslinje og 2017 American Academy of Clinical Endocrinology (AACE) retningslinje.14,20 Begge retningslinjer antyder, at efter implementering af livsstilsændringer, herunder rygestop, overholdelse af et træningsregime og efter en hjerte-sund diæt er statiner førstelinjebehandling til både primær og sekundær forebyggelse af CV-sygdom (CVD). 14,20 Retningslinjerne adskiller sig imidlertid i, hvordan man bestemmer, hvilke statiner der er egnede til hvilke patienter.
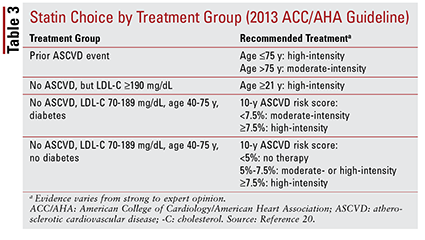
2013 ACC / AHA-retningslinjen introducerede fire behandlingsgrupper, der skulle målrettes til statinbehandling:
1. Patienter med tidligere aterosklerotisk CVD (ASCVD), herunder patienter med en tidligere hændelse (dvs. akutte koronarsyndrom, historie med myokardieinfarkt, stabil eller ustabil angina, koronar eller anden arteriel revaskularisering, slagtilfælde, forbigående iskæmisk angreb eller perifer arteriel sygdom med formodet aterosklerotisk oprindelse).
2. Patienter uden historie med en ASCVD-hændelse, der har et LDL-C-niveau på 190 mg / dL eller højere. Alder er ikke et grundlag for udelukkelse fra dette kriterium.
3. Patienter i alderen 40 til 75 år med diabetes, men ingen historie med en ASCVD-hændelse og et LDL-C-niveau mellem 70 og 189 mg / dL.
4. Patienter i alderen 40 til 75 år uden diabetes, der ikke tidligere har haft en ASCVD-hændelse og et LDL-C-niveau mellem 70 og 189 mg / dL.20
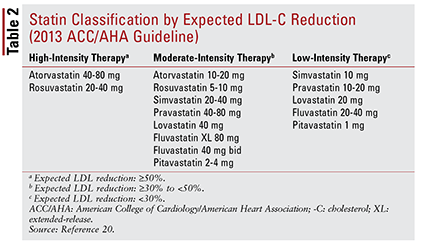
ACC / AHA-retningslinjen introducerede også ideen om at gruppere statiner efter intensitet (dvs. deres forventede LDL-C – sænkningsevne) (TABEL 2) .20 Baseret på behandlingsgruppen (som defineret ovenfor) anbefaler retningslinjen specifikke statinintensiteter til bestemte kliniske situationer (TABEL 3) .20 Flere behandlingsgrupper kræve beregning af en ASCVD-risikoscore ved hjælp af en ASCVD-risikovurderer. Dette online værktøj tager højde for patientens alder, køn, race, systoliske blodtryk, total kolesterol, HDL-C og tidligere medicinsk historie, der er signifikant for hypertensionbehandling, diabetes eller rygning.21 Når alle input er indtastet, er patientens 10 -årsrisikoen for at opleve en ASCVD-begivenhed beregnes.
Disse anbefalinger gælder ikke automatisk for visse undergrupper af patienter. For eksempel bør brugen af statiner til ældre voksne behandles med forsigtighed. Selvom statinbrug til sekundær forebyggelse hos ældre patienter giver betydelig fordel, er dets anvendelse til primær forebyggelse uklar.22-24 Derudover har patienter med hjertesvigt ikke vist sig at have de samme fordele ved statinbehandling som dem uden hjertesvigt.25 Baseret på disse fund inkluderer behandlingsanbefalinger begrænsning af initiering af statiner med høj intensitet til patienter under 75 år og muligvis undgåelse af statiner hos patienter med hjertesvigt.20 Samlet set er beslutningen om at bruge statiner i disse grupper ikke entydig og bør involvere en løbende samtale mellem udbyder og patient om potentielle risici og fordele ved terapi.20
I modsætning til 2013 ACC / AHA-anbefaling om at indlede terapi i henhold til klassifikation af behandlingsgrupper anbefaler AACE-retningslinjen for 2017, at individuelle patienter behandlet på baggrund af laboratoriefund.14 I henhold til denne retningslinje bestemmes patientrisikoen af en række større, yderligere, a nd utraditionelle risikofaktorer. Enkeltpersoner klassificeres derefter i en af fem risikogrupper, hver med et tilsvarende LDL-C og ikke-HDL-C mål (TABEL 4). Baseret på aktuelle niveauer og individualiserede mål bør statiner alene eller i kombination med andre stoffer initieres baseret på forventet LDL-C– eller ikke – HDL-C – sænkende evne.14

Kombinationsbehandling, der involverer tilføjelsen af et andet middel til igangværende statinbehandling, forbliver et noget kontroversielt emne. Mens tidligere forsøg og retningslinjer minimerede tilsætningen af andre stoffer til baggrundsstatinbehandling, understøtter nylige undersøgelser og konsensusudsagn – inklusive en fra ACC / AHA – brugen af ezetimib, evolocumab eller alirocumab, hvoraf de sidste to er proproteinkonvertase subtilisin / kexin type 9-hæmmere, som add-on terapi til sekundær forebyggelse. 20,26-31 Når det er sagt, forbliver statiner universel førstelinjebehandling i både primær og sekundær forebyggelse; den specifikke rolle for andre specifikke stoffer er uklar.
VALG AF STATIN
Valget af statinbehandling begynder med klinikerens foretrukne behandlingsmetode, uanset om det er ACC / AHA-metoden til statinbehandling grupper eller AACE-metoden for LDL-C eller ikke-HDL-C mål. Derfra skal der tages hensyn til egenskaberne for hver statin for at bestemme den bedste løsning for den enkelte patient. Ikke alle statiner er ens, og der findes flere vigtige forskelle, der kan påvirke patientvalg, herunder doseringsovervejelser, lægemiddelinteraktioner og bivirkninger (AE’er).
Dosering
Selvom de fleste statiner muligvis er tages uden hensyntagen til måltider, bør lovastatin med øjeblikkelig frigivelse (IR) tages sammen med aftenmåltidet på grund af øget biotilgængelighed.4 Det modsatte gælder dog for lovastatin med forlænget frigivelse, som ikke bør tages sammen med mad på grund af nedsat biotilgængelighed .8 Yderligere, skønt alle statiner kan doseres en gang dagligt, kan IR fluvastatin og lovastatin kræve dosering to gange dagligt. 3,4 Endelig, mens atorvastatin, pravastatin og rosuvastatin kan administreres på ethvert tidspunkt af dagen, fluvastatin, lovastatin og simvastatin bør tages om aftenen. 3,4,7 Simvastatin viste sig især at have signifikant forskellig effekt, når det blev taget om aftenen i modsætning til morgenen.32
Lægemiddelinteraktioner
Hver statin har forskellige bekymringer vedrørende lægemiddel-lægemiddel- og lægemiddel-mad-interaktioner på grund af de specifikke veje, gennem hvilke hver metaboliseres (TABEL 5). Der findes for mange lægemiddelinteraktioner til at diskutere hver i detaljer; derfor er kun nogle få udvalgte beskrevet nedenfor.
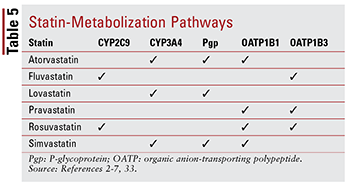
Fibrerer: Skønt kombinationen af et fibrat og et statin ikke har vist sig at ændre kliniske resultater betydeligt, kan patienter stadig ordineres gemfibrozil, fenofibrat eller fenofibersyre sammen med et statin til at målrette mod alvorligt ukontrolleret hypertriglyceridæmi.14,20,26,33 Fordi begge disse klasser er forbundet med muskelrelateret toksicitet, kombineret terapi øger denne risiko signifikant sammenlignet med begge terapi alene.33 Denne additiv toksicitet ses hyppigere med gemfibrozil end med andre fibrater.33 Brug af gemfibrozil er derfor kontraindiceret med simvastatin og bør undgås med andre statiner.7,20 Hvis der anvendes et statin og et fibrat sammen, foretrækkes fenofibrat eller fenofibersyre.20,33 Hvis gemfibrozil skal anvendes, er fluvastatin — eller, med omhyggelig kontrol, atorvastatin eller rosuvastatin (maksimalt 10 mg dagligt) ) – er den valgte agent.33
Amiodaron: Dette antiarytmiske middel indiceret til ventrikelflimmer er en kendt hæmmer af P-glycoprotein (Pgp) og CYP450 enzymsystemet, specifikt CYP3A4 og i mindre grad CYP2C9.33,34 Som en resultat, der findes maksimalt anbefalede doser for lovastatin (maksimalt 40 mg dagligt) og simvastatin (maksimalt 20 mg dagligt), når de anvendes sammen med amiodaron.4,7,33 Selvom atorvastatin metaboliseres gennem CYP3A4, er dosisjustering ikke nødvendig (på samme måde som andre statiner) fordi data ikke antyder alvorlige bivirkninger, når atorvastatin og amiodaron anvendes samtidigt.2,33
CCB’er: Både dihydropyridin (amlodipin) og nondihydropyridin CCB’er (diltiazem, verapamil) har vist sig at have meningsfuld lægemiddelinteraktion med statiner . På samme måde som amiodaron, amlodipin, diltiazem og verapamil hæmmer CYP3A4.33,35-37 Amlodipin har også en hæmmende virkning på Pgp.33,35 Baseret på AE’er rapporteret i litteraturen anbefales en maksimal daglig dosis på 20 mg for lovastatin, når brugt sammen med amlodipin, diltiazem eller verapamil.4,33 Det anbefales også, at simvastatin ikke overstiger 20 mg, når det anvendes sammen med amlodipin, men en lavere dosis på 10 mg bør administreres, når det anvendes sammen med diltiazem og verapamil.7,33 Ingen specifik dosering der findes anbefalinger med atorvastatin, skønt der skal udvises forsigtighed, når det administreres med en af de ikke-dihydropyridin-CCB’er. 2,33
Bivirkninger
Statiner tolereres generelt godt; seponeringsraterne er dog fortsat høje.38 Afbrydelse af statinbehandling og manglende genoptagelse af statinbehandling efter forekomsten af bivirkninger er forbundet med øgede frekvenser af CVE’er.39 Patients bekymringer over statinsikkerhed i lyset af to store statinrelaterede AE’er— myotoksicitet og nybegyndt diabetes – kan føre til seponering af statin.
Myotoksicitet: Statiner har længe været forbundet med muskelrelateret toksicitet, herunder myalgi (muskelsmerter uden forhøjet kreatinkinase), myopati (generel betegnelse for muskler) sygdom) og myositis (muskelbetændelse), hvoraf de sidste to involverer betydelige CK-forhøjelser. 40,41 Alle statiner deler en advarsel om den sjældne, men alvorlige bivirkning af rabdomyolyse. 2-7 Ofte er myotoksicitet, der tilskrives statiner, dog på grund af nocebo-effekten det vil sige en person mener, at en medicin vil forårsage skade, og derefter medikamentet forårsager den forventede skade.42,43 Derfor, for at sikre det bedste resultat, skal farmaceuter være velbevandrede i denne almindeligt rapporterede bivirkning og dens korrekte håndtering. p>
Det er forkert at antage, at alle rapporter om muskelsymptomer skyldes nocebo-effekten; korrekt kontrol af patientens tidligere medicinske historie (PMH), beskrivelse af smerter og tilknytning til statinbehandling er bydende nødvendigt.44 For det første giver en undersøgelse af PMH for CK-forhøjelser og andre potentielle årsager til muskelsmerter eller svaghed klinikeren mulighed for at behandle alternative underliggende patofysiologi eller korrekte faktorer, der kan ændre statinmetabolisme. Almindelige årsager inkluderer alderdom, lægemiddelinteraktioner, nedsat nyre- eller leverfunktion, øget fysisk aktivitet og D-vitaminmangel.20,41
Dernæst skal klinikeren sammenligne patientens præsentation med almindeligt set statin-inducerede symptomer . Statin-induceret muskeltoksicitet præsenteres normalt som smerte, ømhed, kramper og svaghed, normalt i benmusklerne. 20,41 Disse symptomer er typisk værre efter træning og forsvinder ikke uden ophør af det krænkende middel.41
Det sidste trin er at afgøre, om der er en årsagsforbindelse mellem symptomer og statinbrug. Når der er mistanke om statin som årsag til milde til moderate symptomer, anbefales midlertidig tilbagetrækning. Hvis symptomerne ikke løser sig efter ca. 2 uger, er statinen sandsynligvis ikke årsagen og bør genoptages i den originale dosis. Hvis symptomerne forsvinder, bør der dog foretages en ny prøve med den samme statin ved den samme eller en lavere dosis. Hvis lignende symptomer derefter opleves, bør statinen antages at være årsag og ophøre. Efter symptomopløsning bør en lav dosis af et alternativt statin initieres og titreres til den maksimalt tolererede dosis. 20,41 Patientaccept og forståelse af denne proces er vigtige, fordi nocebo-effekten ellers kan føre til yderligere opfattede reaktioner.
Der findes flere andre strategier til håndtering og forebyggelse af disse symptomer. På grund af en højere sandsynlighed for symptomer kan klinikeren vælge at undgå de mest lipofile statiner (lovastatin og simvastatin) til fordel for mere hydrofile statiner (fluvastatin, pravastatin og rosuvastatin) .44 Simvastatin 80 mg bør aldrig initieres som nyt terapi hos enhver patient på grund af en usædvanlig høj frekvens af statinassocierede muskelsymptomer.7,45 Alternative terapier, såsom coenzym Q10, har ikke vist konsekvent fordel, men kan overvejes hos patienter, der oplever psykisk inducerede symptomer.41,44,46 Endelig kan dosering med forlænget interval, som involverer dosering af statinmedicin flere gange ugentligt snarere end en gang dagligt, overvejes. Denne tilgang forbedrer overholdelse og lipidprofiler hos patienter med tidligere statinintolerance.47-49
Nybegyndt diabetes: En vigtig AE forbundet med statinbrug er nybegyndt diabetes. Statiner har vist sig at øge risikoen for diabetesudvikling, selvom der findes flere vigtige advarsler.50 For det første, selvom dette kan betragtes som noget af en klasseeffekt, er den sande risiko for hvert specifikt statin stadig ukendt.51,52 I den største meta -analyse til dato, pravastatin havde den laveste risiko, simvastatin og atorvastatin havde en moderat risiko, og rosuvastatin havde den højeste risiko for at forårsage nybegyndt diabetes.53 Ingen af disse fund var dog statistisk signifikant.53 Derudover fandt konstateringen, at diabetes risikoen stiger, da dosis af stigninger i statin har været inkonsekvent.54
Statin-induceret diabetes er mest udbredt hos personer, der allerede har høj risiko for at udvikle diabetes.50,54 Dette inkluderer ældre patienter og dem med prædiabetes eller metabolisk syndrom.50,55 En konsekvent konstatering har været, at adskillige CVE’er kan forebygges for hvert nyt tilfælde af hændelse diabetes forårsaget af statiner hos patienter med højere risiko.50 xious statin-brugere med moderat eller høj risiko for CV-komplikationer, at risikoen for at udvikle diabetes mere end opvejes af fordelene ved CV-risikoen. Imidlertid er forholdet mellem risiko og fordele uklart hos patienter med meget lav risiko for CVE’er.50
KONKLUSION
Selvom statinbehandling ikke er uden risiko, har fordelene ved at reducere CV-resultater gjorde det til hjørnestenen i forebyggelse af CVE. Tilgængelige retningslinjer er meget forskellige, men den konstante er, at statiner skal være førstelinjeterapi til primær og sekundær forebyggelse hos næsten alle patienter. Den udbredte generiske tilgængelighed af statiner har gjort disse agenter mere og mere tilgængelige. Ved at forstå, at ikke alle statiner er ens, kan apotekeren hjælpe med at sikre det bedst mulige resultat for hver patient.
1. IMS Institute for Healthcare Informatics. Medicinbrug og -udgifter i USA: en gennemgang af 2015 og udsigterne til 2020. https://morningconsult.com/wp-content/uploads/2016/04/IMS-Institute-US-Drug-Spending-2015.pdf. Adgang til 18. marts 2018.
2. Lipitor (atorvastatin) indlægsseddel. New York, NY: Pfizer, Inc; Juni 2017.
3. Lescol / Lescol XL (fluvastatin) indlægsseddel. East Hanover, NJ: Novartis Pharmaceuticals Corp; August 2017.
4. Mevacor (lovastatin) indlægsseddel. Whitehouse Station, NJ: Merck & Co, Inc; Februar 2014.
5. Pravachol (pravastatin) indlægsseddel. Princeton, NJ: Bristol-Myers Squibb Company; Juli 2016.
6. Indlægsseddel til Crestor (rosuvastatin). Wilmington, DE: AstraZeneca Pharmaceuticals LP; August 2017.
7. Zocor (simvastatin) indlægsseddel. Whitehouse Station, NJ: Merck & Co, Inc; Februar 2015.
8. Altoprev (lovastatin) indlægsseddel. Zug, Schweiz: Covis Pharma; April 2017.
9. Indlægsseddel til FloLipid (simvastatin). Brooksville, FL: Salerno Pharmaceuticals LP; Juli 2017.
10. Livalo (pitavastatin) indlægsseddel. Montgomery, AL: Kowa Pharmaceuticals America, Inc; November 2016.
11. Indlægsseddel til Caduet (amlodipin / atorvastatin). New York, NY: Pfizer Inc; Oktober 2017.
12. Vytorin (ezetimibe / simvastatin) indlægsseddel. Whitehouse Station, NJ: Merck & Co, Inc; Februar 2018.
13. AbbVie Inc .; tilbagetrækning af godkendelse af nye lægemiddelansøgninger til Advicor og Simcor. www.federalregister.gov/documents/2016/04/18/2016-08894/abbvie-inc-withdrawal-of-approval-of-new-drug-applications-for-advicor-and-simcor. Adgang til 18. marts 2018.
14. Jellinger PS, Handelsman Y, Rosenblit PD, et al. American Association of Clinical Endocrinologists og American College of Endocrinology guidelines for management of dyslipidemia and prevention of cardiovascular disease. Endocr Pract. 2017; 23 (suppl 2): 1-87.
15. LaRosa JC, Grundy SM, Waters DD, et al. Intensiv lipidsænkning med atorvastatin hos patienter med stabil koronar sygdom. N Engl J Med. 2005; 352: 1425-1435.
16. Ridker PM, Danielson E, Fonseca FA, et al. Rosuvastatin til forebyggelse af vaskulære hændelser hos mænd og kvinder med forhøjet C-reaktivt protein. N Engl J Med. 2008; 359: 2195-2207.
17. Mihaylova B, Emberson J, Blackwell L, et al. Virkningerne af at sænke LDL-kolesterol med statinbehandling hos mennesker med lav risiko for vaskulær sygdom: metaanalyse af individuelle data fra 27 randomiserede forsøg. Lancet. 2012; 380: 581-590.
18. Baigent C, Landray MJ, Reith C, et al. Virkningerne af at sænke LDL-kolesterol med simvastatin plus ezetimibe hos patienter med kronisk nyresygdom (Study of Heart and Renal Protection): et randomiseret placebokontrolleret forsøg. Lancet. 2011; 377: 2181-2192.
19. Cannon CP, Braunwald E, McCabe CH, et al.Intensiv versus moderat lipidsænkning med statiner efter akutte koronarsyndrom. N Engl J Med. 2004; 350: 1495-1504.
20. Stone NJ, Robinson JG, Lichtenstein AH, et al. 2013 ACC / AHA retningslinje om behandling af kolesterol i blodet for at reducere aterosklerotisk kardiovaskulær risiko hos voksne: en rapport fra American College of Cardiology / American Heart Association Task Force om praksisretningslinjer. Cirkulation. 2014; 129 (25 suppl 2): S1-S45.
21. American College of Cardiology. ASCVD Risk Estimator Plus. http://tools.acc.org/ASCVD-Risk-Estimator. Adgang til 18. marts 2018.
22. Wenger NK, Lewis SJ, Herrington DM, et al. Resultater ved brug af høj- eller lavdosis atorvastatin til patienter 65 år eller ældre med stabil koronar hjertesygdom. Ann Intern Med. 2007; 147: 1-9.
23. Shepherd J, Blauw GJ, Murphy MB, et al. Pravastatin hos ældre personer med risiko for vaskulær sygdom (PROSPER): et randomiseret kontrolleret forsøg. Lancet. 2002; 360: 1623-1630.
24. Teng M, Lin L, Zhao YJ, et al. Statiner til primær forebyggelse af hjerte-kar-sygdomme hos ældre patienter: systematisk gennemgang og metaanalyse. Aldring af stoffer. 2015; 32: 649-661.
25. Kjekshus J, Apetrei E, Barrios V, et al. Rosuvastatin hos ældre patienter med systolisk hjertesvigt. N Engl J Med. 2007; 357: 2248-2261.
26. Ginsberg HN, Elam MB, Lovato LC, et al. Virkninger af kombinationslipidbehandling ved type 2-diabetes mellitus. N Engl J Med. 2010; 362: 1563-1574.
27. Kastelein JJ, Akdim F, Stroes ES, et al. Simvastatin med eller uden ezetimibe i familiær hyperkolesterolæmi. N Engl J Med. 2008; 358: 1431-1443.
28. Cannon CP, Blazing MA, Giugliano RP, et al. Ezetimibe blev føjet til statinbehandling efter akutte koronarsyndrom. N Engl J Med. 2015; 372: 2387-2397.
29. Sabatine MS, Giugliano RP, Keech AC, et al. Evolocumab og kliniske resultater hos patienter med hjerte-kar-sygdomme. N Engl J Med. 2017; 376: 1713-1722.
30. Lloyd-Jones DM, Morris PB, Ballantyne CM, et al. 2017 fokuseret opdatering af ACC Expert Consensus Decision Pathway fra 2016 om rollen som ikke-statinbehandlinger til LDL-kolesterolreduktion i styringen af risiko for aterosklerotisk hjerte-kar-sygdom: en rapport fra American College of Cardiology Task Force on Expert Consensus Decision Pathways. J Am Coll Cardiol. 2017; 70: 1785-1822.
31. ODYSSEY-resultater: resultater antyder, at brug af PCSK9-hæmmer reducerer CV-hændelser, LDL-C hos ACS-patienter. American College of Cardiology. www.acc.org/latest-in-cardiology/articles/2018/03/05/15/53/sat-9am-odyssey-outcomes-cv-outcomes-with-alirocumab-after-acs-acc-2018. Adgang til 20. juni 2018.
32. Wallace A, Chinn D, Rubin G. At tage simvastatin om morgenen sammenlignet med om aftenen: randomiseret kontrolleret forsøg. BMJ. 2003; 327: 788.
33. Wiggins BS, Saseen JJ, Page RL, et al. Anbefalinger til styring af klinisk signifikante lægemiddelinteraktioner med statiner og udvalgte stoffer anvendt til patienter med hjerte-kar-sygdom: en videnskabelig erklæring fra American Heart Association. Cirkulation. 2016; 134: e468-e495.
34. Pacerone (amiodaron) indlægsseddel. Maple Grove, MN: Upsher-Smith Laboratories LLC; Juli 2017.
35. Norvasc (amlodipin) indlægsseddel. New York, NY: Pfizer Inc; Oktober 2017.
36. Indlægsseddel til Cardizem (diltiazem). Bridgewater, NJ: Valeant Pharmaceuticals; November 2016.
37. Calan (verapamil) indlægsseddel. New York, NY: Pfizer Inc; September 2017.
38. Riaz H, Khan AR, Khan MS, et al. Metaanalyse af placebokontrollerede randomiserede kontrollerede forsøg med prævalensen af statinintolerance. Er J Cardiol. 2017; 120: 774-781.
39. Zhang H, Plutzky J, Shubina M, Turchin A. Fortsatte statinrecept efter bivirkninger og patientresultater: en kohortestudie. Ann Intern Med. 2017; 167: 221-227.
40. Tomaszewski M, Stepien KM, Tomaszewska J, Czuczwar SJ. Statin-inducerede myopatier. Pharmacol Rep. 2011; 63: 859-866.
41. Stroes ES, Thompson PD, Corsini A, et al. Statinassocierede muskelsymptomer: indvirkning på statinbehandling – European Atherosclerosis Society Consensus Panel Erklæring om vurdering, ætiologi og ledelse. Eur Heart J. 2015; 36: 1012-1022.
42. Gupta A, Thompson D, Whitehouse A, et al. Bivirkninger associeret med ikke-blindet, men ikke med blindet statinbehandling i det anglo-skandinaviske hjerteudfaldsforsøg – lipidsænkende arm (ASCOT-LLA): et randomiseret dobbeltblindt placebokontrolleret forsøg og dets ikke-randomiserede ikke-blinde forlængelse fase. Lancet. 2017; 389: 2473-2481.
43. Pedro-Botet J, Rubiés-Prat J. Statin-associerede muskelsymptomer: pas på nocebo-effekten. Lancet. 2017; 389: 2445-2446.
44. Laufs U, Filipiak KJ, Gouni-Berthold I, et al. Praktiske aspekter i styringen af statinassocierede muskelsymptomer (SAMS). Atheroscler Suppl. 2017; 26: 45-55.
45. FDA-lægemiddelsikkerhedskommunikation: nye begrænsninger, kontraindikationer og dosisbegrænsninger for Zocor (simvastatin) for at reducere risikoen for muskelskade. www.fda.gov/Drugs/DrugSafety/ucm256581.htm. Adgang til 18. marts 2018.
46.Banach M, Serban C, Sahebkar A, et al. Virkninger af coenzym Q10 på statin-induceret myopati: en meta-analyse af randomiserede kontrollerede forsøg. Mayo Clin Proc. 2015; 90: 24-34.
47. Goldberg AS, DeGorter MK, Ban MR, et al. Effekt og plasmakoncentrationer af lægemidler med ikke-daglig dosering af rosuvastatin. Kan J Cardiol. 2013; 29: 915-919.
48. Matalka MS, Ravnan MC, Deedwania PC. Er den alternative daglige dosis af atorvastatin effektiv til behandling af patienter med hyperlipidæmi? Alternativ dag versus daglig dosering af Atorvastatin-undersøgelse (ADDAS). Am Heart J. 2002; 144: 674-677.
49. Copher HR, Stewart RD. Daglig dosering kontra dosering med anden dag af simvastatin til patienter med hyperkolesterolæmi. Farmakoterapi. 2002; 22: 1110-1116.
50. Rochlani Y, Kattoor AJ, Pothineni NV, et al. Balancering af primær forebyggelse og statin-induceret diabetes mellitus-forebyggelse. Er J Cardiol. 2017; 120: 1122-1128.
51. Corrao G, Ibrahim B, Nicotra F, et al. Statiner og risikoen for diabetes: beviser fra en stor befolkningsbaseret kohortestudie. Diabetespleje. 2014; 37: 2225-2232.
52. Lim S, Oh PC, Sakuma I, Koh KK. Sådan afbalanceres kardiorenometaboliske fordele og risici ved statiner. Åreforkalkning. 2014; 235: 644-648.
53. Navarese EP, Buffon A, Andreotti F, et al. Metaanalyse af virkningen af forskellige typer og doser af statiner på nybegyndt diabetes mellitus. Er J Cardiol. 2013; 111: 1123-1130.
54. Crandall JP, Mather K, Rajpathak SN, et al. Statinbrug og risiko for at udvikle diabetes: resultater fra programmet til forebyggelse af diabetes. BMJ Open Diabetes Res Care. 2017; 5: e000438.
55. Ganda OP. Statin-induceret diabetes: forekomst, mekanismer og implikationer. F1000Res. 2016; 5.