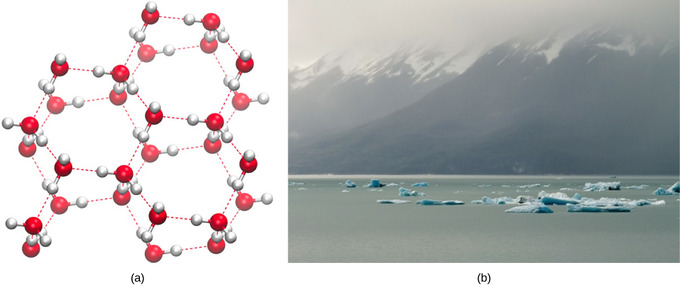
Estados del agua: gas, líquido y sólido
La formación de enlaces de hidrógeno es una cualidad importante del agua líquida que es crucial para la vida tal como la conocemos. A medida que las moléculas de agua forman enlaces de hidrógeno entre sí, el agua adquiere algunas características químicas únicas en comparación con otros líquidos, y dado que los seres vivos tienen un alto contenido de agua, comprender estas características químicas es clave para comprender la vida. En el agua líquida, los enlaces de hidrógeno se forman y se rompen constantemente a medida que las moléculas de agua se deslizan unas sobre otras. La ruptura de estos enlaces es causada por el movimiento (energía cinética) de las moléculas de agua debido al calor contenido en el sistema. Cuando se eleva el calor a medida que se hierve el agua, la mayor energía cinética de las moléculas de agua hace que los enlaces de hidrógeno se rompan por completo y permite que las moléculas de agua escapen al aire en forma de gas (vapor o vapor de agua). Por otro lado, cuando la temperatura del agua se reduce y el agua se congela, las moléculas de agua forman una estructura cristalina mantenida por enlaces de hidrógeno (no hay suficiente energía para romper los enlaces de hidrógeno). Esto hace que el hielo sea menos denso que el agua líquida, un fenómeno que no se ve en la solidificación de otros líquidos.
Fases de la materia: vea qué sucede con los enlaces intermoleculares durante los cambios de fase en este interactivo.
La menor densidad del agua en su forma sólida se debe a la forma en que se orientan los enlaces de hidrógeno a medida que se congela: las moléculas de agua se separan más en comparación con el agua líquida. Con la mayoría de los otros líquidos, la solidificación cuando baja la temperatura incluye la disminución de la energía cinética entre moléculas, lo que les permite compactarse aún más apretadamente que en forma líquida y le da al sólido una mayor densidad que al líquido.
La baja La densidad del hielo, una anomalía, hace que flote en la superficie del agua líquida, como un iceberg o los cubitos de hielo en un vaso de agua. En lagos y estanques, se forma hielo en la superficie del agua creando una barrera aislante que protege a los animales y la vida vegetal en el estanque de la congelación. Sin esta capa de hielo aislante, las plantas y los animales que viven en el estanque se congelarían en el bloque sólido de hielo y no podrían sobrevivir. El efecto perjudicial de la congelación en los organismos vivos es causado por la expansión del hielo en relación con el agua líquida. Los cristales de hielo que se forman al congelarse rompen las delicadas membranas esenciales para la función de las células vivas, dañándolas irreversiblemente. Las células solo pueden sobrevivir a la congelación si el agua que contienen se reemplaza temporalmente por otro líquido como el glicerol.