US Pharm. 2013; 38 (11) (Suplemento de oncología): 3-6.
RESUMEN: La anemia es una complicación común en pacientes con cáncer. Puede ser causado por el propio tumor o por el régimen quimioterapéutico utilizado. La gravedad y la prevalencia de la afección varían según una serie de factores. El tratamiento tiene como objetivo aumentar la capacidad de transporte de oxígeno de la sangre, reducir la fatiga y mejorar la calidad de vida general del paciente. Se han recomendado agentes estimulantes de la eritropoyesis, suplementos de hierro y transfusiones de glóbulos rojos en diferentes entornos. Si bien estos han demostrado ser beneficiosos en algunos pacientes, aún no se ha establecido la modalidad terapéutica óptima.
La anemia es una causa importante de morbilidad en pacientes con cáncer, relacionada con un rendimiento físico, pronóstico y resultado terapéutico deficientes.1 Según la Organización Mundial de la Salud ( OMS), la anemia se define como un nivel de hemoglobina (Hb) de < 12 g / dL en mujeres no embarazadas y < 13 g / dL en hombres ≥15 años.2
Epidemiología
La anemia es una de las manifestaciones más frecuentes en los pacientes con cáncer. De hecho, se ha demostrado que del 30% al 90% de todos los pacientes con cáncer son anémicos, una cifra que depende del tipo de cáncer y de la definición de anemia utilizada.3 La incidencia y la gravedad de la anemia dependen de varios factores, que se enumeran en la TABLA 1.4,5

Etiología
La principal causa de anemia en los pacientes con cáncer es doble: el cáncer en sí mismo y la terapia utilizada para el manejo del cáncer. Las células cancerosas que se infiltran en la médula ósea pueden suprimir directamente la hematopoyesis y causar anemia. Además, las células cancerosas liberan citocinas que pueden conducir al secuestro de hierro, lo que reduce la producción de glóbulos rojos (RBC). Los tumores pueden provocar una pérdida crónica de sangre del sitio del tumor, lo que lleva a una anemia progresiva por el cáncer y daño a los órganos.6
Este problema se ve agravado por pérdidas de sangre, deficiencias nutricionales, hemólisis, trastornos endocrinos, enfermedades hereditarias, insuficiencia renal o insuficiencia renal. la presencia de citocinas inflamatorias asociadas con cánceres y enfermedades crónicas.4,6 Los pacientes con cáncer tienden a perder el apetito, lo que lleva a deficiencias nutricionales. En pacientes con tumores gastrointestinales (GI), la malabsorción de nutrientes también conduce a deficiencias. La hemólisis es el resultado de anticuerpos inmunomediados o cambios en la capacidad de coagulación. Como resultado, la anemia es una comorbilidad común en pacientes recientemente diagnosticados con cáncer. Casi la mitad de las pacientes diagnosticadas con cáncer ginecológico y una tercera parte de las pacientes diagnosticadas con linfoma no Hodgkin tienen anemia en el momento del diagnóstico.
Además, la mielosupresión es uno de los efectos secundarios de la quimioterapia y un factor que contribuye significativamente a la anemia. . La radioterapia en el esqueleto en particular también causa toxicidad hematológica y por lo tanto anemia.6
Síntomas
Los síntomas más comunes de anemia son fatiga, disnea de esfuerzo, palpitaciones, depresión, insuficiencia cardíaca, deterioro cognitivo. función, mareos e insuficiencia cardíaca.7,8
Diagnóstico
La magnitud del problema de la anemia en los pacientes con cáncer se amplifica por las medidas de diagnóstico subóptimas, la falta de una definición estándar y la El hecho de que la causa es a menudo multifactorial.6,9 Se debe tomar una historia detallada que registre la duración y el tiempo hasta el inicio de los síntomas, la presencia de condiciones comórbidas, los antecedentes familiares y los antecedentes de exposición a fármacos antineoplásicos y radiación. Se debe realizar un examen físico para detectar síncope, disnea de ejercicio, dolor de cabeza, vértigo, dolor en el pecho, fatiga, menstruación anormal en mujeres y palidez.6
La National Cancer Comprehensive Network recomienda que se realice aCBC en pacientes con una Hb < 11 g / dL o una reducción en el recuento de Hb de 2 g / dL. Esto es útil para determinar si hay citopenias. También se recomienda una revisión visual del frotis de sangre periférica para confirmar el tamaño, la forma y el color de los glóbulos rojos.6
Fisiopatología
La anemia es el resultado de una combinación de disminución de los eritrocitos circulantes , reducción del volumen de células empaquetadas y reducción de los niveles de Hb.6 Esto puede ocurrir a través de varios mecanismos fisiopatológicos que incluyen pérdida excesiva de sangre, aumento de la destrucción de glóbulos rojos y disminución de la eritropoyesis.
Eritropoyetina (EPO), vitamina B12, ácido fólico y el hierro es esencial para la eritropoyesis. La eritropoyetina controla la maduración, diferenciación y supervivencia de las células eritroides durante este proceso.10 La EPO es producida principalmente por los riñones y transportada a la médula ósea.11
El metabolismo anormal del hierro o la retención de hierro en los macrófagos reduce la cantidad de hierro que está disponible para la eritropoyesis.El metabolismo alterado del hierro es causado principalmente por la hepcidina, una proteína que disminuye la absorción de hierro en el intestino, así como la liberación de hierro por los macrófagos. La producción de hepcidina aumenta por las citocinas liberadas por los tumores, lo que disminuye la cantidad de hierro circulante. También se ha demostrado que la producción de citocinas como la interleucina (IL) -6 aumenta con ciertos regímenes quimioterapéuticos.5 Los ciclos repetidos de quimioterapia pueden empeorar la reducción de la eritropoyesis acumulativamente.7
A medida que disminuye el suministro de oxígeno, Las células de los tejidos del cuerpo se vuelven hipóxicas, lo que da como resultado una serie de respuestas fisiológicas a medida que el cuerpo intenta ganar o mantener la oxigenación del tejido.
Se cree que la utilización normal de hierro en pacientes con cáncer puede verse interrumpida por una interacción entre las células tumorales y el propio sistema inmunológico del huésped. Esta interacción conduce a la sobrerregulación de citocinas inflamatorias específicas como IL-1, gammainterferón y factor de necrosis tumoral alfa (TNF-α), que disminuyen la diferenciación de precursores eritroides en la médula ósea, interfieren con la utilización normal de hierro e inhiben la hipoxia normal. producción de driveneritropoyetina. Los agentes quimioterapéuticos nefrotóxicos pueden empeorar el problema al causar insuficiencia renal.
En la anemia crónica, se ha demostrado que los tumores liberan un factor inductor de ananemia, una molécula que reduce la vida útil de los eritrocitos. Esto agrava la anemia hasta el punto en que la eritropoyesis no puede compensar la supervivencia inferior de los glóbulos rojos.12
Factores de riesgo de anemia en el cáncer
Se han identificado los siguientes factores de riesgo de anemia en el cáncer9:
- Quimioterapia mielosupresora o radioterapia
- Niveles bajos de Hb (10-12 g / dL) al inicio de la quimioterapia citotóxica
- Administración de platino- que contienen regímenes, lo que también aumenta la necesidad de apoyo transfusional.
Tratamiento
Además de una mejora general en la calidad de vida del paciente, el tratamiento de la anemia es esencial para varios La anemia compromete el suministro de cantidades suficientes de oxígeno a todas las células, incluidas las células tumorales.7 Dado que la baja oxigenación tisular se asocia con una sensibilidad reducida de los tumores a la radiación y otras formas de quimioterapia, la eficacia de estos tratamientos se reduce en la anemia.13,14
El objetivo de la terapia debe ser aumentar el transporte de oxígeno g capacidad de la sangre y tratar la causa subyacente.Las condiciones subyacentes, como las deficiencias nutricionales, son más fáciles de tratar que otras, como la pérdida de sangre oculta. Hay varias opciones disponibles para el tratamiento de pacientes con cáncer y anemia. Estos incluyen15:
- Terapia suplementaria adecuada con ácido fólico y / o vitamina B12 para corregir las deficiencias nutricionales
- Agentes estimulantes de la eritropoyesis (AEE)
- Suplementos de hierro
- Transfusiones de sangre, que están indicadas para pacientes con pérdida de sangre aguda grave. Para los pacientes cuya anemia es crónica, se prefieren los agentes eritropoyéticos.
Agentes estimulantes de la eritropoyesis: AEE, incluida la eritropoyetina alfa humana recombinante (rHuEPO; Procrit, Epogen) y la darbepoetina alfa (Aranesp), se desarrollado tradicionalmente para el tratamiento de la anemia en pacientes con insuficiencia renal crónica. Han demostrado una eficacia y limitaciones similares cuando se utilizan dosis incomparables en pacientes con cáncer y anemia.5 Los AEE están indicados para el tratamiento de pacientes cuyos niveles de EPO endógena son anormalmente bajos, ya que el modo de acción de los AEE y los efectos inmunológicos y hematológicos son similares a los de la EPO endógena.9Estudios realizados con rHuEPO han demostrado que mejora los niveles de H y la calidad de vida de los pacientes y disminuye las necesidades de transfusión.15,16 Se ha propuesto que los AEE también mejoran la función cognitiva de los pacientes que reciben quimioterapia.17
Una revisión sistémica realizado por la Sociedad Estadounidense del Cáncer demostró que el beneficio clínico óptimo del tratamiento eritropoyético de la anemia inducida por quimioterapia se puede lograr mediante una intervención temprana.18 Es evidente que el uso de AEE tiene un beneficio; sin embargo, todas las demás causas de anemia deben investigarse y corregirse antes del uso de la terapia con ESA.
Tanto la darbepoetina como la rHuEPO están indicadas para el tratamiento de la anemia en pacientes con neoplasias no mieloides en quienes la anemia está relacionada con la quimioterapia. La Sociedad Estadounidense de Hematología (ASH) y la Sociedad Estadounidense de Oncología Clínica (ASCO) recomiendan que el tratamiento se inicie cuando los niveles de Hb caigan por debajo de 10 g / dL y que la dosis se reduzca si hay un aumento mínimo de 1 g / dL en los niveles de H en 2 semanas.19 El objetivo de la terapia debe ser elevar la Hb a la concentración más baja para evitar la transfusión. Si no se logra el aumento mínimo de 1 a 2 g / dl de Hb después de 6 a 8 semanas de tratamiento, se debe interrumpir el tratamiento con AEE.18 Si bien es difícil predecir la respuesta del paciente a estas terapias con los datos actuales, se ha demostrado que aproximadamente del 50% al 60% de los pacientes muestran un aumento de 2 g / dL en la Hb cuando se tratan con rHuEPO.9 La terapia con AEE debe suspenderse una vez finalizado el tratamiento. el curso de quimioterapia.20,21
La dosis recomendada de darbepoetin alfa es de 2,25 mcg / kgas por inyección subcutánea (SC) semanal. Si los niveles de Hb no aumentan en al menos 1 g / dL después de 6 semanas, la dosis debe aumentarse a 4,5 mcg / kg. Si los niveles de Hb aumentan más de 1 g / dL en un período de 2 semanas o si la Hb excede los 12 g / dL, la dosis de darbepoetina debe reducirse en un 40% .20 La darbepoetina debe suspenderse si los niveles de Hb superan los 13 g / dL. 9
La dosis recomendada de rHuEPO es 40.000 U administradas SC una vez a la semana o 150 U / kg administradas SC tres veces a la semana en pacientes cuyos niveles de Hb están por debajo de 10 g / dL. La dosis de rHuEPO debe reducirse en un 25% si el nivel de Hb aumenta > 1 g / dL en cualquier período de 2 semanas o alcanza un nivel necesario para evitar la transfusión de glóbulos rojos.21
Los AEE se envasan en un vial que no debe agitarse, ya que se desnaturalizan.20,21 El contenido del vial no debe diluirse ni mezclarse.
Los riesgos de la terapia con AEE también deben reducirse. tomado en consideración. Se cree que los AEE aumentan los eventos cardiovasculares adversos, aumentan el riesgo de tromboembolismo venoso, acortan el tiempo de progresión del tumor y reducen la supervivencia en pacientes con cáncer anémico a través de diferentes mecanismos22,23. Por esta razón, se desaconseja el uso de AEE en pacientes con cáncer que no se someten a tratamiento. tratamiento con quimioterapia o radioterapia.24 Todos los AEE vienen con una caja negra de advertencia sobre el aumento del riesgo de muerte, infarto de miocardio, accidente cerebrovascular, tromboembolismo venoso, trombosis del acceso vascular y progresión y recurrencia del tumor.20,21 El Programa de Oncología APPRISE de la ESA ha sido creado por la FDA para aconsejar a los pacientes, cuidadores y profesionales sanitarios sobre el uso seguro de los ESA.25
Suplementación de hierro: la suplementación de hierro, preferiblemente por vía parenteral, está indicada en pacientes con niveles bajos de offerritina (< 30 ng / mL), saturación de transferrina (TSAT < 15%) y baja (< 26 pg / celda ) contenido de Hb de reticulocitos t (CHr). Se han reconocido dos tipos de deficiencia de hierro en pacientes con cáncer anémico:
- Deficiencia absoluta de hierro (AID) que ocurre con hemorragia crónica debido, por ejemplo, a lesiones gastrointestinales o ginecológicas, pérdida de sangre por cirugía, deficiencias y anemia de enfermedades crónicas (ACD). Se define como un nivel de ferritina sérica de < 30 mcg / L y una disminución de TSAT de < 15% .1
- Deficiencia funcional de hierro (FID) que surge después del uso continuo de eritropoyetina. Es la causa más común de una respuesta inadecuada a la terapia con AEE, particularmente en pacientes con insuficiencia renal. Por lo tanto, la mayoría de los pacientes que reciben terapia con AEE eventualmente requerirán suplementos de hierro.6
Los suplementos de hierro se introdujeron cuando el tratamiento con AEE por sí solo demostró tasas de respuesta bajas en pacientes tratados con quimioterapia.1 La eficacia de una combinación de IV Se probó la terapia con hierro y AEE y se estableció el papel del hierro en la deficiencia funcional de hierro.1 Si bien la evidencia actual respalda el uso de suplementos de hierro por vía intravenosa para mejorar las respuestas de hemoglobina en pacientes anémicos con cáncer, se necesitan estudios prospectivos sobre la eficacia y seguridad a largo plazo del hierro por vía intravenosa Además, es necesario establecer regímenes de dosificación óptimos.5
El hierro se puede administrar por vía oral o como formulaciones parenterales de hierro dextrano de bajo peso molecular (LMW), ferricgluconato y hierro sacarosa. El hierro administrado por vía parenteral tiene una respuesta superior en comparación con el hierro oral.6 Por lo tanto, este último se usa raramente en pacientes con cáncer con anemia y no se analiza en este artículo. Se recomiendan dosis de prueba para el hierro dextrano. Los pacientes que han mostrado sensibilidades previas al hierro dextrano u otras preparaciones de hierro por vía intravenosa o aquellos que tienen alergias a múltiples fármacos también deben recibir una dosis de prueba. La TABLA 2 muestra el régimen de dosificación para los suplementos de hierro por vía intravenosa.6
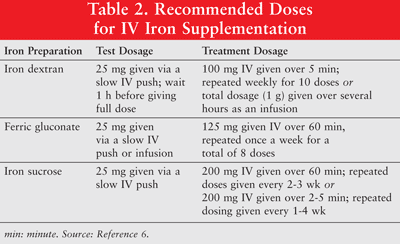
El hierro parenteral se asocia con hipotensión, náuseas, vómitos y / o diarrea, dolor, hipertensión, disnea, prurito, dolor de cabeza y mareos. Además, puede ser inconveniente y costoso administrarlo.9 Dado que el hierro dextrano de alto peso molecular (HMW) está asociado con una mayor incidencia de eventos adversos que el hierro dextrano de BPM, este último es el preferido en general.6
Rojo Transfusión de células sanguíneas: los glóbulos rojos son el producto sanguíneo preferido para transfusiones para corregir la anemia en casos de anemia aguda después de una hemorragia. Ciertos pacientes pueden requerir una perfusión negativa para citomegalovirus.El objetivo de utilizar una transfusión de glóbulos rojos es tratar o prevenir una deficiencia en la capacidad de transporte de oxígeno de la sangre, y la transfusión no suele estar indicada si el nivel de H del paciente es ≥10 g / dl.6
Las transfusiones de glóbulos rojos ofrecen la ventaja de un rápido aumento de los niveles de Hb y hematocrito inmediatamente después de la infusión. Se estima que una transfusión de 300 ml (1 unidad) de glóbulos rojos puros dará como resultado un aumento promedio de 1 g / dL de Hb o 3% del hematocrito en un adulto normal que no experimente pérdida de sangre simultánea. Esto conduce a una rápida mejora general de la fatiga.6
La sangre del paciente debe ser comparada para la compatibilidad ABO antes de que los glóbulos rojos puedan ser transfundidos. Si el paciente requiere infusiones repetidas, el riesgo de reacciones adversas se puede minimizar mediante el uso de sangre reductora de leucocitos y premedicación con anantihistamina o acetaminofeno.6
La transfusión de glóbulos rojos no está exenta de riesgos, incluido el potencial de infecciones transmitidas por transfusión. agentes, reacciones transfusionales, aloinmunización e inmunosupresión.9 Otros riesgos de la transfusión incluyen insuficiencia cardíaca congestiva, aumento de eventos trombóticos y sobrecarga de hierro.6 Sin embargo, es útil señalar que los pacientes que requieren infusiones de glóbulos rojos durante el período correspondiente al tratamiento de quimioterapia solo tienen muy poca experimentar sobrecarga de hierro.6
Perspectivas futuras
Actualmente se están siguiendo nuevas estrategias para controlar la anemia en pacientes con cáncer. Si bien no existe un sustituto para la sangre humana, los investigadores están en el proceso de desarrollar productos que tienen la capacidad de transportar oxígeno de los glóbulos rojos. En la tubería están los portadores de oxígeno a base de Hb y los perfluorocarbonos.5
Conclusión
En general, aún no se ha establecido el enfoque óptimo para la anemia como un tema importante en oncología. La falta de coherencia entre los proveedores de atención médica, una definición clara de anemia en el cáncer y los criterios de diagnóstico contribuyen a este problema.
1. Steinmetz HT. El papel del hierro intravenoso en el tratamiento de la anemia en pacientes con cáncer. Ther Adv Hematol. 2012; 3: 177-191.
2. deBenoist B, McLean E, Egli I, et al. Prevalencia mundial de la anemia 1993–2005: Base de datos mundial de la OMS sobre anemia. Ginebra, Suiza: Organización Mundial de la Salud; 2008.
3. Knight K, Wade S, Balducci L. Prevalencia y resultados de la anemia en el cáncer: una revisión sistemática de la literatura. Am J Med. 2004; 116 (supl. 7A): 11S-26S.
4. Schwartz RN. Anemia en pacientes con cáncer: incidencia, causas, impacto, manejo y uso de guías y protocolos de tratamiento. Soy J Health Syst Pharm. 2007; 64 (3 supl 2): S5-S13; quiz S28-S30.
5. Calabrich A, Katz A. Manejo de la anemia en pacientes con cáncer. Future Oncol. 2011; 7: 507-517.
6. Rodgers GM, Becker P, Blinder M, et al. Anemia inducida por cáncer y quimioterapia. J Natl Compr Canc Netw. 2012; 10: 628-653.
7. Groopman JE, Itri LM. Anemia inducida por quimioterapia en adultos: incidencia y tratamiento. J Natl Cancer Inst. 1999; 91: 1616-1634.
8. Ludwig H, Strasser K. Sintomatología de la anemia. Semin Oncol. 2001; 28: 7-14.
9. Gillespie TW. Anemia en cáncer. Enfermería oncológica. 2003; 26: 119-128.
10. Koeller JM. Guías clínicas para el tratamiento de la anemia relacionada con el cáncer. Farmacoterapia. 1998; 18: 156-169.
11. Cazzola M, Mercuriali F, Brugnara C. Uso de eritropoyetina humana recombinante fuera del contexto de la uremia. Sangre. 1997; 89: 424-867.
12. Nowrousian MR, Kasper C, Oberhoff C, et al. Patofisiología de la anemia relacionada con el cáncer. En: Smith JF, Boogaerts MA, Ehmer B, eds. Eritropoyetina en el tratamiento de apoyo al cáncer. Nueva York, NY: Marcel Dekker; 1997: 13-34.
13. Vaupel P, Dunst J, Engert A y col. Efectos de la eritropoyetina humana recombinante (rHuEPO) sobre el control tumoral en pacientes con anemia inducida por cáncer. Onkologie. 2005; 28: 216-221.
14. Zhao KL, Liu G, Jiang GL y col. Asociación del nivel de hemoglobina con la morbilidad y mortalidad de pacientes con carcinoma de esófago avanzado localmente sometidos a radioterapia: un análisis secundario de tres ensayos clínicos de fase III consecutivos. Clin Oncol (R Coll Radiol). 2006; 18: 621-627.
15. Glaspy JA. El desarrollo de agentes eritropoyéticos en oncología. Opinión de expertos Emerg Drugs. 2005; 10: 553-567.
16. Adamson JW, Spivak JL. Base fisiológica para el uso farmacológico de eritropoyetina humana recombinante en cirugía y tratamiento del cáncer. Cirugía. 1994; 115: 7-15.
17. Ferrario E, Ferrari L, Bidoli P, et al. Tratamiento de la anemia relacionada con el cáncer con epoetina alfa: una revisión. Cancer Treat Rev.2004; 30: 563-575.
18. Lyman GH, Glaspy J. ¿Existen beneficios clínicos con la intervención eritropoyética temprana para la anemia inducida por quimioterapia? Revisión asistemática. Cáncer. 2006; 106: 223-233.
19. Rizzo JD, Brouwers M, Hurley P, et al. Actualización de la guía de práctica clínica de la Sociedad Estadounidense de Oncología Clínica / Sociedad Estadounidense de Hematología sobre el uso de epoetina y darbepoetina en pacientes adultos con cáncer. J Clin Oncol. 2010; 28: 4996-5010.
20. Información de prescripción de Aranesp (darbepoetin alfa).Thousand Oaks, CA: Amgen Inc; Mayo de 2012.
21. Información de prescripción de Procrit (epoetin alfa). Horsham, PA: Janssen Products, LP; Julio de 2012.
22. Beutel G, Ganser A. Riesgos y beneficios de los agentes estimulantes de la eritropoyesis en el tratamiento del cáncer. Semin Hematol. 2007; 44: 157-165.
23. Fenner MH, Ganser A. Eritropoyetina en la anemia relacionada con el cáncer. Curr Opin Oncol. 2008; 20: 685-689.
24. Smith RE Jr, Aapro MS, Ludwig H, et al. Darbepoetinalfa para el tratamiento de la anemia en pacientes con cáncer activo que no reciben quimioterapia ni radioterapia: resultados de un estudio de fase III, multicéntrico, aleatorizado, doble ciego y controlado con placebo. J Clin Oncol. 2008; 26: 1040-1050.
25. Programa de Oncología ESA APPRISE. Productos Amgen y Janssen, LP. www.esa-apprise.com. Consultado el 13 de octubre de 2013.