- La presencia de altas concentraciones de anticuerpos (título > 1: 640) debe hacer sospechar que un trastorno autoinmune es regalo. En este escenario, recomiendo que se analicen los sueros para detectar anticuerpos contra dsDNA, Sm, RNP, Ro (SS-A), La (SS-B) y quizás Scl-70. La presencia de anticuerpos contra cualquiera de estos aumenta en gran medida la probabilidad de que el paciente tenga LES, MCTD, Sjögren o esclerodermia. Algunos laboratorios analizarán automáticamente estos anticuerpos siempre que el análisis de ANA sea positivo. Sin embargo, la presencia de estos anticuerpos no es un diagnóstico de enfermedad. Si no se puede hacer un diagnóstico inicial, es mi práctica observar al paciente cuidadosamente a lo largo del tiempo para detectar el desarrollo de una enfermedad asociada con los ANA y ver al paciente al menos dos veces al año.
- La combinación de títulos bajos de anticuerpos (< 1:80) y pocos o ningún signo o síntoma de enfermedad presagia una probabilidad mucho menor de una enfermedad autoinmune. Como resultado, estos pacientes con títulos bajos de ANA necesitan ser reevaluados con menos frecuencia, anualmente, a menos que los síntomas clínicos evolucionen para sugerir una enfermedad autoinmune.
- Es muy poco probable que un paciente con un ANA negativo tenga LES, MCTD , Sjögren o esclerodermia. Sin embargo, si todavía hay una fuerte evidencia clínica de un trastorno autoinmune sistémico, se pueden realizar pruebas de anticuerpos específicos contra el ADN bicatenario (ds), Sm, RNP, Ro, La o Scl-70, aunque, en mi experiencia, suelen ser negativos. Sin embargo, es prudente ver a estos pacientes en los que existe un alto índice clínico de sospecha, al menos una vez al año, aunque con mayor frecuencia si está clínicamente indicado.
- Los anticuerpos antinucleares producen una amplia gama de patrones de tinción (homogéneos, difusos , periférico, borde, moteado, nucleolar, anticentrómero, etc.). Se ha reconocido que el patrón de tinción nuclear tiene una sensibilidad y especificidad relativamente bajas para diferentes trastornos autoinmunes. La presencia de anticuerpos dirigidos a antígenos nucleares específicos suele ser más útil. (Estos anticuerpos incluyen los siguientes: dsDNA, Sm, RNP, Ro, La o Scl-70.)
Durante los últimos años, los investigadores y las empresas de biotecnología han estado desarrollando inmunoensayos para reemplazar la prueba IF ANA.4-23 El fundamento de este intento se relaciona con las características de rendimiento de la técnica IF. Esta prueba requiere mucha mano de obra y está sujeta a variaciones debido a las diferentes interpretaciones de los técnicos. También complica la prueba el desvanecimiento de la imagen cuando se examina en un microscopio fluorescente. Además, la técnica IF utiliza diluciones en serie de sueros de pacientes, lo que dará resultados que pueden no ser lineales. Las variaciones en el título en dos veces son comunes en las pruebas diarias en la misma muestra; Se dice que las diferencias de cuatro veces son «significativas». Por el contrario, los inmunoensayos en fase sólida están automatizados y son altamente reproducibles. Los resultados son lineales y la técnica requiere menos mano de obra y, por lo tanto, es más barata de realizar.
Debido a estas consideraciones, debería haber ahorros económicos en empleando un inmunoensayo de fase sólida para cuantificar un ANA. Por lo tanto, en un intento de desarrollar inmunoensayos de ANA en fase sólida, varios grupos han puesto en la fase sólida los antígenos que se analizan normalmente en los inmunoensayos de ANA más específicos (por ejemplo, ADN, Sm, RNP, Ro / SSA, La / SSB, nucleoproteína, extractos de células, etc.). En informes publicados, el coeficiente de correlación entre los títulos de ANA y estos ensayos en fase sólida es bastante bueno. Por lo tanto, muchas empresas comerciales han cambiado sus ANA a estos inmunoensayos en fase sólida.4-23 Sin embargo, es preocupante la alta frecuencia / porcentaje de resultados falsos negativos en pacientes con LES conocido y enfermedades relacionadas, así como la alta frecuencia continua de «falsos positivos» (p. ej., un ANA positivo en alguien sin LES) en estos estudios.15-21 Se necesita más trabajo para mejorar la sensibilidad y especialmente la especificidad de estos inmunoensayos en fase sólida para garantizar que los pacientes con LES y enfermedades relacionadas no se pierdan en estos inmunoensayos en fase sólida.
Anticuerpos contra el ADN
Los anticuerpos contra el ADN se pueden dividir principalmente en los que reaccionan con el ADN monocatenario (ss) y los que reconocen el ADN bicatenario.24-26
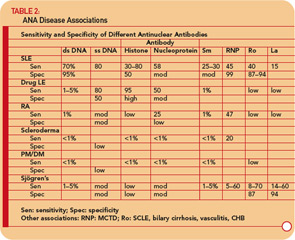
Anti- Se han informado anticuerpos de ssDNA en LES, artritis reumatoide, lupus relacionado con fármacos, familiares sanos de pacientes con LES y, con menor frecuencia, en otras enfermedades reumáticas. (Véase la Tabla 2, pág. 17.) Por tanto, el anti-ssDNA tiene una utilidad limitada para el diagnóstico de LES u otras enfermedades reumáticas. El anti-ssDNA no se correlaciona bien con la actividad de la enfermedad y, por lo tanto, no es útil para el manejo de enfermedades.
Los anticuerpos contra el dsDNA se detectan con mayor frecuencia mediante inmunoensayos en fase sólida, pero también en algunos laboratorios mediante el ensayo de crithidia IF o ocasionalmente el radioinmunoensayo de Farr.La mayoría de los laboratorios hospitalarios y comerciales hacen solo uno. El ensayo de Farr probablemente tiene la mayor especificidad y la menor sensibilidad de los tres ensayos para el diagnóstico de LES, mientras que los ensayos de fase sólida tienen la mayor sensibilidad y la menor especificidad; el ensayo de critidios se encuentra en el medio. El ensayo de Farr también tiene la desventaja de utilizar material radiactivo, que la mayoría de los laboratorios evitan, y la prueba de critidios requiere mucha mano de obra. Prefiero el ensayo ELISA para el uso diario.
Los anti-dsDNA son específicos (95%) aunque no muy sensibles (70%) para el LES, lo que los hace muy útiles para el diagnóstico cuando son positivos.9 (Ver Tabla 2 , p. 17.) Ocasionalmente se encuentran en otras afecciones, como artritis reumatoide, artritis juvenil, lupus inducido por fármacos, hepatitis autoinmune e incluso en personas normales.
Los títulos de anticuerpos anti-dsDNA a menudo fluctúan con actividad de la enfermedad, especialmente nefritis lúpica, y por lo tanto son útiles en muchos pacientes para seguir el curso del LES. Si un paciente tiene un título en aumento, o un título muy alto, pero clínicamente está inactivo, no trato la anomalía serológica, pero lo considero una señal de advertencia de que el paciente debe ser seguido más de cerca y tratado cuando algo sucede clínicamente para justificar una cambio de terapia. Sin embargo, algunos investigadores han tratado estas anomalías serológicas (especialmente cuando se asocian con niveles bajos de complemento) y han informado mejores resultados clínicos. Por el contrario, utilizo un título descendente en alguien que mejora después de un brote durante el tratamiento como guía para reducir el tratamiento (p. Ej., Corticosteroides y / o inmunosupresores).
La asociación entre anticuerpos anti-dsDNA y otros Las manifestaciones de la enfermedad del LES son mucho menos claras. Por ejemplo, no existe una relación entre el título de anti-dsDNA y la actividad de la enfermedad del LES neuropsiquiátrico.
Distinguir las manifestaciones de lupus activo de las complicaciones infecciosas o los efectos tóxicos de los fármacos, y de enfermedades no relacionadas, es siempre un desafío. La presencia de anticuerpos anti-dsDNA puede ser útil en algunos pacientes para hacer esta distinción.
Anticuerpos anti-Smith y anti-ribonucleoproteína
Anticuerpos contra Smith (Sm) y anti-ribonucleoproteína (anti-RNP) se detectan con mayor frecuencia mediante inmunoensayos en fase sólida.24,27
Los anticuerpos anti-Sm se encuentran solo en el 10% al 40% de los pacientes con LES, pero son muy poco frecuentes en pacientes con otras condiciones (es decir, no son sensibles pero son muy específicas). La medición de los títulos anti-Sm puede ser útil para el diagnóstico, particularmente en un momento en que los anticuerpos anti-ADN son indetectables. Sin embargo, dada la sensibilidad relativamente baja de anti-Sm, un valor negativo no excluye de ninguna manera el diagnóstico de LES.
Los anticuerpos anti-RNP se encuentran en alrededor del 40% al 60% de los pacientes con LES, pero no son específicos para LES, siendo una característica definitoria de MCTD. Estos anticuerpos también pueden presentarse en títulos bajos y frecuencias bajas en otras enfermedades reumáticas, incluida la AR y la esclerodermia. (Ver Tabla 2, p. 17.)
Ni el título (niveles) de anticuerpos anti-Sm ni anti-RNP se correlacionan con ninguna actividad clínica.
Anti-Ro / SSA y anticuerpos anti-La / SSB
Los anticuerpos contra Ro / SSA y La / SSB se detectan con mayor frecuencia mediante inmunoensayos en fase sólida.28,29 Se han detectado anti-Ro / SSA y anti-La / SSB con alta frecuencia en pacientes con síndrome de Sjögren y en LES, pero también en pacientes con dermatitis fotosensible, y en 0.1% a 0.5% de adultos sanos.
Los anticuerpos anti-Ro / SSA se encuentran en aproximadamente 50% de pacientes con LES. (Ver Tabla 2, pág. 17.) Se han asociado con fotosensibilidad, lupus cutáneo subagudo, vasculitis cutánea (púrpura palpable), enfermedad pulmonar intersticial, lupus neonatal y bloqueo cardíaco congénito. Los anticuerpos anti-Ro / SSA se encuentran en aproximadamente el 75% de los pacientes con síndrome de Sjögren primario (ver Tabla 2, p. 17), y los títulos altos de estos anticuerpos se asocian con una mayor incidencia de características extraglandulares, especialmente púrpura y vasculitis. Por el contrario, los anticuerpos Ro / SSA están presentes sólo en el 10% al 15% de los pacientes con síndrome de Sjögren secundario asociado con artritis reumatoide. Por lo tanto, la presencia de anticuerpos Ro / SSA o anti-La / SSB en pacientes con sospecha de síndrome de Sjögren primario apoya fuertemente el diagnóstico.
Aproximadamente el 50% de los pacientes con LES que tienen anticuerpos anti-Ro también tienen -La anticuerpo, un antígeno de proteína ARN estrechamente relacionado. De manera similar, la mayoría de los pacientes con síndrome de Sjögren también tienen anticuerpos anti-La (SSB). Es extremadamente raro encontrar pacientes con anticuerpos anti-La sin anticuerpos anti-Ro.
En mi opinión, las indicaciones para solicitar una prueba de anticuerpos anti-Ro / SSA y anti-La / SSB son las siguientes:
- Mujeres con LES que estén embarazadas o puede quedar embarazada en el futuro;
- Mujeres que tienen antecedentes de haber dado a luz a un niño con bloqueo cardíaco o miocarditis;
- Pacientes con antecedentes de erupciones cutáneas fotosensibles inexplicables;
- Pacientes fuertemente sospechosos de tener LES pero que tienen una prueba ANA negativa; o
- Pacientes con síntomas de xerostomía, queratoconjuntivitis seca y / o agrandamiento de las glándulas salivales y lagrimales.
Anticuerpos antiribosomales de la proteína P
Anti- Se han detectado anticuerpos contra la proteína P ribosómica en el 10% al 20% de los pacientes con LES en los Estados Unidos y entre el 40% y el 50% de los pacientes asiáticos con LES, pero raramente en otras enfermedades reumáticas.30 Los anticuerpos anti-proteína P ribosómica pueden ser altamente específico para la psicosis asociada al lupus, aunque no todos los estudios lo han confirmado. La depresión y la afectación renal y hepática en pacientes con lupus también se han asociado con anticuerpos anti-proteína P ribosomal en algunos estudios pequeños.
Debido a la baja sensibilidad y la mala correlación clínica, muchos investigadores, incluido yo mismo, ver poca utilidad clínica en esta prueba.
Anticuerpos anti-centrómero
Los anticuerpos anti-centrómero (ACA) se encuentran casi exclusivamente en pacientes con esclerosis sistémica cutánea limitada (lcSSc) especialmente en aquellos con CREST.31 Se han observado ACA en el 57% de los pacientes con CREST, pero también se han observado en pacientes con otras afecciones, incluidos algunos pacientes con el fenómeno de Raynaud solo. Los ACA se detectan típicamente mediante el patrón IF característico en las células Hep-2.
Anticuerpos anti-Scl-70 (topoisomerasa-1)
Aproximadamente del 15% al 20% de los pacientes con esclerodermia tienen anticuerpos contra una proteína de 70 kD (topoisomerasa-1), posteriormente denominada Scl-70.31 El método habitual de detección es por ELISA. La presencia de estos anticuerpos parece aumentar el riesgo de fibrosis pulmonar entre los pacientes con esclerodermia y es bastante específica para la enfermedad.
Resumen
Si uno sospecha de LES basado en la historia, examen físico examen y hemograma completo (p. ej., leucopenia, trombocitopenia), solicite una prueba de ANA. Si es negativo, es muy poco probable que el paciente tenga LES y se puede tranquilizar al paciente. Si el título es < 1: 160, el LES es poco probable y se puede asegurar al paciente que el LES es poco probable, pero se debe realizar un seguimiento periódico del paciente. Un título de ≥1: 160 aumenta la probabilidad de LES y trastornos relacionados. Sin embargo, es importante recordar que el 85% de las personas con ANA positivo no tienen LES. Si el ANA es positivo, también se deben realizar pruebas de anticuerpos contra dsDNA, Sm, RNP, Ro / SSA y La / SSB. La presencia de estos anticuerpos aumenta en gran medida la probabilidad de que el paciente tenga LES y trastornos relacionados (ver Tabla 2, pág. 17), y es necesario seguir más de cerca al paciente. La detección de anticuerpos anti-centrómero y anti-Scl-70 es muy útil para el diagnóstico de esclerodermia. La detección de anticuerpos contra Ro / SSA y La / SSB también son útiles para el diagnóstico del síndrome de Sjögren.
La única de estas pruebas que es útil para monitorear la actividad es el anti-dsDNA.
Agradecimiento: Estoy en deuda con el trabajo de muchos autores de UpToDate in Medicine, cuyo trabajo proporcionó un marco útil para el desarrollo de este artículo, así como con los Dres. Robert Shmerling, David Lee y Donald Bloch, con quienes he escrito artículos y capítulos sobre este mismo tema.
Dr. Schur es profesor de medicina en la Facultad de Medicina de Harvard y la división de reumatología, inmunología y alergia en el departamento de medicina del Brigham and Women’s Hospital en Boston.
- Reichlin M. Medición e importancia clínica de anticuerpos antinucleares. A hoy. Octubre de 2008.
- Comité ad hoc sobre pruebas inmunológicas del American College of Rheumatology. Directrices para las pruebas de laboratorio inmunológico en las enfermedades reumáticas: una introducción. Arthritis Rheum. 2002; 47: 429-433.
- Solomon DH, Kavanaugh AJ, Schur PH, et al. Directrices basadas en evidencia para el uso de pruebas inmunológicas: Prueba de anticuerpos antinucleares. Arthritis Rheum. 2002; 47: 434-444.
- Sinclair D, Saas M, Williams D, Hart M, Goswami R. ¿Puede un ELISA reemplazar la inmunofluorescencia para la detección de anticuerpos antinucleares? —El uso rutinario de anti – ELISA de detección de anticuerpos nucleares. Clin Lab. 2007; 53: 183-191.
- Avaniss-Aghajani E, Berzon S, Sarkissian A. Valor clínico de los inmunoensayos basados en perlas multiplexadas para la detección de autoanticuerpos contra antígenos nucleares. Clin Vaccine Immunol. 2007; 14: 505-509.
- Copple SS, Martins TB, Masterson C, Joly E, Hill HR. Comparación de tres inmunoensayos multiplex para la detección de anticuerpos contra anticuerpos nucleares extraíbles utilizando sueros clínicamente definidos. Ann N Y Acad Sci.2007; 1109: 464-472.
- Caramaschi P, Ruzzenente O, Pieropan S, et al. Determinación de la especificidad de ANA mediante inmunoensayo de microesferas fluorescentes multiplexadas en pacientes con positividad de ANA en títulos altos después del tratamiento con infliximab: resultados preliminares. Rheumatol Int. 2007; 27: 649-654.
- Biagini RE, Parks CG, Smith JP, Sammons DL, Robertson SA. Rendimiento analítico del ensayo AtheNA MultiLyte ANA II en sueros de pacientes con lupus con múltiples ANA positivos. Anal Bioanal Chem. 2007; 388: 613-618.
- González C, García-Berrocal B, Pérez M, et al. Cribado de laboratorio de enfermedades del tejido conectivo mediante un nuevo ensayo de cribado ENA automatizado (EliA Symphony) en pacientes clínicamente definidos. Clin Chim Acta. 2005; 359: 109-114.
- Eissfeller P, Sticherling M, Scholz D, et al. Comparación de diferentes sistemas de prueba para la detección simultánea de autoanticuerpos en enfermedades del tejido conectivo. Ann N Y Acad Sci. 2005; 1050: 327-339.
- Smith J, Onley D, Garey C, et al. Determinación de la especificidad de ANA utilizando la plataforma UltraPlex. Ann N Y Acad Sci. 2005; 1050: 286-294.
- Martins TB, Burlingame R, von Muhlen CA, et al. Evaluación de inmunoensayo de microesferas fluorescentes multiplexadas para la detección de autoanticuerpos contra antígenos nucleares. Clin Diagn Lab Immunol. 2004; 11: 1054-1059.
- Bernardini S, Infantino M, Bellincampi L, et al. Cribado de anticuerpos antinucleares: Comparación entre inmunoensayo enzimático basado en homogeneizados nucleares, antígenos purificados o recombinantes y ensayo de inmunofluorescencia. Clin Chem Lab Med. 2004; 42: 1155-1160.
- Nossent H, Rekvig OP. Detección de anticuerpos antinucleares en este nuevo milenio: ¿Adiós al microscopio? Scand J Rheumatol. 2001; 30: 123-126; discusión 127-128.
- Lopez-Hoyos M, Rodriguez-Valverde V, Martinez-Taboada V. Performance of antinuclear anticuerpo de detección de enfermedades del tejido conectivo. Ann N Y Acad Sci. 2007; 1109: 322-329.
- Ghillani P, Rouquette AM, Desgruelles C, et al. Evaluación del ensayo de cribado LIAISON ANA para la prueba de anticuerpos antinucleares en enfermedades autoinmunes. Ann N Y Acad Sci. 2007; 1109: 407-413.
- Bonilla E, Francis L, Allam F, et al. La microscopía de inmunofluorescencia es superior a las perlas fluorescentes para la detección de reactividad de anticuerpos antinucleares en pacientes con lupus eritematoso sistémico. Clin Immunol. 2007; 124: 18-21.
- Nifli AP, Notas G, Mamoulaki M, et al. Comparación de un ensayo de fluorescencia multiplexado basado en perlas y métodos de inmunofluorescencia para la detección de autoanticuerpos ANA y ANCA en suero humano. Métodos J Immunol. 2006; 311: 189-197.
- Shovman O, Gilburd B, Zandman-Goddard G, et al. Inmunoensayo multiplexado AtheNA multi-lyte para la detección de ANA en enfermedades autoinmunes. Autoinmunidad. 2005; 38: 105-109.
- Ulvestad E. Características de rendimiento y utilidad clínica de un ELISA híbrido para la detección de ANA. Apmis. 2001; 109: 217-222.
- Olaussen E, Rekvig OP. Pruebas de detección de anticuerpos antinucleares (ANA): uso selectivo de antígenos nucleares centrales como base racional para la detección mediante ELISA. J Autoimmun. 1999; 13: 95-102.
- Homburger HA, Cahen YD, Griffiths J, Jacob GL. Detección de anticuerpos antinucleares: Evaluación comparativa de métodos de inmunoensayo enzimático e inmunofluorescencia indirecta. Arch Pathol Lab Med. 1998; 122: 993-999.
- Gniewek RA, Stites DP, McHugh TM, Hilton JF, Nakagawa M. Comparación de métodos de prueba de anticuerpos antinucleares: ensayo de inmunofluorescencia versus inmunoensayo enzimático. Clin Diagn Lab Immunol. 1997; 4: 185-188.
- Reichlin M. Anticuerpos contra ADN, SM y RNP. A hoy. Octubre de 2008.
- Hahn BH. Anticuerpos contra el ADN. New Engl J Med. 1998; 338: 1359.
- Kavanaugh AF, Solomon DH, Comité Ad Hoc del Colegio Estadounidense de Reumatología sobre Pautas de Pruebas Inmunológicas. Directrices para las pruebas de laboratorio inmunológico en las enfermedades reumáticas: Pruebas de anticuerpos anti-ADN. Arthritis Rheum. 2002; 47: 546-555.
- Benito-García E, Schur PH, Lahita R. Pautas para las pruebas de laboratorio inmunológico en las enfermedades reumáticas: pruebas de anticuerpos Anti-Sm y Anti-RNP. Arthritis Rheum. 2004; 51: 1030-1044.
- Reichlin M. Importancia clínica de los anticuerpos anti-Ro / SSA y anti-La / SSB. A hoy. Octubre de 2008.
- Reveille JD, Sherrer YRS, Solomon DH, Schur P, Kavanaugh A. Directrices basadas en evidencia para el uso de pruebas de laboratorio inmunológicas: Anti-Ro (SS-A) y La (SS- B): Informe del Comité Ad Hoc de ACR sobre Directrices de Pruebas Inmunológicas. Enviado para publicación.
- Reichlin M. Anticuerpos anti-proteína P antiribosomales. A hoy. Octubre de 2008.
- Denton CP. Clasificación de la esclerodermia. A hoy. Octubre de 2008.