US Pharm. 2018; 43 (7): 22-26.
RESUMEN: Las estatinas son una clase de medicamentos ampliamente utilizados para la prevención primaria y secundaria de eventos cardiovasculares. Con seis estatinas disponibles genéricamente, la selección de un agente apropiado puede determinarse en función de factores específicos del fármaco, incluidas las consideraciones de dosificación, las interacciones farmacológicas y los eventos adversos. Se pueden desarrollar planes individualizados de atención al paciente basados en datos de importantes estudios clínicos, diferencias en las pautas y recomendaciones de manejo actuales para dos eventos adversos importantes asociados con el uso de estatinas.
La piedra angular del tratamiento de la dislipidemia implica el uso de Inhibidores de la 3-hidroxi-3-metilglutaril-coenzima A reductasa, más comúnmente conocidos como estatinas. Con una variedad de opciones genéricas en el mercado y una fuerte evidencia que respalda su uso, las estatinas son algunos de los medicamentos más recetados en el mundo.1 Sin embargo, el uso frecuente de estos agentes ha llevado a un escrutinio continuo de su seguridad y a un debate continuo sobre su uso. papel en la terapia. Este artículo, que se centra en las estatinas genéricas, destacará el debate sobre el papel de las estatinas en la terapia, discutirá el uso adecuado y explorará la evidencia en torno a dos eventos adversos importantes.
De las siete estatinas diferentes en el mercado, seis están disponibles genéricamente (TABLA 1) .2-7 Tres formulaciones de marca disponibles son pitavastatina (Livalo), suspensión oral de simvastatina (FloLipid) y lovastatina de liberación prolongada (Altoprev). la amplia disponibilidad de opciones genéricas.
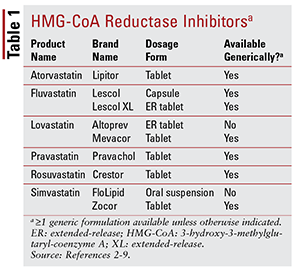
La atorvastatina y la simvastatina también están disponibles genéricamente en varios productos combinados. Estos incluyen la combinación de atorvastatina y amlodipino, un bloqueador de los canales de calcio (BCC) indicado para la hipertensión, y la combinación de simvastatina y ezetimiba, un inhibidor de la absorción intestinal del colesterol también indicado para la hipercolesterolemia.11,12 Productos con estatinas y niacina coformulados (niacina / lovastatina y niacina / simvastatina) se retiraron del mercado en 2016 debido a la falta de evidencia de que la adición de niacina en pacientes tratados con estatinas reduce aún más los resultados cardiovasculares (CV) más allá de lo que se observa con las estatinas solas.13
RECOMENDACIONES DE TRATAMIENTO
Se ha demostrado repetidamente que las estatinas son efectivas para reducir los niveles de colesterol LDL (C-LDL) y triglicéridos mientras aumentan los niveles de colesterol HDL (C-HDL) .14 Además, se ha demostrado que mejoran significativamente resultados orientados al paciente, como eventos CV mayores (ECV), tanto en la prevención primaria como en la secundaria.15-19
Varias pautas de tratamiento muy debatidas discuten el papel de las estatinas en el tratamiento de perlipidemia. Estos incluyen la guía de 2013 del Colegio Americano de Cardiología / Asociación Americana del Corazón (ACC / AHA) y la guía de la Academia Americana de Endocrinología Clínica (AACE) de 2017.14,20 Ambas guías sugieren que después de la implementación de modificaciones en el estilo de vida, incluido el abandono del hábito de fumar, se debe un régimen de ejercicio, y siguiendo una dieta saludable para el corazón, las estatinas son la terapia de primera línea para la prevención primaria y secundaria de la enfermedad CV (ECV) .14,20 Las pautas difieren, sin embargo, en cómo determinar qué estatinas son apropiadas para qué pacientes.
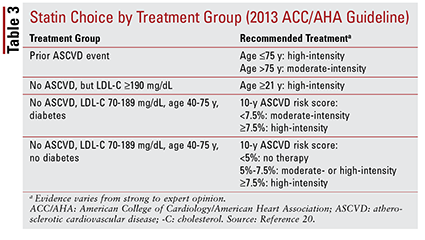
La guía ACC / AHA de 2013 introdujo cuatro grupos de tratamiento para ser el objetivo de la terapia con estatinas:
1. Pacientes con ECV aterosclerótica previa (ASCVD), incluidos aquellos con un evento previo (es decir, síndromes coronarios agudos, antecedentes de infarto de miocardio, angina estable o inestable, revascularización coronaria u otra arteria, accidente cerebrovascular, ataque isquémico transitorio o enfermedad arterial periférica de presunta origen aterosclerótico).
2. Pacientes sin antecedentes de un evento de ASCVD que tengan un nivel de LDL-C de 190 mg / dL o más. La edad no es una base para la exclusión de este criterio.
3. Pacientes de 40 a 75 años con diabetes pero sin antecedentes de un evento de ASCVD y un nivel de LDL-C entre 70 y 189 mg / dL.
4. Pacientes de 40 a 75 años sin diabetes que no tienen antecedentes de un evento de ASCVD y un nivel de LDL-C entre 70 y 189 mg / dL.20
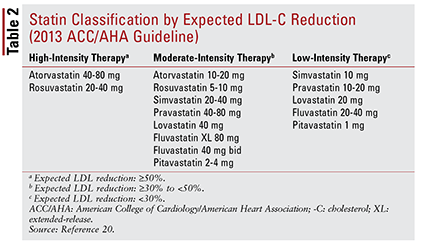
La guía ACC / AHA también introdujo la idea de agrupar estatinas por intensidad (es decir, su capacidad esperada de reducción de LDL-C) (TABLA 2) .20 Según el grupo de tratamiento (como se define anteriormente), la guía recomienda intensidades de estatinas específicas para situaciones clínicas particulares (TABLA 3) .20 Varios grupos de tratamiento requieren el cálculo de una puntuación de riesgo ASCVD utilizando un estimador de riesgo ASCVD. Esta herramienta en línea tiene en cuenta la edad, el sexo, la raza, la presión arterial sistólica, el colesterol total, el HDL-C y los antecedentes médicos importantes del paciente para el tratamiento de la hipertensión, la diabetes o el tabaquismo.21 Una vez ingresados todos los datos, el 10 Se calcula el riesgo de un año de experimentar un evento ASCVD.
Estas recomendaciones no se aplican automáticamente a ciertos subgrupos de pacientes. Por ejemplo, el uso de estatinas en adultos mayores debe abordarse con cautela. Aunque el uso de estatinas para la prevención secundaria en pacientes ancianos confiere un beneficio significativo, su uso para la prevención primaria no está claro.22-24 Además, no se ha encontrado que los pacientes con insuficiencia cardíaca experimenten los mismos beneficios de la terapia con estatinas que aquellos sin insuficiencia cardíaca. En base a estos hallazgos, las recomendaciones de tratamiento incluyen limitar el inicio de estatinas de alta intensidad a pacientes menores de 75 años y posiblemente evitar las estatinas en pacientes con insuficiencia cardíaca.20 En general, la decisión de usar estatinas en estos grupos no es clara y debe involucrar una conversación continua entre el proveedor y el paciente sobre los posibles riesgos y beneficios de la terapia.20
Contrariamente a la recomendación de ACC / AHA de 2013 de iniciar la terapia de acuerdo con la clasificación del grupo de tratamiento, la guía de la AACE de 2017 recomienda que los pacientes individuales sean tratados según los hallazgos de laboratorio.14 De acuerdo con esta guía, el riesgo del paciente está determinado por una variedad de factores importantes, adicionales, y factores de riesgo no tradicionales. Luego, los individuos se clasifican en uno de los cinco grupos de riesgo, cada uno con un objetivo correspondiente de C-LDL y C-no-HDL (TABLA 4). Con base en los niveles actuales y los objetivos individualizados, las estatinas solas o en combinación con otros agentes deben iniciarse en función de la capacidad esperada para reducir el LDL-C o no HDL-C14.

El tratamiento combinado que implica la adición de un segundo agente a la terapia con estatinas en curso sigue siendo un tema algo controvertido. Mientras que los ensayos y las pautas anteriores minimizaron la adición de otros agentes a la terapia de base con estatinas, los estudios recientes y las declaraciones de consenso, incluido uno de la ACC / AHA, apoyan el uso de ezetimiba, evolocumab o alirocumab, los dos últimos de los cuales son proproteína convertasa subtilisina / inhibidores de kexina tipo 9, como terapia complementaria para la prevención secundaria.20,26-31 Dicho esto, las estatinas siguen siendo una terapia universal de primera línea tanto en la prevención primaria como secundaria; el papel definitivo de otros agentes específicos sigue sin estar claro.
SELECCIÓN DE ESTATINAS
La elección de la terapia con estatinas comienza con el enfoque de tratamiento preferido por el médico, ya sea el método ACC / AHA de tratamiento con estatinas grupos o el método AACE de objetivos de LDL-C o no HDL-C. A partir de ahí, se deben tener en cuenta las propiedades de cada estatina para determinar la mejor opción para cada paciente. No todas las estatinas son iguales y existen varias diferencias clave que pueden influir en la selección del paciente, incluidas las consideraciones de dosificación, las interacciones farmacológicas y los eventos adversos (EA).
Dosificación
Aunque la mayoría de las estatinas pueden La lovastatina de liberación inmediata (IR) debe tomarse con la comida de la noche debido al aumento de la biodisponibilidad.4 Sin embargo, ocurre lo contrario con la lovastatina de liberación prolongada, que no debe tomarse con alimentos debido a una menor biodisponibilidad. .8 Además, aunque todas las estatinas pueden dosificarse una vez al día, la fluvastatina IR y lovastatina pueden requerir una dosificación dos veces al día.3,4 Finalmente, mientras que atorvastatina, pravastatina y rosuvastatina pueden administrarse en cualquier momento del día, fluvastatina, lovastatina y la simvastatina debe tomarse por la noche.3,4,7 Simvastatina, en particular, demostró tener una eficacia significativamente diferente cuando se toma por la noche en comparación con la mañana.32
Interacciones farmacológicas
Cada estatina tiene diferentes preocupaciones con respecto a las interacciones fármaco-fármaco y fármaco-alimento debido a las vías específicas a través de las cuales se metaboliza cada uno (TABLA 5). Existen demasiadas interacciones farmacológicas para discutir cada una en detalle; por lo tanto, a continuación se describen solo unos pocos seleccionados.
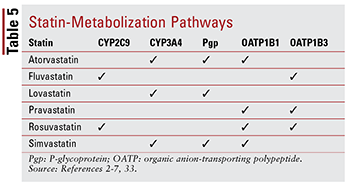
Fibratos: aunque la combinación de un fibrato y una estatina no ha demostrado alterar significativamente los resultados clínicos, a los pacientes se les puede recetar gemfibrozil, fenofibrato o ácido fenofíbrico junto con una estatina para atacar la hipertrigliceridemia gravemente incontrolada.14,20,26,33 Debido a que ambas clases están asociados con toxicidad relacionada con el músculo, la terapia de combinación aumenta significativamente este riesgo en comparación con cualquiera de las terapias solas33. Esta toxicidad aditiva se observa con más frecuencia con gemfibrozil que con otros fibratos33. Por lo tanto, el uso de gemfibrozil está contraindicado con simvastatina y debe evitarse con otros estatinas.7,20 Si se van a utilizar juntos una estatina y un fibrato, se prefiere fenofibrato o ácido fenofíbrico.20,33 Sin embargo, si se debe utilizar gemfibrozil, fluvastatina o, con un control cuidadoso, atorvastatina o rosuvastatina (máximo 10 mg diarios ) —Es el agente de elección.33
Amiodarona: Este agente antiarrítmico indicado para la fibrilación ventricular es un conocido inhibidor de la glicoproteína P (Pgp) y del sistema enzimático CYP450, específicamente CYP3A4 y, en menor medida, CYP2C9.33,34 Como Como resultado, existen dosis máximas recomendadas para lovastatina (máximo 40 mg al día) y simvastatina (máximo 20 mg al día) cuando se usan con amiodarona4,7,33. Aunque la atorvastatina se metaboliza a través del CYP3A4, no es necesario ajustar la dosis (de manera similar a otras estatinas). porque los datos no sugieren efectos adversos graves cuando se utilizan atorvastatina y amiodarona de forma concomitante.2,33
BCC: Se ha demostrado que los BCC de dihidropiridina (amlodipina) y no dihidropiridina (diltiazem, verapamilo) tienen interacciones medicamentosas significativas con las estatinas . De manera similar a la amiodarona, amlodipino, diltiazem y verapamilo inhiben el CYP3A4.33,35-37 Amlodipino también tiene un efecto inhibidor sobre Pgp.33,35 Según los EA reportados en la literatura, se recomienda una dosis diaria máxima de 20 mg de lovastatina cuando se utiliza con amlodipina, diltiazem o verapamilo.4,33 También se recomienda que la simvastatina no exceda los 20 mg cuando se utiliza con amlodipina, pero se debe administrar una dosis menor de 10 mg cuando se utiliza con diltiazem y verapamilo.7,33 Sin dosis específicas Existen recomendaciones con la atorvastatina, aunque se debe tener precaución cuando se administra con cualquiera de los BCC no dihidropiridínicos.2,33
Reacciones adversas a los medicamentos
Las estatinas generalmente se toleran bien; sin embargo, las tasas de interrupción siguen siendo altas.38 La interrupción del tratamiento con estatinas y la imposibilidad de reanudar la terapia con estatinas después de la aparición de reacciones adversas al fármaco se asocian con mayores tasas de ECV.39 Las preocupaciones de los pacientes sobre la seguridad de las estatinas a la luz de dos EA importantes relacionados con las estatinas: miotoxicidad y diabetes de nueva aparición: pueden llevar a la interrupción de las estatinas.
Myotoxicidad: las estatinas se han asociado durante mucho tiempo con toxicidad relacionada con los músculos, incluida la mialgia (dolor muscular sin creatina quinasa elevada), miopatía (término general para enfermedad) y miositis (inflamación muscular), las dos últimas de las cuales implican elevaciones significativas de CK.40,41 Todas las estatinas comparten una advertencia sobre el efecto secundario poco común pero grave de la rabdomiólisis.2-7 A menudo, sin embargo, la miotoxicidad atribuida a las estatinas es por efecto nocebo; es decir, una persona cree que un medicamento causará daño y, posteriormente, el medicamento causará el daño anticipado.42,43 Por lo tanto, para garantizar el mejor resultado, los farmacéuticos deben estar bien informados sobre este efecto secundario comúnmente reportado y su manejo adecuado.
Es incorrecto suponer que todos los informes de síntomas musculares se deben al efecto nocebo; Es imperativo examinar adecuadamente el historial médico anterior (PMH) del paciente, la descripción del dolor y la asociación con el tratamiento con estatinas.44 En primer lugar, un examen de PMH en busca de elevaciones de CK y otras causas potenciales de dolor o debilidad muscular permite al médico tratar alternativas fisiopatología subyacente o factores correctos que pueden alterar el metabolismo de las estatinas. Las causas comunes incluyen vejez, interacciones medicamentosas, insuficiencia renal o hepática, aumento de la actividad física y deficiencia de vitamina D.20,41
A continuación, el médico debe comparar la presentación del paciente con los síntomas inducidos por estatinas que se observan comúnmente. . La toxicidad muscular inducida por las estatinas generalmente se presenta como dolor, sensibilidad, calambres y debilidad, generalmente en los músculos de las piernas.20,41 Estos síntomas suelen empeorar después del ejercicio y no se resuelven sin suspender el agente causante.41
El último paso es determinar si existe una relación causal entre los síntomas y el uso de estatinas. Cuando se sospecha que una estatina es la causa de síntomas leves a moderados, se recomienda la abstinencia temporal. Si los síntomas no se resuelven después de aproximadamente 2 semanas, es probable que la estatina no sea la causa y deba reiniciarse con la dosis original. Sin embargo, si los síntomas desaparecen, se debe realizar un nuevo ensayo con la misma estatina a la misma dosis o a una dosis menor. Si luego se experimentan síntomas similares, se debe suponer que la estatina es la causa y se debe descontinuar. Una vez que se resuelven los síntomas, se debe iniciar una dosis baja de una estatina alternativa y ajustarla a la dosis máxima tolerada.20,41 La aceptación y comprensión de este proceso por parte del paciente es importante porque el efecto nocebo puede conducir a reacciones percibidas adicionales.
Existen varias otras estrategias para controlar y prevenir estos síntomas. Primero, debido a una mayor probabilidad de síntomas, el médico puede optar por evitar las estatinas más lipofílicas (lovastatina y simvastatina) en favor de estatinas más hidrofílicas (fluvastatina, pravastatina y rosuvastatina) .44 La simvastatina 80 mg nunca debe iniciarse como nueva. terapia en cualquier paciente debido a una frecuencia inusualmente alta de síntomas musculares asociados con las estatinas.7,45 Las terapias alternativas, como la coenzima Q10, no han demostrado un beneficio constante, pero pueden considerarse en pacientes que experimentan síntomas inducidos psicológicamente.41,44,46 Finalmente, se puede considerar la dosificación a intervalos prolongados, que implica la dosificación de estatinas varias veces a la semana en lugar de una vez al día. Este enfoque mejora la adherencia y los perfiles de lípidos en pacientes con intolerancia previa a las estatinas.47-49
Diabetes de nueva aparición: un EA importante asociado con el uso de estatinas es la diabetes de nueva aparición. Se ha demostrado que las estatinas aumentan el riesgo de desarrollo de diabetes, aunque existen varias advertencias importantes.50 Primero, aunque esto puede considerarse una especie de efecto de clase, el verdadero riesgo de cada estatina específica aún se desconoce51,52. En el análisis hasta la fecha, la pravastatina tenía el riesgo más bajo, la simvastatina y la atorvastatina tenían un riesgo moderado, y la rosuvastatina tenía el riesgo más alto de causar diabetes de nueva aparición.53 Sin embargo, ninguno de estos hallazgos fue estadísticamente significativo.53 Además, el hallazgo de que la diabetes el riesgo aumenta a medida que aumenta la dosis de estatinas ha sido inconsistente.54
La diabetes inducida por estatinas es más prevalente en personas que ya tienen un alto riesgo de desarrollar diabetes.50,54 Esto incluye pacientes mayores y aquellos con prediabetes o enfermedades metabólicas 50,55 Un hallazgo constante ha sido que, por cada nuevo caso de diabetes incidente causado por estatinas, se pueden prevenir varias ECV en pacientes de mayor riesgo.50 Por lo tanto, los farmacéuticos deben asesorar a un médico. Si los usuarios de estatinas tienen un riesgo moderado o alto de complicaciones CV, el riesgo de desarrollar diabetes está más que compensado por los beneficios de reducción del riesgo CV. Sin embargo, la relación riesgo-beneficio no está clara en pacientes con un riesgo muy bajo de ECV.50
CONCLUSIÓN
Aunque el tratamiento con estatinas no está exento de riesgos, sus beneficios para reducir los resultados CV lo convirtió en la piedra angular de la prevención de CVE. Las pautas disponibles difieren ampliamente, pero la única constante es que las estatinas deben ser el tratamiento de primera línea para la prevención primaria y secundaria en casi todos los pacientes. La amplia disponibilidad genérica de estatinas ha hecho que estos agentes sean cada vez más accesibles. Al comprender que no todas las estatinas son iguales, el farmacéutico puede ayudar a garantizar el mejor resultado posible para cada paciente.
1. Instituto IMS de Informática Sanitaria. Uso y gasto de medicamentos en los EE. UU .: una revisión de 2015 y perspectivas para 2020. https://morningconsult.com/wp-content/uploads/2016/04/IMS-Institute-US-Drug-Spending-2015.pdf. Consultado el 18 de marzo de 2018.
2. Prospecto de Lipitor (atorvastatin). Nueva York, NY: Pfizer, Inc; Junio de 2017.
3. Prospecto de Lescol / Lescol XL (fluvastatina). East Hanover, Nueva Jersey: Novartis Pharmaceuticals Corp; Agosto de 2017.
4. Prospecto de mevacor (lovastatina). Estación de Whitehouse, Nueva Jersey: Merck & Co, Inc; Febrero de 2014.
5. Prospecto de pravachol (pravastatina). Princeton, Nueva Jersey: Bristol-Myers Squibb Company; Julio de 2016.
6. Prospecto de Crestor (rosuvastatina). Wilmington, DE: AstraZeneca Pharmaceuticals LP; Agosto de 2017.
7. Prospecto de Zocor (simvastatina). Estación de Whitehouse, Nueva Jersey: Merck & Co, Inc; Febrero de 2015.
8. Prospecto de Altoprev (lovastatina). Zug, Suiza: Covis Pharma; Abril de 2017.
9. Prospecto de FloLipid (simvastatin). Brooksville, FL: Salerno Pharmaceuticals LP; Julio de 2017.
10. Prospecto de Livalo (pitavastatina). Montgomery, AL: Kowa Pharmaceuticals America, Inc; Noviembre de 2016.
11. Prospecto de Caduet (amlodipina / atorvastatina). Nueva York, NY: Pfizer Inc; Octubre de 2017.
12. Prospecto de Vytorin (ezetimibe / simvastatin). Estación de Whitehouse, Nueva Jersey: Merck & Co, Inc; Febrero de 2018.
13. AbbVie Inc .; retirada de la aprobación de nuevas solicitudes de medicamentos para Advicor y Simcor. www.federalregister.gov/documents/2016/04/18/2016-08894/abbvie-inc-withdrawal-of-approval-of-new-drug-applications-for-advicor-and-simcor. Consultado el 18 de marzo de 2018.
14. Jellinger PS, Handelsman Y, Rosenblit PD, et al. Directrices de la Asociación Estadounidense de Endocrinólogos Clínicos y del Colegio Estadounidense de Endocrinología para el manejo de la dislipidemia y la prevención de enfermedades cardiovasculares. Endocr Pract. 2017; 23 (supl 2): 1-87.
15. LaRosa JC, Grundy SM, Waters DD, et al. Reducción intensiva de lípidos con atorvastatina en pacientes con enfermedad coronaria estable. N Engl J Med. 2005; 352: 1425-1435.
16. Ridker PM, Danielson E, Fonseca FA, et al. Rosuvastatina para prevenir eventos vasculares en hombres y mujeres con proteína C reactiva elevada. N Engl J Med. 2008; 359: 2195-2207.
17. Mihaylova B, Emberson J, Blackwell L y col. Los efectos de reducir el colesterol LDL con la terapia con estatinas en personas con bajo riesgo de enfermedad vascular: metanálisis de datos individuales de 27 ensayos aleatorios. Lanceta. 2012; 380: 581-590.
18. Baigent C, Landray MJ, Reith C y col. Los efectos de reducir el colesterol LDL con simvastatina más ezetimiba en pacientes con enfermedad renal crónica (Estudio de protección cardíaca y renal): un ensayo aleatorizado controlado con placebo. Lanceta. 2011; 377: 2181-2192.
19. Cannon CP, Braunwald E, McCabe CH, et al.Reducción de lípidos intensiva versus moderada con estatinas después de síndromes coronarios agudos. N Engl J Med. 2004; 350: 1495-1504.
20. Stone NJ, Robinson JG, Lichtenstein AH, et al. Guía de 2013 de ACC / AHA sobre el tratamiento del colesterol en sangre para reducir el riesgo cardiovascular aterosclerótico en adultos: un informe del Grupo de trabajo sobre guías de práctica del American College of Cardiology / American Heart Association. Circulación. 2014; 129 (25 supl 2): S1-S45.
21. Colegio Americano de Cardiología. Estimador de riesgos ASCVD Plus. http://tools.acc.org/ASCVD-Risk-Estimator. Consultado el 18 de marzo de 2018.
22. Wenger NK, Lewis SJ, Herrington DM y col. Resultados del uso de atorvastatina en dosis altas o bajas en pacientes de 65 años o más con enfermedad coronaria estable. Ann Intern Med. 2007; 147: 1-9.
23. Shepherd J, Blauw GJ, Murphy MB, et al. Pravastatina en ancianos con riesgo de enfermedad vascular (PROSPER): un ensayo controlado aleatorio. Lanceta. 2002; 360: 1623-1630.
24. Teng M, Lin L, Zhao YJ y col. Estatinas para la prevención primaria de enfermedades cardiovasculares en pacientes ancianos: revisión sistemática y metaanálisis. Envejecimiento de las drogas. 2015; 32: 649-661.
25. Kjekshus J, Apetrei E, Barrios V, et al. Rosuvastatina en pacientes mayores con insuficiencia cardíaca sistólica. N Engl J Med. 2007; 357: 2248-2261.
26. Ginsberg HN, Elam MB, Lovato LC y col. Efectos de la terapia combinada de lípidos en la diabetes mellitus tipo 2. N Engl J Med. 2010; 362: 1563-1574.
27. Kastelein JJ, Akdim F, Stroes ES, et al. Simvastatina con o sin ezetimiba en la hipercolesterolemia familiar. N Engl J Med. 2008; 358: 1431-1443.
28. Cannon CP, Blazing MA, Giugliano RP, et al. Ezetimiba añadido al tratamiento con estatinas después de los síndromes coronarios agudos. N Engl J Med. 2015; 372: 2387-2397.
29. Sabatine MS, Giugliano RP, Keech AC, et al. Evolocumab y resultados clínicos en pacientes con enfermedad cardiovascular. N Engl J Med. 2017; 376: 1713-1722.
30. Lloyd-Jones DM, Morris PB, Ballantyne CM y col. Actualización centrada en 2017 de la vía de decisión de consenso de expertos de ACC de 2016 sobre el papel de las terapias sin estatinas para la reducción del colesterol LDL en el manejo del riesgo de enfermedad cardiovascular aterosclerótica: un informe del Grupo de Trabajo del Colegio Estadounidense de Cardiología sobre vías de decisión de consenso de expertos. J Am Coll Cardiol. 2017; 70: 1785-1822.
31. Resultados de ODYSSEY: los resultados sugieren que el uso del inhibidor de PCSK9 reduce los eventos CV, LDL-C en pacientes con SCA. Colegio Americano de Cardiología. www.acc.org/latest-in-cardiology/articles/2018/03/05/15/53/sat-9am-odyssey-outcomes-cv-outcomes-with-alirocumab-after-acs-acc-2018. Consultado el 20 de junio de 2018.
32. Wallace A, Chinn D, Rubin G. Tomar simvastatina por la mañana en comparación con la noche: ensayo controlado aleatorio. BMJ. 2003; 327: 788.
33. Wiggins BS, Saseen JJ, Page RL, et al. Recomendaciones para el manejo de interacciones medicamentosas clínicamente significativas con estatinas y agentes selectos utilizados en pacientes con enfermedad cardiovascular: una declaración científica de la American Heart Association. Circulación. 2016; 134: e468-e495.
34. Prospecto de pacerona (amiodarona). Maple Grove, MN: Upsher-Smith Laboratories LLC; Julio de 2017.
35. Prospecto de Norvasc (amlodipina). Nueva York, NY: Pfizer Inc; Octubre de 2017.
36. Prospecto de Cardizem (diltiazem). Bridgewater, Nueva Jersey: Valeant Pharmaceuticals; Noviembre de 2016.
37. Prospecto de Calan (verapamil). Nueva York, NY: Pfizer Inc; Septiembre de 2017.
38. Riaz H, Khan AR, Khan MS, et al. Metaanálisis de ensayos controlados aleatorios controlados con placebo sobre la prevalencia de intolerancia a las estatinas. Soy J Cardiol. 2017; 120: 774-781.
39. Zhang H, Plutzky J, Shubina M, Turchin A. Prescripciones continuas de estatinas después de reacciones adversas y resultados de los pacientes: un estudio de cohorte. Ann Intern Med. 2017; 167: 221-227.
40. Tomaszewski M, Stepien KM, Tomaszewska J, Czuczwar SJ. Miopatías inducidas por estatinas. Pharmacol Rep. 2011; 63: 859-866.
41. Stroes ES, Thompson PD, Corsini A, et al. Síntomas musculares asociados a las estatinas: impacto en el tratamiento con estatinas — Declaración del panel de consenso de la Sociedad Europea de Aterosclerosis sobre evaluación, etiología y tratamiento. Eur Heart J. 2015; 36: 1012-1022.
42. Gupta A, Thompson D, Whitehouse A y col. Eventos adversos asociados con el tratamiento con estatinas no ciego, pero no ciego, en el Anglo-Scandinavian Cardiac Outcomes Trial — Lipid-Lowering Arm (ASCOT-LLA): un ensayo aleatorizado doble ciego controlado con placebo y su extensión no aleatorizada no ciega fase. Lanceta. 2017; 389: 2473-2481.
43. Pedro-Botet J, Rubiés-Prat J. Síntomas musculares asociados a las estatinas: cuidado con el efecto nocebo. Lanceta. 2017; 389: 2445-2446.
44. Laufs U, Filipiak KJ, Gouni-Berthold I y col. Aspectos prácticos en el manejo de los síntomas musculares asociados a las estatinas (SAMS). Atheroscler Suppl. 2017; 26: 45-55.
45. Comunicado de la FDA sobre la seguridad de los medicamentos: nuevas restricciones, contraindicaciones y limitaciones de dosis de Zocor (simvastatina) para reducir el riesgo de lesión muscular. www.fda.gov/Drugs/DrugSafety/ucm256581.htm. Consultado el 18 de marzo de 2018.
46.Banach M, Serban C, Sahebkar A y col. Efectos de la coenzima Q10 en la miopatía inducida por estatinas: un metanálisis de ensayos controlados aleatorios. Mayo Clin Proc. 2015; 90: 24-34.
47. Goldberg AS, DeGorter MK, Ban MR, et al. Eficacia y concentraciones plasmáticas del fármaco con la dosificación no diaria de rosuvastatina. Can J Cardiol. 2013; 29: 915-919.
48. Matalka MS, Ravnan MC, Deedwania PC. ¿Es la dosis diaria alternativa de atorvastatina eficaz para el tratamiento de pacientes con hiperlipidemia? Estudio de día alterno versus dosis diaria de atorvastatina (ADDAS). Am Heart J. 2002; 144: 674-677.
49. Copher HR, Stewart RD. Dosificación diaria versus dosificación en días alternos de simvastatina en pacientes con hipercolesterolemia. Farmacoterapia. 2002; 22: 1110-1116.
50. Rochlani Y, Kattoor AJ, Pothineni NV, et al. Equilibrio entre la prevención primaria y la prevención de la diabetes mellitus inducida por estatinas. Soy J Cardiol. 2017; 120: 1122-1128.
51. Corrao G, Ibrahim B, Nicotra F, et al. Las estatinas y el riesgo de diabetes: evidencia de un gran estudio de cohorte basado en la población. Cuidado de la diabetes. 2014; 37: 2225-2232.
52. Lim S, Oh PC, Sakuma I, Koh KK. Cómo equilibrar los beneficios y riesgos cardiorenometabólicos de las estatinas. Aterosclerosis. 2014; 235: 644-648.
53. Navarese EP, Buffon A, Andreotti F y col. Metaanálisis del impacto de diferentes tipos y dosis de estatinas en la diabetes mellitus de nueva aparición. Soy J Cardiol. 2013; 111: 1123-1130.
54. Crandall JP, Mather K, Rajpathak SN y col. Uso de estatinas y riesgo de desarrollar diabetes: resultados del Programa de Prevención de la Diabetes. BMJ Open Diabetes Res Care. 2017; 5: e000438.
55. Ganda OP. Diabetes inducida por estatinas: incidencia, mecanismos e implicaciones. F1000Res. 2016; 5.