Cuando ve la tabla periódica, ¿qué le viene a la mente? ¿Las piezas en un tablero de scrabble? Tal vez pienses en tu clase de química en la escuela secundaria. Tal vez piense en la colorida mesa pegada en la pared de una sala de conferencias en la universidad. Tal vez recuerde que su maestro favorito prendió fuego a algo en el frente del aula. Soy profesor asistente de química en la Universidad de Richmond y cuando escucho la frase «la tabla periódica», pienso en la vida.
Pienso en cómo las moléculas y las sustancias químicas que nos rodean y dictan nuestro día a día las actividades se componen de los elementos de esa mesa: sostienen nuestra vida, aportan belleza al mundo y son vitales en la medicina.
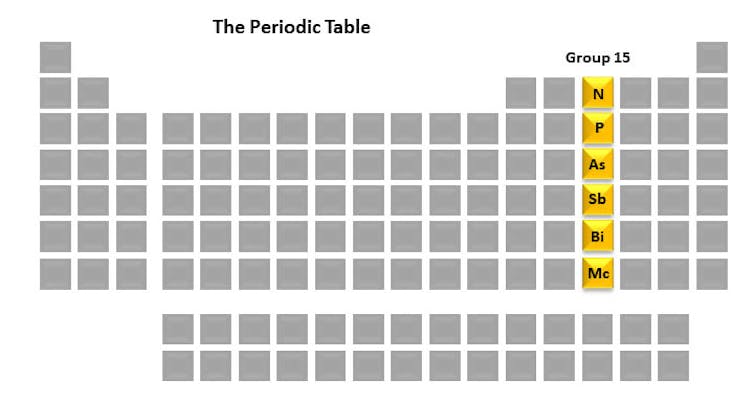
Cada columna de la tabla periódica se llama grupo. Cada miembro del grupo tiene una disposición similar de electrones que puede resultar en propiedades químicas similares. Los elementos del grupo 15 – nitrógeno, fósforo, arsénico, antimonio, bismuto y moscovio – son interesantes para mí por su papel fundamental en la vida, así como en mi laboratorio de investigación. Un elemento que estudiamos es el fósforo debido a su papel integral en el destino de las células.
Pero antes de entrar en esos detalles, echemos un vistazo breve a cada uno de los 15 elementos del grupo. Son un conjunto único en su historia, usos y propiedades.
Grupo 15 – dar vida y causar muerte
El nitrógeno (N) en su forma atmosférica (N₂) constituye aproximadamente 78% del aire que respiramos. Cuando las bacterias que viven dentro de las raíces de las plantas lo convierten en una forma utilizable a través de un proceso llamado fijación de nitrógeno, esta forma elemental de nitrógeno se incorpora a muchos compuestos necesarios para la vida: proteínas y ADN, por ejemplo. En la parte inferior de la columna está Moscovium (Mc), lo cual es interesante porque realmente no existe en la naturaleza. Es un elemento radiactivo que solo se puede generar en un laboratorio y sobrevive menos de un segundo.
El arsénico (As) puede resultarle familiar debido a su asociación con envenenamientos. En 1494, Pico della Mirandola, un filósofo humanista italiano durante el Renacimiento, fue envenenado con arsénico, aunque los detalles que rodearon su temprana muerte aún se debaten. Durante mucho tiempo se creyó que Napoleón Bonaparte murió por exposición al arsénico en 1821, pero después de extensas comparaciones de muestras de cabello preservado de diferentes etapas de su vida, los investigadores concluyeron que los niveles elevados de arsénico probablemente se debieron a las técnicas de preservación de la época. Más recientemente, la Organización Mundial de la Salud estimó que el agua potable contaminada con arsénico en Bangladesh provocó más de 9,000 muertes en 2001. No se comprende completamente cómo el arsénico envenena y mata, pero no hay duda de que el elemento causa la destrucción de órganos vitales en el ser humano. cuerpo.

Cuando el elemento antimonio (Sb) se combina con tres átomos de oxígeno para formar trióxido de antimonio, se utiliza ampliamente como retardante de llama para muebles, alfombras , cortinas, caucho, plásticos y adhesivos. Las cantidades de esta molécula en estos productos domésticos tienden a ser muy pequeñas y estos niveles de antimonio se consideran seguros.
El bismuto (Bi) es un metal que se encuentra en la misma fila de la tabla periódica que varios metales tóxicos; sin embargo, los compuestos que contienen bismuto son inofensivos. Los compuestos de bismuto se pueden encontrar en cosméticos debido a su distintivo y deseable brillo plateado. Incluso si no ha usado productos de cuidado personal que contengan bismuto, probablemente lo haya encontrado en el conocido antiácido Peptobismol®, que se usa para tratar el malestar estomacal, o el 4 de julio cuando está viendo los fuegos artificiales. Es un compuesto de bismuto que causa los sonidos crepitantes de los fuegos artificiales del huevo de dragón.
Por último, pero no menos importante, del grupo 15 elementos está el fósforo (P). Fue descubierto en 1669 por el alquimista Hennig Brandt y recibió su nombre de la palabra griega «fósforo», que significa portador de luz. Eso se debe a que cuando la forma elemental interactúa con el oxígeno atmosférico produce una luz brillante. Los químicos descubrieron cómo aprovechar el poder de esta reacción para el desarrollo de fósforos. La punta roja de un fósforo todavía contiene una forma de fósforo en la actualidad.
Fosfatos: regulan el destino de las células cancerosas
Además de las chispas generadas por el elemento , el fósforo se encuentra en un compuesto conocido como fosfato: fósforo unido a cuatro átomos de oxígeno.En las células, cuando una molécula de fosfato se une a una proteína, puede encender o activar la proteína para que pueda realizar su función en la célula, como estimular el crecimiento.
Cuando el fosfato deja de estar unido a la proteína, las células dejan de crecer. Puede pensar en ello casi como los fósforos descritos anteriormente: cuando el fosfato está allí, el fósforo puede encenderse y el negocio puede continuar. Cuando se elimina el fosfato, el fósforo es solo un palo y no se proporciona luz; no puede suceder tanto trabajo en la oscuridad.
En las células cancerosas, el estado del fosfato está fuera de control. Imagine una gran cantidad de fósforos encendidos y una habitación muy luminosa que puede provocar una gran actividad. Esta actividad puede tener graves consecuencias para las células. Por ejemplo, el crecimiento y la migración no regulados pueden provocar cáncer.
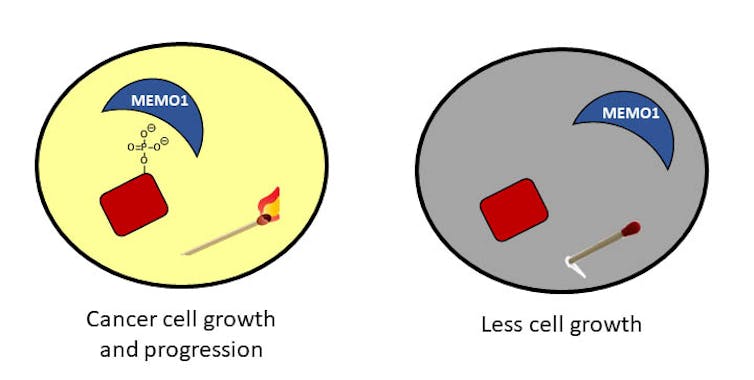
En mi laboratorio de la Universidad de Richmond, estamos interesados en comprender estos fosfatos y una proteína en particular que interactúa con ellos. Esta proteína, llamada MEMO1, se encuentra en grandes cantidades en pacientes con cáncer de mama y ayuda a que los fosfatos permanezcan siempre unidos a las proteínas. Estamos tratando de comprender cómo MEMO1 interactúa con estos fosfatos y estamos desarrollando estrategias para interrumpir esas interacciones.
Esperamos que nuestro trabajo revele una forma de ayudar a eliminar los fosfatos para detener el crecimiento descontrolado de las células, en otras palabras, apagar las cerillas.
Así que la próxima vez que escuche las palabras «tabla periódica», por favor piensa en la vida. Piensa en las moléculas que encuentras en cada momento de cada día, piensa en la medicina que te mantiene saludable y piensa en aquellos de nosotros que estamos trabajando para entender cómo mantenerte así .