Disminución de la presión de vapor
Como se describe en el capítulo sobre líquidos y sólidos, la presión de vapor de equilibrio de un líquido es la presión ejercida por su gas fase en la que la vaporización y la condensación ocurren a velocidades iguales:
\ text {liquid} \ rightleftharpoons \ text {gas}
Disolver una sustancia no volátil en un líquido volátil da como resultado una disminución de la presión de vapor del líquido. Este fenómeno se puede racionalizar considerando el efecto de las moléculas de soluto agregadas en los procesos de vaporización y condensación del líquido. Para vaporizar, las moléculas de disolvente deben estar presentes en la superficie de la solución. La presencia de soluto disminuye el área de superficie disponible para las moléculas de disolvente y, por tanto, reduce la velocidad de vaporización del disolvente. Dado que la velocidad de condensación no se ve afectada por la presencia de soluto, el resultado neto es que el equilibrio de vaporización-condensación se logra con menos moléculas de disolvente en la fase de vapor (es decir, a una presión de vapor más baja) (Figura 1). Si bien esta interpretación cinética es útil, no tiene en cuenta varios aspectos importantes de la naturaleza coligativa de la disminución de la presión de vapor. Una explicación más rigurosa implica la propiedad de la entropía, un tema de discusión en un capítulo de texto posterior sobre termodinámica. Para comprender la disminución de la presión de vapor de un líquido, es adecuado señalar que la mayor entropía de una solución en comparación con su solvente y soluto separados sirve para estabilizar eficazmente las moléculas de solvente y obstaculizar su vaporización. Se produce una presión de vapor más baja y un punto de ebullición correspondientemente más alto, como se describe en la siguiente sección de este módulo.
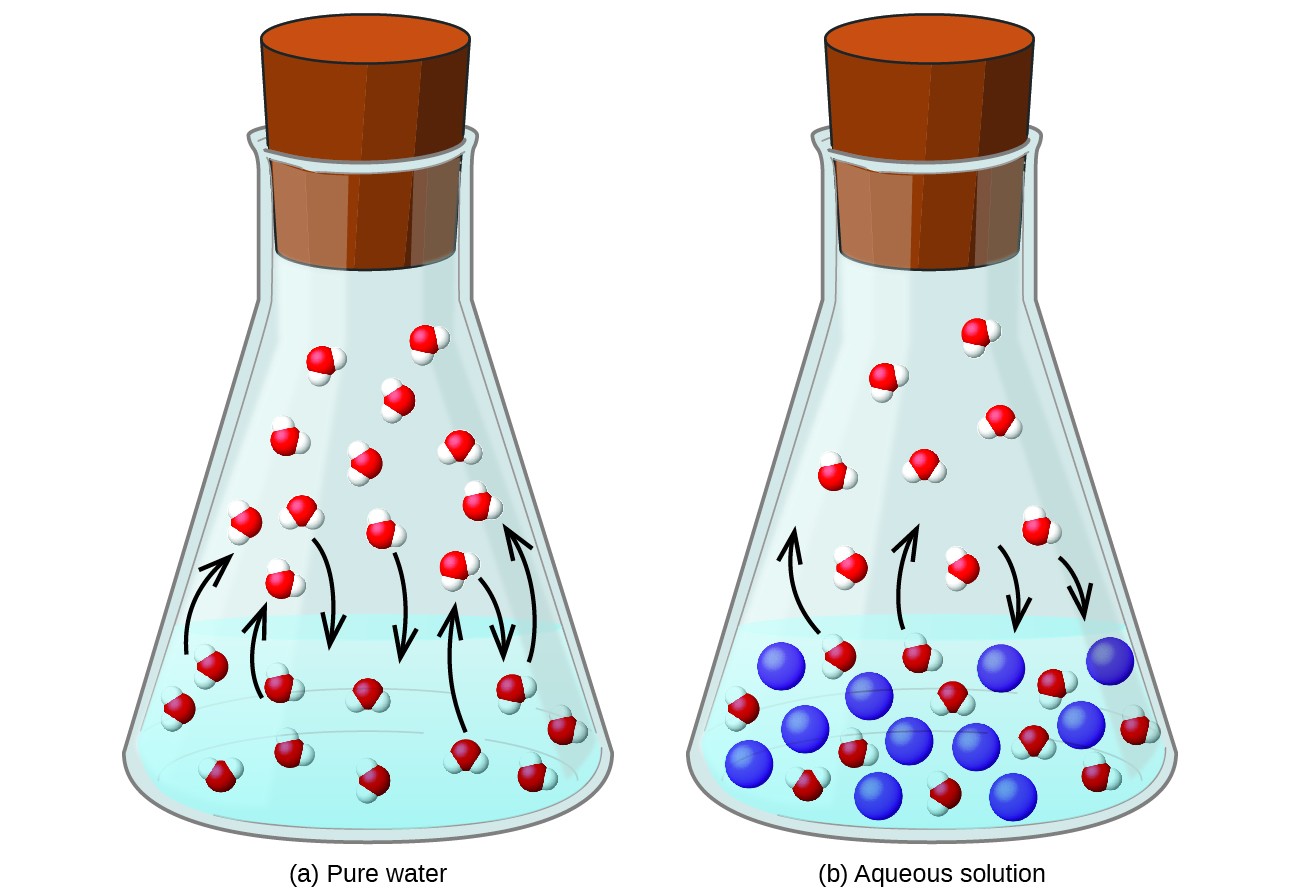
Figura 1. La presencia de solutos no volátiles reduce la presión de vapor de una solución al impedir la evaporación de las moléculas de solvente.
La relación entre las presiones de vapor de los componentes de la solución y las concentraciones de esos componentes se describen mediante la ley de Raoult: la presión parcial ejercida por cualquier componente de una solución ideal es igual a la presión de vapor del componente puro multiplicada por su fracción molar en la solución.
{P} _ {\ text {A}} = {X} _ {\ text {A}} {P} _ {\ text {A}} ^ {\ star}
Recordando que la presión total de una mezcla gaseosa es igual a la suma de las presiones parciales de todos sus componentes (ley de Dalton de las presiones parciales), la presión de vapor total ejercida por una solución que contiene i componentes es
{ P} _ {\ text {solución}} = \ sum _ {i} {P} _ {i} = \ sum _ {i} {X} _ {i} {P} _ {i} ^ {\ star}
Una sustancia no volátil es aquella cuya presión de vapor es insignificante (P ^ {\ star} ≈ 0), por lo que la presión de vapor por encima de una solución que contiene solo solutos no volátiles se debe únicamente al disolvente:
{P} _ {\ text {solución}} = {X} _ {\ text {solvente}} {P} _ {\ text {solvente}} ^ {\ star}
Destilación de soluciones
La destilación es una técnica para separar los componentes de mezclas que se aplica ampliamente tanto en el laboratorio como en entornos industriales. Se utiliza para refinar petróleo, aislar productos de fermentación y purificar agua. Esta técnica de separación implica el calentamiento controlado de una mezcla de muestra para vaporizar, condensar y recolectar selectivamente uno o más componentes de interés. En la Figura 2 se muestra un aparato típico para destilaciones a escala de laboratorio.

Figura 2. Una típica La unidad de destilación de laboratorio se muestra en (a) una fotografía y (b) un diagrama esquemático de los componentes. (crédito a: modificación del trabajo de «Rifleman82» / Wikimedia commons; crédito b: modificación del trabajo de «Slashme» / Wikipedia)
Las refinerías de petróleo utilizan destilación fraccionada a gran escala para separar los componentes del petróleo crudo. El petróleo crudo se calienta a altas temperaturas en la base de una columna de fraccionamiento alta, vaporizando muchos de los componentes que se elevan dentro de la columna. A medida que los componentes vaporizados alcanzan zonas adecuadamente frías durante su ascenso, se condensan y se recogen. Los líquidos recolectados son mezclas más simples de hidrocarburos y otros compuestos de petróleo que tienen una composición adecuada para diversas aplicaciones (por ejemplo, combustible diesel, queroseno, gasolina), como se muestra en la Figura 3.

Figura 3. El petróleo crudo es una mezcla compleja que se separa mediante destilación fraccionada a gran escala para aislar varias mezclas más simples.
Elevación del punto de ebullición
Como se describe en el capítulo sobre líquidos y sólidos, el punto de ebullición de un líquido es la temperatura a la que su presión de vapor es igual a la presión atmosférica ambiental.Dado que la presión de vapor de una solución se reduce debido a la presencia de solutos no volátiles, es lógico pensar que el punto de ebullición de la solución aumentará posteriormente. En comparación con el solvente puro, una solución, por lo tanto, requerirá una temperatura más alta para lograr cualquier presión de vapor dada, incluida una equivalente a la de la atmósfera circundante. El aumento del punto de ebullición observado cuando se disuelve un soluto no volátil en un disolvente, ΔTb, se denomina elevación del punto de ebullición y es directamente proporcional a la concentración molal de las especies de soluto:
\ Delta {T} _ {\ text {b}} = {K} _ {\ text {b}} m
donde Kb es la constante de elevación del punto de ebullición, o la constante ebullioscópica ym es la concentración molal (molalidad) de todas las especies de solutos.
Las constantes de elevación del punto de ebullición son propiedades características que dependen de la identidad del disolvente. Los valores de Kb para varios disolventes se enumeran en la Tabla 1.
La medida en que se reduce la presión de vapor de un disolvente y se eleva el punto de ebullición depende del número total de partículas de soluto presentes en una cantidad determinada de solvente, no en la masa o tamaño o identidades químicas de las partículas. Una solución acuosa de sacarosa de 1 m (342 g / mol) y una solución acuosa de etilenglicol (62 g / mol) de 1 m exhibirán el mismo punto de ebullición porque cada solución tiene un mol de partículas de soluto (moléculas) por kilogramo de disolvente. .
Ejemplo 6: El punto de ebullición de una solución de yodo
Encuentre el punto de ebullición de una solución de 92,1 g de yodo, I2, en 800,0 g de cloroformo, CHCl3 , asumiendo que el yodo no es volátil y que la solución es ideal.
Verifique su aprendizaje
¿Cuál es el punto de ebullición de una solución de 1.0 g de glicerina, C3H5 (OH) 3, en 47,8 g de agua? Suponga una solución ideal.
Depresión del punto de congelación

Figura 4. Sal de roca ( NaCl), cloruro de calcio (CaCl2) o una mezcla de los dos se utilizan para derretir hielo. (crédito: modificación del trabajo de Eddie Welker)
Las soluciones se congelan a temperaturas más bajas que los líquidos puros. Este fenómeno se explota en esquemas de «deshielo» que usan sal (Figura 4), cloruro de calcio o urea para derretir hielo en carreteras y aceras, y en el uso de etilenglicol como «anticongelante» en radiadores de automóviles. El agua de mar se congela a una temperatura más baja que el agua dulce, por lo que los océanos Ártico y Antártico permanecen descongelados incluso a temperaturas inferiores a 0 ° C (al igual que los fluidos corporales de los peces y otros animales marinos de sangre fría que viven en estos océanos).
La disminución del punto de congelación de una solución diluida en comparación con la del disolvente puro, ΔTf, se denomina depresión del punto de congelación y es directamente proporcional a la concentración molal del soluto
\ Delta {T} _ {\ text {f}} = {K} _ {\ text {f}} m
donde m es la concentración molal del soluto en el solvente y Kf se llama constante de depresión del punto de congelación (o constante crioscópica). Al igual que las constantes de elevación del punto de ebullición, se trata de propiedades características cuyos valores dependen de la identidad química del disolvente. Los valores de Kf para varios disolventes se enumeran en la Tabla 1.
Propiedades coligativas y deshielo
El cloruro de sodio y sus análogos del grupo 2, el cloruro de calcio y magnesio se utilizan a menudo para Deshielo de carreteras y aceras, debido a que una solución de cualquiera de estas sales tendrá un punto de congelación inferior a 0 ° C, el punto de congelación del agua pura. Las sales de metales del grupo 2 se mezclan con frecuencia con el cloruro de sodio («sal de roca») más barato y más disponible para su uso en carreteras, ya que tienden a ser algo menos corrosivas que el NaCl y proporcionan una depresión mayor del punto de congelación. , ya que se disocian para producir tres partículas por unidad de fórmula, en lugar de dos partículas como el cloruro de sodio.
Debido a que estos compuestos iónicos tienden a acelerar la corrosión del metal, no sería una buena elección usarlos en anticongelante para el radiador de su automóvil o para descongelar un avión antes del despegue.Para estas aplicaciones, a menudo se utilizan compuestos covalentes, como etileno o propilenglicol. Los glicoles utilizados en el líquido del radiador no solo reducen el punto de congelación del líquido, sino que también elevan el punto de ebullición, lo que hace que el líquido sea útil tanto en invierno como en verano. Los glicoles calentados a menudo se rocían sobre la superficie de los aviones antes del despegue en condiciones climáticas adversas en el invierno para eliminar el hielo que ya se ha formado y evitar la formación de más hielo, que sería particularmente peligroso si se forma en las superficies de control de la aeronave (Figura 5).

Figura 5. La depresión del punto de congelación se explota para eliminar el hielo de (a) carreteras y (b) las superficies de control de la aeronave.
Diagrama de fase para una solución
Los efectos coligativos sobre la presión de vapor, el punto de ebullición y el punto de congelación descritos en la sección anterior se resumen convenientemente comparando los diagramas de fase para un líquido puro y una solución derivada de ese líquido. Los diagramas de fase para el agua y una solución acuosa se muestran en la Figura 6.
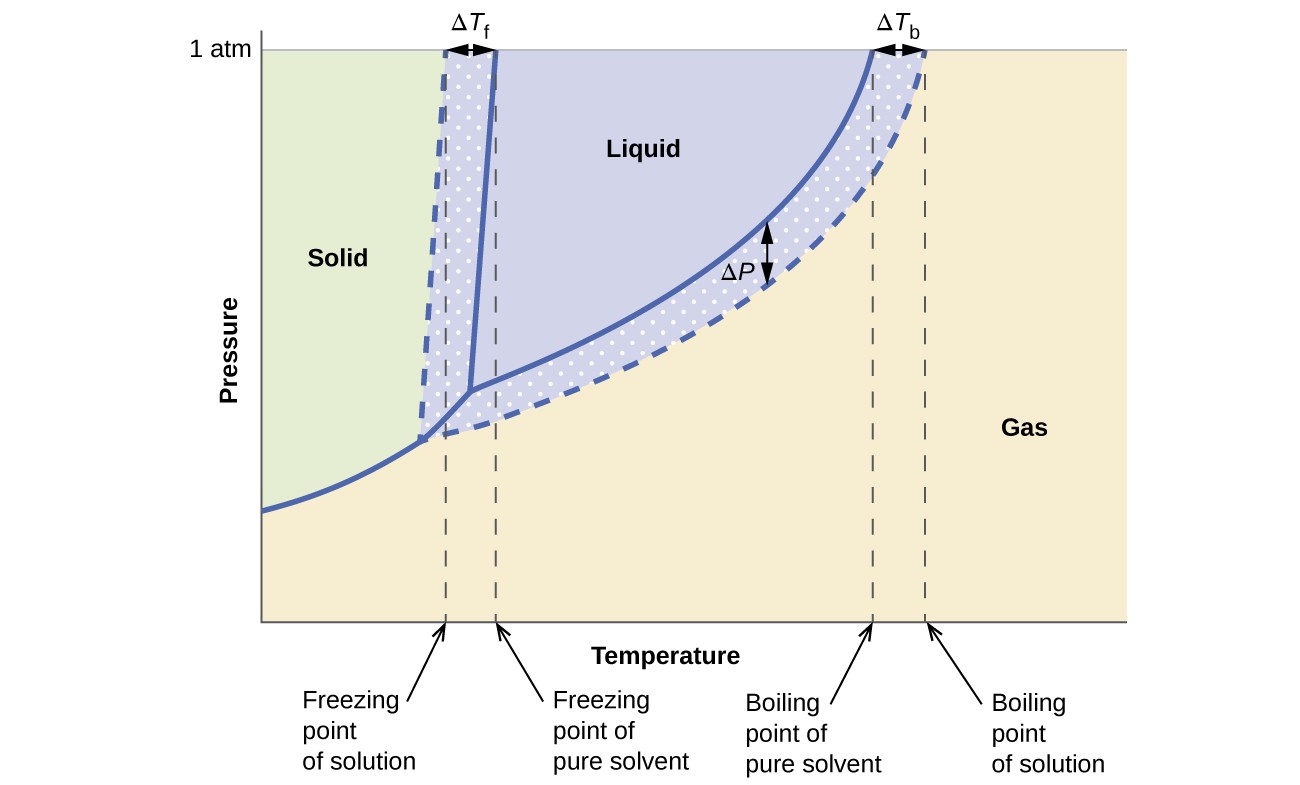
Figura 6. Estas fases Los diagramas muestran agua (curvas sólidas) y una solución acuosa de no electrolito (curvas discontinuas).
La curva líquido-vapor para la solución se encuentra debajo de la curva correspondiente para el solvente, representando el vapor disminución de la presión, ΔP, que resulta de la disolución del soluto no volátil. En consecuencia, a cualquier presión dada, el punto de ebullición de la solución se observa a una temperatura más alta que la del disolvente puro, lo que refleja la elevación del punto de ebullición, ΔTb, asociada con la presencia de soluto no volátil. La curva sólido-líquido de la solución se desplaza a la izquierda de la del disolvente puro, lo que representa la depresión del punto de congelación, ΔTb, que acompaña a la formación de la solución. Finalmente, observe que las curvas de sólido-gas para el solvente y su solución son idénticas. Este es el caso de muchas soluciones que comprenden disolventes líquidos y solutos no volátiles. Al igual que con la vaporización, cuando una solución de este tipo se congela, en realidad son solo las moléculas de solvente las que experimentan la transición de líquido a sólido, formando solvente sólido puro que excluye las especies de soluto. Las fases sólida y gaseosa, por lo tanto, están compuestas únicamente por solventes, por lo que las transiciones entre estas fases no están sujetas a efectos coligativos.
Ósmosis y presión osmótica de soluciones
Una serie de soluciones naturales y los materiales sintéticos exhiben permeación selectiva, lo que significa que solo moléculas o iones de cierto tamaño, forma, polaridad, carga, etc., son capaces de atravesar (permear) el material. Las membranas celulares biológicas proporcionan elegantes ejemplos de permeación selectiva en la naturaleza, mientras que los tubos de diálisis utilizados para eliminar los desechos metabólicos de la sangre son un ejemplo tecnológico más simplista. Independientemente de cómo se puedan fabricar, estos materiales generalmente se denominan membranas semipermeables.
Considere el aparato ilustrado en la Figura 7, en el que las muestras de disolvente puro y una solución se separan mediante una membrana que solo contiene disolvente las moléculas pueden penetrar. Las moléculas de disolvente se difundirán a través de la membrana en ambas direcciones. Dado que la concentración de disolvente es mayor en el disolvente puro que en la solución, estas moléculas se difundirán desde el lado del disolvente de la membrana al lado de la solución a una velocidad más rápida que en la dirección inversa. El resultado es una transferencia neta de moléculas de disolvente del disolvente puro a la solución. La transferencia de moléculas de disolvente impulsada por difusión a través de una membrana semipermeable es un proceso conocido como ósmosis.
Figura 7. (a) Una solución y un disolvente puro se separan inicialmente mediante una membrana osmótica. (b) La transferencia neta de moléculas de solvente a la solución ocurre hasta que su presión osmótica produce tasas iguales de transferencia en ambas direcciones.
Cuando la ósmosis se lleva a cabo en un aparato como el que se muestra en la Figura 7 , el volumen de la solución aumenta a medida que se diluye por acumulación de disolvente. Esto hace que el nivel de la solución aumente, aumentando su presión hidrostática (debido al peso de la columna de solución en el tubo) y dando como resultado una transferencia más rápida de las moléculas de solvente al lado del solvente puro. Cuando la presión alcanza un valor que produce una tasa de transferencia de solvente inversa igual a la tasa de ósmosis, cesa la transferencia de solvente en masa. Esta presión se llama presión osmótica (Π) de la solución. La presión osmótica de una solución diluida está relacionada con su molaridad de soluto, M, y la temperatura absoluta, T, según la ecuación
\ Pi = MRT
donde R es la constante de gas universal.
Si se coloca una solución en un aparato como el que se muestra en la Figura 8, la aplicación de una presión mayor que la presión osmótica de la solución invierte la ósmosis y empuja las moléculas de disolvente de la solución al disolvente puro. Esta técnica de ósmosis inversa se utiliza para la desalinización a gran escala de agua de mar y en escalas más pequeñas para producir agua del grifo de alta pureza para beber.
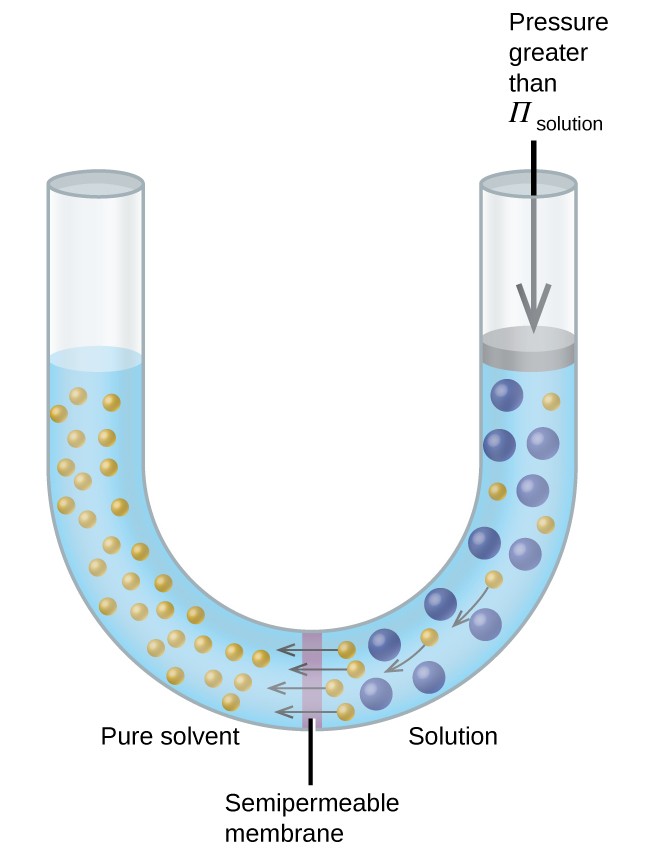
Figura 8. Aplicar una presión mayor que la presión osmótica de una solución revertirá la ósmosis. Las moléculas de disolvente de la solución se introducen en el disolvente puro.
Purificación de agua por ósmosis inversa
En el proceso de ósmosis, la difusión sirve para mover el agua a través de un membrana semipermeable de una solución menos concentrada a una solución más concentrada. La presión osmótica es la cantidad de presión que se debe aplicar a la solución más concentrada para detener la ósmosis. Si se aplica una mayor presión, el agua pasará de la solución más concentrada a una solución menos concentrada (más pura). A esto se le llama ósmosis inversa. La ósmosis inversa (RO) se utiliza para purificar el agua en muchas aplicaciones, desde plantas de desalinización en ciudades costeras hasta máquinas purificadoras de agua en tiendas de comestibles (Figura 9) y unidades domésticas de ósmosis inversa más pequeñas. Con una bomba manual, las pequeñas unidades de ósmosis inversa se pueden utilizar en países del tercer mundo, áreas de desastre y en botes salvavidas. Nuestras fuerzas militares tienen una variedad de unidades RO operadas por generadores que se pueden transportar en vehículos a ubicaciones remotas.

Figura 9. Los sistemas de ósmosis inversa para purificar el agua potable se muestran aquí en (a) escalas pequeñas y (b) grandes. (crédito a: modificación del trabajo de Jerry Kirkhart; crédito b: modificación del trabajo de Willard J. Lathrop)
Los ejemplos de ósmosis son evidentes en muchos sistemas biológicos porque las células son rodeada de membranas semipermeables. Las zanahorias y el apio que se han debilitado porque han perdido agua pueden volverse crujientes colocándolos en agua. El agua entra en las células de la zanahoria o el apio por ósmosis. Un pepino colocado en una solución de sal concentrada pierde agua por ósmosis y absorbe un poco de sal para convertirse en un pepinillo. La ósmosis también puede afectar a las células animales. Las concentraciones de solutos son particularmente importantes cuando las soluciones se inyectan en el cuerpo. Los solutos en los fluidos de las células corporales y el suero sanguíneo dan a estas soluciones una presión osmótica de aproximadamente 7,7 atm. Las soluciones inyectadas en el cuerpo deben tener la misma presión osmótica que el suero sanguíneo; es decir, deben ser isotónicos con el suero sanguíneo. Si se inyecta una solución menos concentrada, una solución hipotónica, en cantidad suficiente para diluir el suero sanguíneo, el agua del suero diluido pasa a las células sanguíneas por ósmosis, lo que hace que las células se expandan y se rompan. Este proceso se llama hemólisis. Cuando se inyecta una solución más concentrada, una solución hipertónica, las células pierden agua a la solución más concentrada, se marchitan y posiblemente mueren en un proceso llamado formación de crianza. Estos efectos se ilustran en la Figura 10.
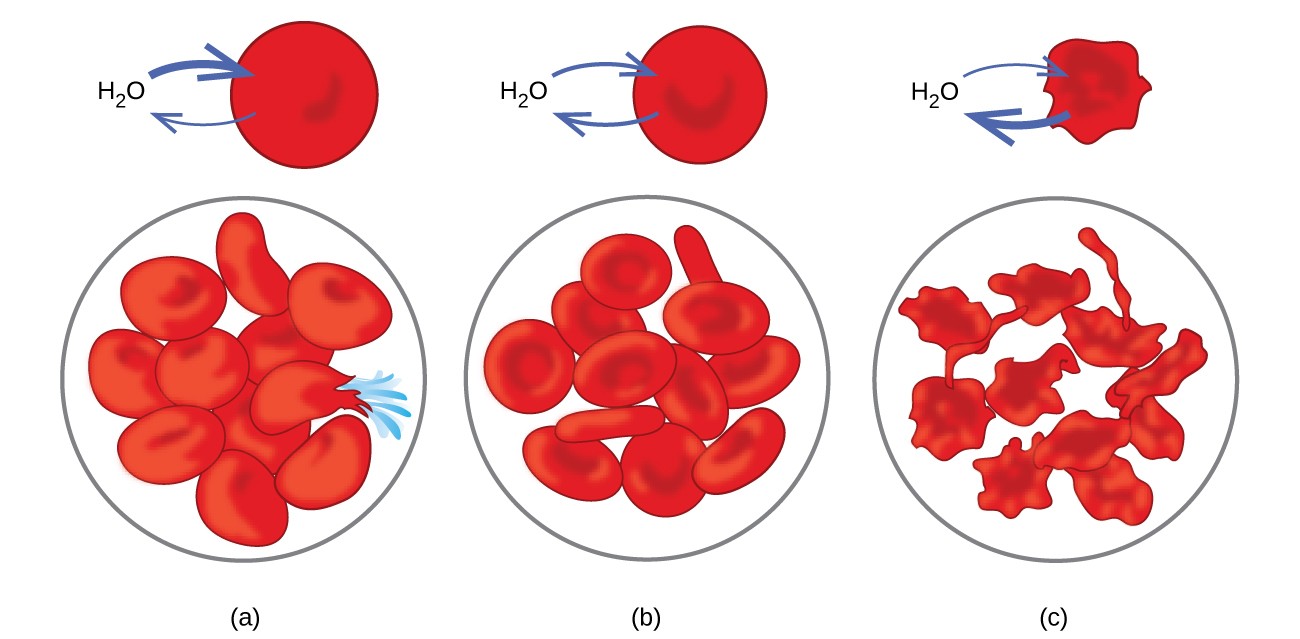
Figura 10. Las membranas de los glóbulos rojos son permeables al agua y (a) se hinchará y posiblemente se romperá en una solución hipotónica; (b) mantener el volumen y la forma normales en una solución isotónica; y (c) marchitarse y posiblemente morir en una solución hipertónica. (crédito a / b / c: modificaciones del trabajo de «LadyofHats» / Wikimedia commons)
Determinación de masas molares
Presión osmótica y cambios en el punto de congelación, ebullición punto, y la presión de vapor son directamente proporcionales a la concentración de soluto presente. En consecuencia, podemos usar una medición de una de estas propiedades para determinar la masa molar del soluto a partir de las mediciones.
Propiedades coligativas de los electrolitos
Como se señaló anteriormente en este módulo, las propiedades coligativas de una solución dependen solo del número, no de la identidad, de las especies de soluto disueltas. Los términos de concentración en las ecuaciones para varias propiedades coligativas (depresión del punto de congelación , elevación del punto de ebullición, presión osmótica) pertenecen a todas las especies de solutos presentes en la solución. Para las soluciones consideradas hasta ahora en este capítulo, los solutos han sido no electrolitos que se disuelven físicamente sin disociación o cualquier otro proceso acompañante. le que se disuelve produce una molécula de soluto disuelta. Sin embargo, la disolución de un electroito no es tan simple, como lo ilustran los dos ejemplos comunes a continuación:
Considerando el primero de estos ejemplos, y asumiendo una disociación completa, una solución acuosa de NaCl de 1.0 m contiene 2.0 moles de iones (1.0 mol de Na + y 1.0 mol Cl−) por cada kilogramo de agua, y se espera que la depresión del punto de congelación sea
Sin embargo, cuando esta solución está realmente preparada y se mide la depresión del punto de congelación, se obtiene un valor de 3.4 ° C. Se observan discrepancias similares para otros compuestos iónicos, y las diferencias entre los valores de propiedad coligativos medidos y esperados suelen volverse más significativas a medida que aumentan las concentraciones de soluto. Estas observaciones sugieren que los iones de cloruro de sodio (y otros electrolitos fuertes) no están completamente disociados en solución.
Para tener en cuenta esto y evitar los errores que acompañan al supuesto de disociación total, un parámetro medido experimentalmente llamado en Se utiliza el honor del químico alemán Jacobus Henricus van’t Hoff, ganador del Premio Nobel. El factor de van’t Hoff (i) se define como la relación entre las partículas de soluto en solución y el número de unidades de fórmula disueltas:
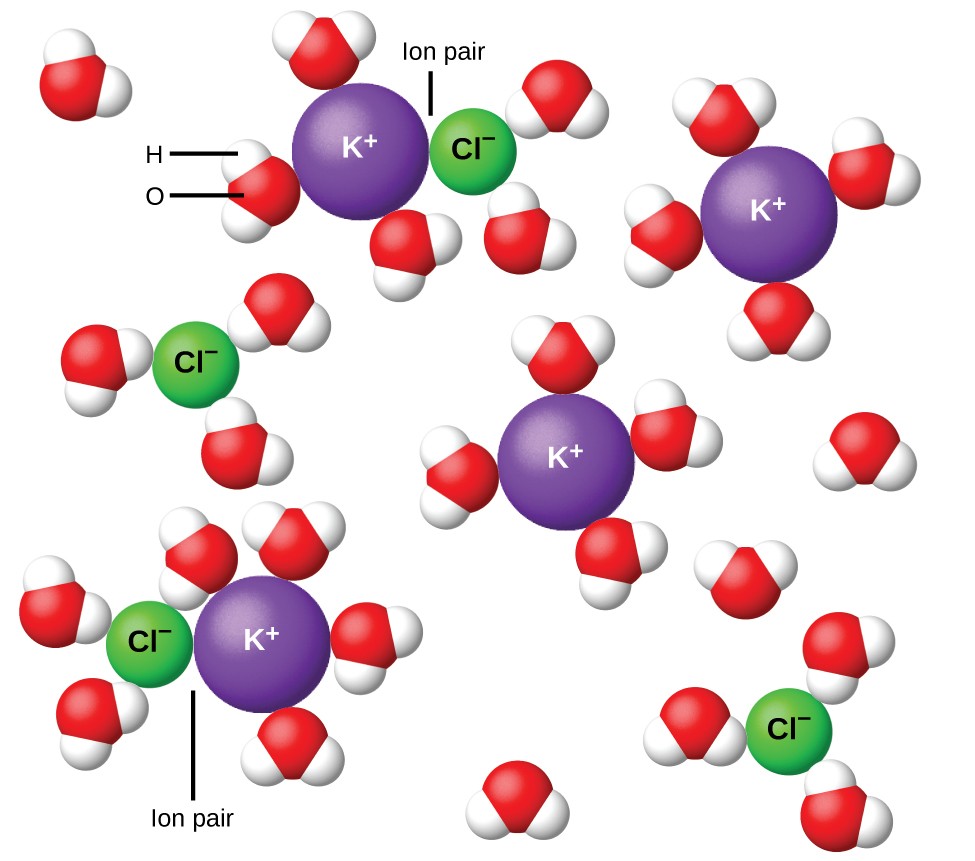
Figura 11. Los iones se separan cada vez más a medida que se diluye la solución, y las atracciones interiónicas residuales disminuyen.
En 1923, los químicos Peter Debye y Erich Hückel propusieron una teoría para explicar la aparente ionización incompleta de electrolitos fuertes. Sugirieron que aunque la atracción interiónica en una solución acuosa se reduce en gran medida por la solvatación de los iones y la acción aislante del disolvente polar, no se anula por completo. Las atracciones residuales evitan que los iones se comporten como partículas totalmente independientes (Figura 11). En algunos casos, un ión positivo y negativo pueden tocarse, dando una unidad solvatada llamada par de iones. Por tanto, la actividad, o la concentración eficaz, de cualquier tipo particular de ion es menor que la indicada por la concentración real. Los iones se separan cada vez más a medida que se diluye la solución, y las atracciones interiónicas residuales se vuelven cada vez menores. Así, en soluciones extremadamente diluidas, las concentraciones efectivas de los iones (sus actividades) son esencialmente iguales a las concentraciones reales. Tenga en cuenta que los factores de van’t Hoff para los electrolitos en la Tabla 2 son para soluciones de 0.05 m, a cuya concentración el valor de i para NaCl es 1.9, en contraposición a un valor ideal de 2.
Ejemplo 11: El punto de congelación de una solución de un electrolito
La concentración de iones en el agua de mar es aproximadamente la misma que en una solución que contiene 4,2 g de NaCl disueltos en 125 g de agua. Suponga que cada uno de los iones en la solución de NaCl tiene el mismo efecto sobre el punto de congelación del agua que una molécula no electrolítica y determine la temperatura de congelación de la solución (que es aproximadamente igual a la temperatura de congelación del agua de mar).
Verifique su aprendizaje
Suponga que cada uno de los iones en el cloruro de calcio, CaCl2, tiene el mismo efecto sobre el punto de congelación del agua que una molécula no electrolítica. Calcula el punto de congelación de una solución de 0.724 g de CaCl2 en 175 g de agua.
Pruébelo
- La carne se puede clasificar como fresca (no congelada) aunque se almacene a −1 ° C. ¿Por qué no se congelaría la carne a esta temperatura?
- Un compuesto orgánico tiene una composición de 93.46% C y 6.54% H en masa. Una solución de 0.090 g de este compuesto en 1.10 g de alcanfor se funde a 158.4 ° C. El punto de fusión del alcanfor puro es de 178,4 ° C. Kf para alcanfor es 37,7 ° C / m. ¿Cuál es la fórmula molecular del soluto? Muestre sus cálculos.
- Se sabe que una sal es un fluoruro de metal alcalino. Una rápida determinación aproximada del punto de congelación indica que 4 g de sal disueltos en 100 g de agua producen una solución que se congela a aproximadamente -1,4 ° C. ¿Cuál es la fórmula de la sal? Muestra tus cálculos.
Glosario
actividad: concentración efectiva de iones en solución; es menor que la concentración real, debido a interacciones iónicas.
Elevación del punto de ebullición: elevación del punto de ebullición de un líquido mediante la adición de un soluto
constante de elevación del punto de ebullición: la constante de proporcionalidad en la ecuación que relaciona la elevación del punto de ebullición con la molalidad del soluto; también conocida como la constante ebulloscópica
propiedad coligativa: propiedad de una solución que depende únicamente de la concentración de una especie de soluto
creación: proceso por el cual las células biológicas se arrugan debido a la pérdida de agua por ósmosis
Depresión del punto de congelación: disminución del punto de congelación de un líquido mediante la adición de un soluto
Constante de depresión del punto de congelación: (también, constante crioscópica) constante de proporcionalidad en la ecuación relativa depresión del punto de congelación a la molalidad del soluto
hemólisis: rotura de los glóbulos rojos debido a la acumulación de exceso de agua por ósmosis
hipertónica: de mayor presión osmótica
hipotónica : de menor presión osmótica
par de iones: par de aniones / cationes solvatados que se mantienen unidos por una atracción electrostática moderada
isotónico: de igual presión osmótica
molalidad (m) : unidad de concentración definida como la relación entre el número de moles de soluto y la masa del solvente en kilogramos
fracción molar (X): la relación entre la cantidad molar de un componente de la solución y el número total de moles de todos los componentes de la solución
ósmosis: difusión de moléculas de disolvente a través de una membrana semipermeable
presión osmótica (Π ): presión opuesta requerida para evitar la transferencia masiva de moléculas de solvente a través de una membrana semipermeable
Ley de Raoult: la presión parcial ejercida por un componente en solución es igual al producto de la fracción molar del componente en la solución y su equilibrio presión de vapor en estado puro
membrana semipermeable: una membrana que permite selectivamente el paso de ciertos iones o moléculas
factor de van’t Hoff (i): la relación entre el número de moles de partículas en una solución al número de moles de unidades de fórmula disueltas en la solución
- Se muestra un no electrolito para comparación. ↵

