Inflamación intravascular maligna
La sepsis se ha denominado un proceso de inflamación intravascular maligna . Normalmente, una cascada inmunológica compleja y potente asegura una respuesta protectora rápida a la invasión de microorganismos en humanos. Una defensa inmunológica deficiente puede permitir que se establezca la infección; sin embargo, una respuesta excesiva o mal regulada puede dañar al huésped a través de la liberación desadaptativa de compuestos inflamatorios generados de forma autóctona (ver la imagen a continuación).
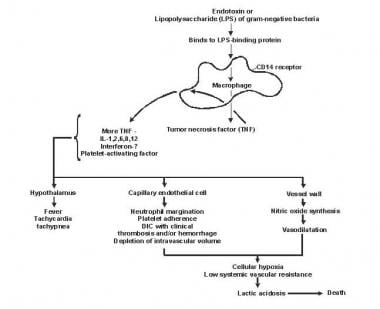 Patogenia de la sepsis y el fallo multiorgánico.
Patogenia de la sepsis y el fallo multiorgánico. El lípido A y otros productos bacterianos liberan citocinas y otros inmunomoduladores que median las manifestaciones clínicas de la sepsis. Las interleucinas, el factor de necrosis tumoral (TNF) -α, el interferón gamma (IFN-γ) y otros factores estimulantes de colonias se producen rápidamente en minutos u horas después de las interacciones de los monocitos y macrófagos con el lípido A.
La liberación de mediadores inflamatorios se convierte en un proceso autoestimulante y la liberación de otros mediadores como la interleucina (IL) -1, factor activador de plaquetas, IL-2, IL-6, IL-8, IL-10 y óxido nítrico (NO), aumenta aún más los niveles de citocinas. Esto conduce a la activación continua de leucocitos polimorfonucleares (PMN), macrófagos y linfocitos; los mediadores proinflamatorios reclutan más de estas células. Todos estos procesos crean un estado de disonancia inmunológica destructiva.
La sepsis se describe como un proceso autodestructivo que permite la extensión de la respuesta fisiopatológica normal a la infección para involucrar tejidos y resultados que de otro modo serían normales en MODS. La disfunción o insuficiencia orgánica puede ser el primer signo clínico de sepsis, y ningún sistema de órganos es inmune a las consecuencias de los excesos inflamatorios de la sepsis. La mortalidad aumenta a medida que aumenta la insuficiencia orgánica.
Aunque no se controla, una vez que el MODS se desarrolla, por lo general hay evidencia sistémica de regulación positiva tanto proinflamatoria como antiinflamatoria, lo que sugiere que falla la homeostasis de la defensa del huésped es la vía final de la sepsis a MODS, en lugar de una simple lesión de órganos diana inducida por hipotensión, como puede ocurrir con el shock hemorrágico. La supervivencia de la sepsis grave con MODS generalmente se asocia con una reducción generalizada de la respuesta proinflamatoria y antiinflamatoria.
Recientemente ha surgido una nueva hipótesis de que la supervivencia de la sepsis grave requiere un regulación a la baja generalizada de la respuesta inmune del cuerpo, funciones energéticas y desempeño orgánico asociado. Por lo tanto, MODS puede ser debido a la respuesta adaptativa del huésped a una inflamación abrumadora, permitiendo que la inflamación desaparezca sin causar daño permanente a los órganos terminales. Como se analiza a continuación, todos los órganos revelan una hiporreactividad generalizada que es claramente anormal en la salud, pero que puede marcar una estrategia de supervivencia en la sepsis grave.
Disfunción de los sistemas de órganos
Trastorno circulatorio
Un trastorno significativo en la autorregulación de la circulación es típico de la sepsis. Los mediadores vasoactivos provocan vasodilatación y aumentan la permeabilidad microvascular en el sitio de la infección. El NO juega un papel central en la vasodilatación del shock séptico. Además, puede producirse una alteración de la secreción de vasopresina, lo que puede permitir la persistencia de la vasodilatación.
En la sepsis se producen cambios en la función ventricular tanto sistólica como diastólica. Mediante el uso del mecanismo de Frank-Starling, el gasto cardíaco a menudo aumenta para mantener la presión arterial en presencia de vasodilatación sistémica. Los pacientes con enfermedad cardíaca preexistente no pueden aumentar su gasto cardíaco de manera adecuada.
A nivel regional, la sepsis interfiere con la distribución normal del flujo sanguíneo sistémico a los sistemas de órganos. En consecuencia, es posible que los órganos centrales no reciban el suministro de oxígeno adecuado y el resultado es lo que se conoce como hipoperfusión regional.
La microcirculación es el órgano diana clave para la lesión en la sepsis, ya que el endotelio vascular es universalmente afectado por los mediadores inflamatorios circulantes. Aunque no está claro si las anomalías microcirculatorias son la causa o un espectador inocente de la lesión del órgano terminal, se observa una clara disfunción microvascular. Se observa una disminución en el número de capilares perfundidos, aunque con la aplicación de terapias vasodilatadoras se produce un reclutamiento microvascular completo. La disfunción mitocondrial también ocurre y a menudo se asocia con gradientes de potencial transmembrana mitocondrial reducidos, que son necesarios para impulsar la fosforilación oxidativa. El resultado final es una aparente incapacidad de los órganos terminales para extraer oxígeno al máximo.
Continúa el debate sobre si esta falla del metabolismo energético es un mecanismo citoprotector adaptativo similar a la hibernación o refleja una patología mitocondrial primaria. Estas son áreas de investigación activa, pero actualmente no se traducen en guías claras de práctica clínica. El aumento de la permeabilidad endotelial capilar conduce a un edema tisular rico en proteínas generalizado.
El shock séptico y el SRIS se caracterizan por depresión miocárdica reversible, que puede resultar resistente a la administración de catecolaminas y líquidos. El «factor depresor miocárdico» circulante, que probablemente representa los efectos sinérgicos del TNF-α, IL-1β, otras citocinas y NO, está implicado en la patogénesis. Las dos características de esta depresión miocárdica por estrés agudo son la alteración de la capacidad de respuesta adrenérgica y la disfunción diastólica que conduce a resistencia relativa a las catecolaminas y corazones pequeños en lugar de dilatados. La isquemia miocárdica macrovascular y la hipoperfusión son contribuyentes poco probables.
En la sepsis grave y el choque séptico, la disfunción microcirculatoria y la depresión mitocondrial provocan alteración tisular regional, y, por lo tanto, persiste la disoxia regional. Esta afección se denomina síndrome de distrés microcirculatorio y mitocondrial (MMDS). La disfunción autorreguladora inflamatoria inducida por sepsis persiste y la necesidad de oxígeno no se corresponde con el suministro, lo que lleva a MODS.
Redistribución del volumen de líquido intravascular resultante de la reducción del tono vascular arterial, disminución del retorno venoso de la di y la liberación de sustancias depresoras del miocardio provoca hipotensión.
Disfunción pulmonar
La lesión endotelial en la vasculatura pulmonar conduce a alteraciones flujo sanguíneo capilar y mayor permeabilidad microvascular, lo que resulta en edema intersticial y alveolar. El atrapamiento de neutrófilos dentro de la microcirculación pulmonar inicia y amplifica la lesión de las membranas capilares alveolares. La lesión pulmonar aguda y el síndrome de dificultad respiratoria aguda (SDRA) son manifestaciones frecuentes de estos efectos. De hecho, la sepsis y la neumonía son las causas más comunes de SDRA.
Disfunción gastrointestinal
El tracto gastrointestinal (GI) puede ayudar a propagar la lesión de la sepsis. El crecimiento excesivo de bacterias en el tracto GI superior puede ser aspirado hacia los pulmones, produciendo neumonía nosocomial o por aspiración. La función de barrera normal del intestino puede verse afectada, lo que permite la translocación de bacterias, endotoxinas y proteasas digestivas normales a la circulación sistémica y prolonga la respuesta séptica.
El shock séptico puede causar íleo paralítico que puede provocar un retraso en el establecimiento de la alimentación enteral. Se cree que el exceso de producción de NO es el agente causante del íleo inducido por sepsis. El nivel óptimo de ingesta nutricional se ve obstaculizado ante los altos requisitos de proteínas y calorías. Los narcóticos y relajantes musculares pueden empeorar aún más la motilidad del tracto gastrointestinal.
Disfunción hepática
Como consecuencia de la función que desempeña el hígado en la defensa del huésped, las funciones sintéticas anormales causadas por la disfunción hepática pueden contribuir tanto al inicio como a la progresión de la sepsis. El sistema reticuloendotelial del hígado actúa como una primera línea de defensa para eliminar las bacterias y sus productos; La disfunción hepática conduce a un derrame de estos productos a la circulación sistémica.
La insuficiencia hepática («hígado conmocionado») puede manifestarse por elevaciones de las enzimas hepáticas y bilirrubina, defectos de coagulación y incapacidad para excretar toxinas como el amoníaco, lo que conduce a un empeoramiento de la encefalopatía.
Disfunción renal
Lesión renal aguda (AKI) a menudo acompaña a la sepsis. Se han informado diferentes etiologías de IRA, y normalmente se piensa que la causa es multifactorial. El mecanismo de la IRA es complejo, pero probablemente implica una disminución del volumen intravascular efectivo resultante de hipotensión sistémica, vasoconstricción renal directa, liberación de citocinas, y la activación de neutrófilos por endotoxinas y otros péptidos, que contribuyen a la lesión renal. Aún así, la mayoría de los estudios en animales muestran que el flujo sanguíneo renal aumenta, no disminuye, en la sepsis, aunque se asocia con una función tubular deteriorada y una falta de evidencia histológica significativa de tu lesión bular.
Disfunción del sistema nervioso central
La participación del sistema nervioso central (SNC) en la sepsis produce encefalopatía y neuropatía. La patogenia está mal definida, pero probablemente esté relacionada con hipotensión sistémica, que puede conducir a hipoperfusión cerebral.
Coagulopatía
Coagulopatía subclínica, señalada por una leve elevación del tiempo de trombina (TT) o tiempo de tromboplastina parcial activada (aPTT) o una reducción moderada en el recuento de plaquetas, es extremadamente común; sin embargo, también se puede desarrollar coagulación intravascular diseminada manifiesta (CID). Los receptores activados por proteasa (PAR), especialmente el PAR 1, forman el vínculo molecular entre la coagulación y la inflamación; PAR1 ejerce efectos citoprotectores cuando es estimulado por proteína C activada o trombina en dosis bajas, pero ejerce efectos disruptivos sobre la función de barrera de las células endoteliales cuando se activa con trombina en dosis altas.
Mecanismos de disfunción y lesión de órganos
Los mecanismos precisos de la lesión celular y la disfunción de órganos resultante en la sepsis no se comprenden completamente. La MODS se asocia con una lesión generalizada de las células endoteliales y parenquimatosas, algunas de las cuales pueden explicarse por los siguientes 4 mecanismos propuestos.
Hipoxia hipóxica
La lesión séptica circulatoria interrumpe la oxigenación de los tejidos, altera la regulación metabólica del suministro de oxígeno a los tejidos y contribuye a la disfunción de los órganos. Las anomalías microvasculares y endoteliales contribuyen al defecto microcirculatorio séptico en la sepsis. Las especies reactivas de oxígeno, las enzimas líticas y las sustancias vasoactivas (p. Ej., NO y factores de crecimiento endotelial) provocan una lesión microcirculatoria, que se agrava por la incapacidad de los eritrocitos para navegar por la microcirculación séptica.
Citotoxicidad directa
La endotoxina, el TNF-α y el NO pueden dañar el transporte de electrones mitocondrial y provocar un metabolismo energético desordenado. Esto se llama anoxia citopática o histotóxica, una incapacidad para utilizar el oxígeno incluso cuando está presente.
Apoptosis
Apoptosis ( muerte celular programada) es el mecanismo principal por el cual las células disfuncionales se eliminan normalmente. Las citocinas proinflamatorias pueden retrasar la apoptosis en macrófagos y neutrófilos activados, pero otros tejidos (p. Ej., Epitelio intestinal) pueden sufrir apoptosis acelerada. Por lo tanto, el trastorno de la apoptosis juega un papel crítico en la lesión tisular de la sepsis.
Inmunosupresión
La interacción entre proinflamatorios y los mediadores antiinflamatorios pueden provocar un desequilibrio entre ellos. Puede predominar una reacción inflamatoria o una inmunodeficiencia, o ambas pueden estar presentes.
Respuesta del huésped y otros factores que influyen en el resultado
Características clínicas que se relacionan con la gravedad de sepsis incluyen la respuesta del huésped a la infección, el sitio y el tipo de infección, el momento y el tipo de terapia antimicrobiana, el organismo causante, el desarrollo del shock, la enfermedad subyacente, el estado de salud a largo plazo del paciente y el número de órganos. Los factores que conducen a la sepsis y al shock séptico pueden no ser esenciales para determinar el resultado final.
La respuesta del huésped a la sepsis se caracteriza tanto por respuestas proinflamatorias como por respuestas inmunosupresoras antiinflamatorias. La dirección, extensión y duración de estas reacciones están determinadas por factores del hospedador (p. Ej., Características genéticas, edad, enfermedades coexistentes, medicamentos) y factores patógenos (p. Ej., Carga microbiana, virulencia).
Las respuestas inflamatorias se inician por la interacción entre los patrones moleculares asociados a patógenos expresados por patógenos y los receptores de reconocimiento de patrones expresados por las células huésped en la superficie celular (receptores tipo Toll y receptores tipo C receptores de lectina), en el endosoma (TLR) o en el citoplasma (receptores similares al gen 1 inducibles por ácido retinoico y receptores similares al dominio de oligomerización de unión a nucleótidos).
La consecuencia de una inflamación exagerada es el daño tisular colateral y la muerte celular necrótica, que da como resultado la liberación de patrones moleculares asociados al daño, las llamadas moléculas peligrosas que perpetúan la inflamación al menos en parte actuando sobre los mismos receptores de reconocimiento de patrones activados por patógenos.