Gőznyomáscsökkentés
A folyadékokról és szilárd anyagokról szóló fejezetben leírtak szerint a folyadék egyensúlyi gőznyomása a gáz halmazállapotú nyomása. szakasz, amikor a párolgás és a páralecsapódás egyenlő sebességgel történik:
\ text {liquid} \ rightleftharpoons \ text {gas}
Nem illékony anyag feloldása illékony folyadékban a folyadék gőznyomásának csökkenését eredményezi. Ez a jelenség racionalizálható, ha figyelembe vesszük a hozzáadott oldott molekulák hatását a folyadék párolgási és kondenzációs folyamataira. A párologtatáshoz oldószermolekuláknak kell lenniük az oldat felületén. Az oldott anyag jelenléte csökkenti az oldószermolekulák számára elérhető felületet, és ezáltal csökkenti az oldószer párolgásának sebességét. Mivel az oldott anyag jelenléte a kondenzáció sebességét nem befolyásolja, a nettó eredmény az, hogy a párolgási-kondenzációs egyensúly kevesebb oldószer-molekulával érhető el a gőzfázisban (azaz alacsonyabb gőznyomás mellett) (1. ábra). Bár ez a kinetikus értelmezés hasznos, nem veszi figyelembe a gőznyomáscsökkentés kolligatív jellegének számos fontos szempontját. A szigorúbb magyarázat magában foglalja az entrópia tulajdonságát, amely egy későbbi, a termodinamikáról szóló szöveges fejezet vita tárgyát képezi. A folyadék gőznyomásának csökkenésének megértése érdekében helyénvaló megjegyezni, hogy az oldat nagyobb entrópiája, külön oldószeréhez és oldott anyagához képest, az oldószermolekulák hatékony stabilizálását és azok párolgásának megakadályozását szolgálja. Alacsonyabb gőznyomás, és ennek megfelelően magasabb forráspontú, amint azt a modul következő szakasza leírja.
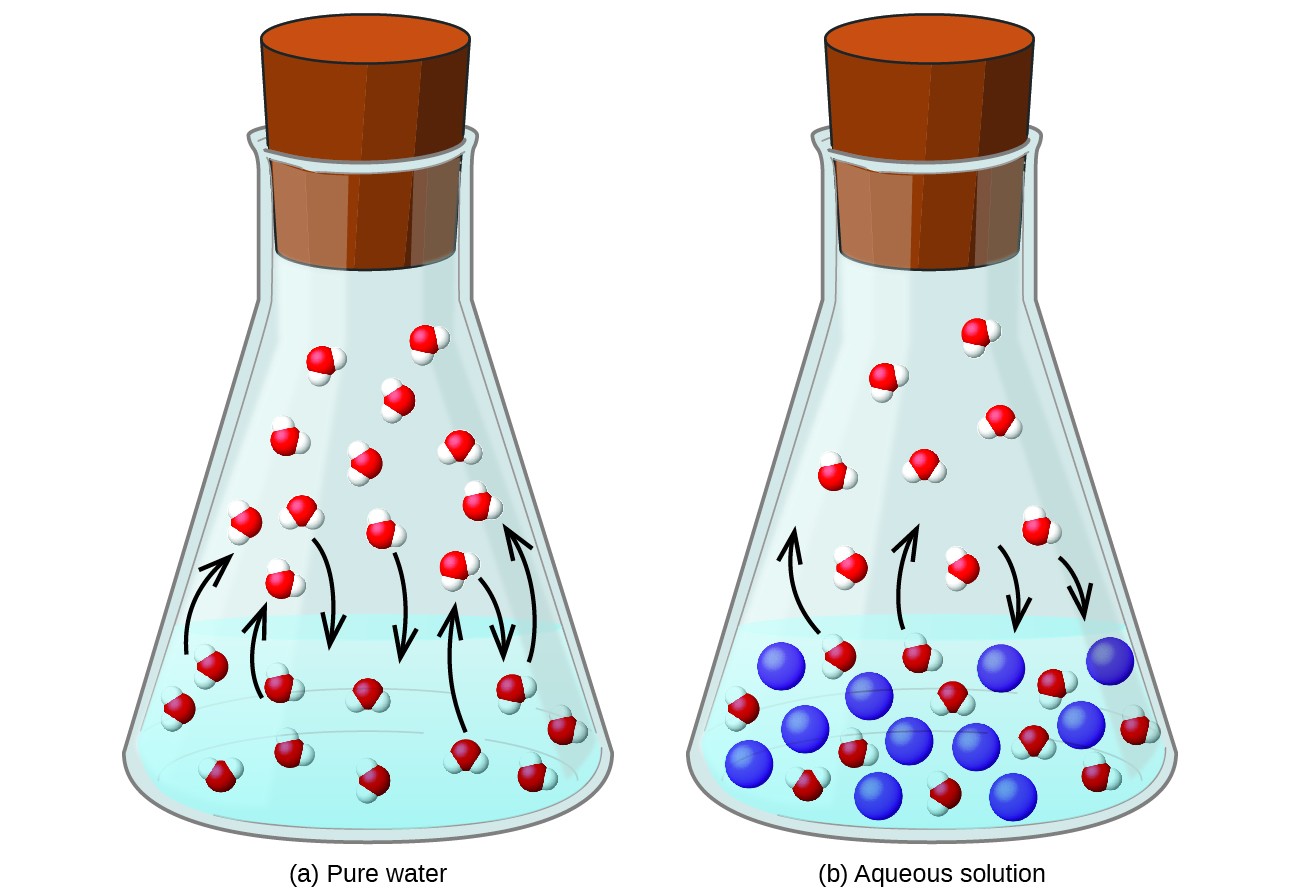
1. ábra. A nem illékony oldott anyagok jelenléte csökkenti az oldat gőznyomását az akadályozva az oldószermolekulák párolgását.
Az oldatkomponensek gőznyomásának és a ezeket az összetevőket a Raoult-törvény írja le: Az ideális megoldás bármely alkotóeleme által kifejtett parciális nyomás megegyezik a tiszta komponens gőznyomásának és az oldat mólfrakciójának szorzatával.
{P} _ {\ text {A}} = {X} _ {\ text {A}} {P} _ {\ text {A}} ^ {\ star}
Emlékeztetve arra, hogy a gáznemű keverék teljes nyomása megegyezik az összes alkotórészének résznyomásainak összegével (Dalton részleges nyomás törvénye), az i komponenseket tartalmazó oldat által kifejtett teljes gőznyomás
{ P} _ {\ text {megoldás}} = \ összeg _ {i} {P} _ {i} = \ összeg _ {i} {X} _ {i} {P} _ {i} ^ {\ csillag}
Nem illékony anyag az az anyag, amelynek gőznyomása elhanyagolható (P ^ {\ star} ≈ 0), és ezért a csak nem illékony oldott anyagokat tartalmazó oldat felett a gőznyomás csak az oldószernek köszönhető:
{P} _ {\ text {solution}} = {X} _ {\ text {solvent}} {P} _ {\ text {solv}} ^ {\ csillag}
Oldatok lepárlása
A desztilláció a keverékek összetevőinek elválasztására szolgáló technika, amelyet széles körben alkalmaznak a laboratóriumban és az ipari környezetben egyaránt. A kőolaj finomítására, a fermentációs termékek elkülönítésére és a víz tisztítására szolgál. Ez az elválasztási technika magában foglalja a minta keverékének szabályozott melegítését egy vagy több érdekes komponens szelektív elpárologtatása, kondenzálása és összegyűjtése céljából. A laboratóriumi méretű desztillációk tipikus készülékét a 2. ábra mutatja.

2. ábra a laboratóriumi desztillációs egységet az (a) fénykép és (b) az alkatrészek sematikus ábrája mutatja. (kredit a: a “Rifleman82” / Wikimedia commons munkájának módosítása; b: a “Slashme” / Wikipédia munkájának módosítása)
Az olajfinomítók nagyüzemi frakcionált desztillációt alkalmaznak a a kőolaj összetevői. A nyers olajat magas hőmérsékletre melegítik egy magas frakcionáló oszlop tövében, és az oszlopon belül emelkedő számos komponenst elpárologtat. Amint az elpárologtatott alkatrészek emelkedésük során megfelelő hűvös zónákat érnek el, kondenzálódnak és összegyűlnek. Az összegyűjtött folyadékok a szénhidrogének és más kőolajvegyületek egyszerűbb keverékei, amelyek megfelelő összetételűek a különböző alkalmazásokhoz (pl. Dízelüzemanyag, kerozin, benzin), amint azt a 3. ábra mutatja.

3. ábra: A nyersolaj egy összetett keverék, amelyet nagy mennyiségű frakcionált desztillációval választanak el, hogy különféle egyszerűbb keverékeket izoláljanak.
Forráspont emelkedése
A folyadékokról és szilárd anyagokról szóló fejezetben leírtak szerint a folyadék forráspontja az a hőmérséklet, amelyen a gőznyomása megegyezik a környezeti légköri nyomással.Mivel az oldat gőznyomása csökken az illékony oldott anyagok jelenléte miatt, indokolt, hogy az oldat forráspontja később növekedjen. A tiszta oldószerhez képest az oldathoz ennélfogva magasabb hőmérsékletre van szükség az adott gőznyomás eléréséhez, beleértve a környező atmoszférának megfelelő értéket is. A nem illékony oldott anyag oldószerben való feloldása esetén megfigyelt forráspont-növekedést (ΔTb) forráspont-emelkedésnek nevezzük, és egyenesen arányos az oldott anyag moláris koncentrációjával:
\ Delta {T} _ {\ text {b}} = {K} _ {\ text {b}} m
ahol Kb a forráspont magasságállandója vagy az ebullioszkópos állandó és m az Az összes oldott anyag moláris koncentrációja (molalitása).
A forráspont emelkedési állandói jellemző tulajdonságok, amelyek az oldószer azonosságától függenek. Az 1. táblázatban felsoroljuk az oldószerek Kb-értékeit.
Az oldószer gőznyomásának és a forráspont emelkedésének mértéke az adott mennyiségben jelen lévő oldott részecskék teljes számától függ. oldószer, nem a részecskék tömegén, méretén vagy kémiai azonosságán. 1 m vizes szacharóz-oldat (342 g / mol) és 1 m vizes etilén-glikol-oldat (62 g / mol) azonos forráspontot mutat, mivel minden oldat egy mól oldott részecskét (molekulát) tartalmaz egy kilogramm oldószerben .
6. példa: Jódoldat forráspontja
Keresse meg 92,1 g (I2) jód és 800,0 g kloroform (CHCl3) oldatának forráspontját. feltételezve, hogy a jód nem illékony és a megoldás ideális.
Ellenőrizze a tanulást
Mi a forráspontja egy 1,0 g glicerin, C3H5 (OH) 3, 47,8 g vízben? Tegyünk fel ideális megoldást.
Fagyáspont-depresszió

4. ábra Kősó ( NaCl), kalcium-kloridot (CaCl2) vagy a kettő keverékét használják a jég megolvasztására. (hitel: Eddie Welker munkájának módosítása)
Az oldatok alacsonyabb hőmérsékleten fagynak meg, mint a tiszta folyadékok. Ezt a jelenséget használják ki olyan “jégmentesítő” sémákban, amelyek sót (4. ábra), kalcium-kloridot vagy karbamidot használnak a jég megolvasztására az utakon és a járdákon, valamint az etilén-glikolt “fagyállóként” használják az autó radiátoraiban. A tengervíz alacsonyabb hőmérsékleten fagy meg, mint az édesvíz, ezért az Északi-sarkvidék és az Antarktisz óceánjai 0 ° C alatti hőmérsékleten is fagyatlanok maradnak (akárcsak az ezen óceánokban élő halak és más hidegvérű tengeri állatok testnedvei). p>
A híg oldat fagyáspontjának csökkenését a tiszta oldószerrel összehasonlítva, ΔTf fagyáspont-depressziónak nevezzük, és egyenesen arányos az oldott anyag moláris koncentrációjával
\ Delta {T} _ {\ text {f}} = {K} _ {\ text {f}} m
ahol m az oldott anyag moláris koncentrációja az oldószert és a Kf-et fagyáspont-depressziós állandónak (vagy krioszkópos állandónak) nevezzük. Csakúgy, mint a forráspont-magasság állandók esetében, ezek is jellemző tulajdonságok, amelyek értéke az oldószer kémiai azonosságától függ. Az oldószer Kf értékeit az 1. táblázat sorolja fel.
Kolligatív tulajdonságok és jégmentesítés
A nátrium-kloridot és 2. csoportjába tartozó analógokat a kalciumot és a magnézium-kloridot gyakran használják jégmentesítő utak és járdák, annak a ténynek köszönhetően, hogy ezen sók bármelyikének oldatának fagyáspontja 0 ° C-nál alacsonyabb lesz, a tiszta víz fagyáspontja. A 2. csoportba tartozó fémsókat gyakran keverik az utakon történő felhasználáshoz az olcsóbb és könnyebben hozzáférhető nátrium-kloriddal (“kősó”), mivel hajlamosak valamivel kevésbé korrozívak lenni, mint a NaCl, és nagyobb fagyáspont-csökkenést biztosítanak , mivel disszociálva képletegységenként három részecskét eredményeznek, nem pedig két részecskét, mint például a nátrium-kloridot.
Mivel ezek az ionos vegyületek hajlamosak felgyorsítani a fém korrózióját, nem lenne bölcs választás fagyálló az autóban lévő radiátor számára, vagy felszállás előtt jégtelenítésre.Ezen alkalmazásokhoz gyakran használnak kovalens vegyületeket, például etilént vagy propilénglikolt. A radiátorfolyadékban használt glikolok nem csak csökkentik a folyadék fagyáspontját, hanem megemelik a forráspontot, így a folyadék télen és nyáron egyaránt hasznos. Fűtött glikolokat gyakran permeteznek a repülőgépek felületére felszállás előtt, télen zord időben a már kialakult jég eltávolítása és a további jég keletkezésének megakadályozása érdekében, ami különösen veszélyes lenne, ha a repülőgép vezérlő felületein képződnének (ábra). 5).

5. ábra: A fagyáspont-nyomást arra használják, hogy eltávolítsák a jeget (a) úttestről és (b) a repülőgép vezérlő felületei.
A megoldás fázisdiagramja
A gőznyomás, a forráspont és a fagyáspont kolligatív hatásai Az előző szakaszban leírt módszereket kényelmesen összefoglaljuk, összehasonlítva a tiszta folyadék és az abból származó oldat fázisdiagramjait. A víz és a vizes oldat fázisdiagramjait a 6. ábra mutatja.
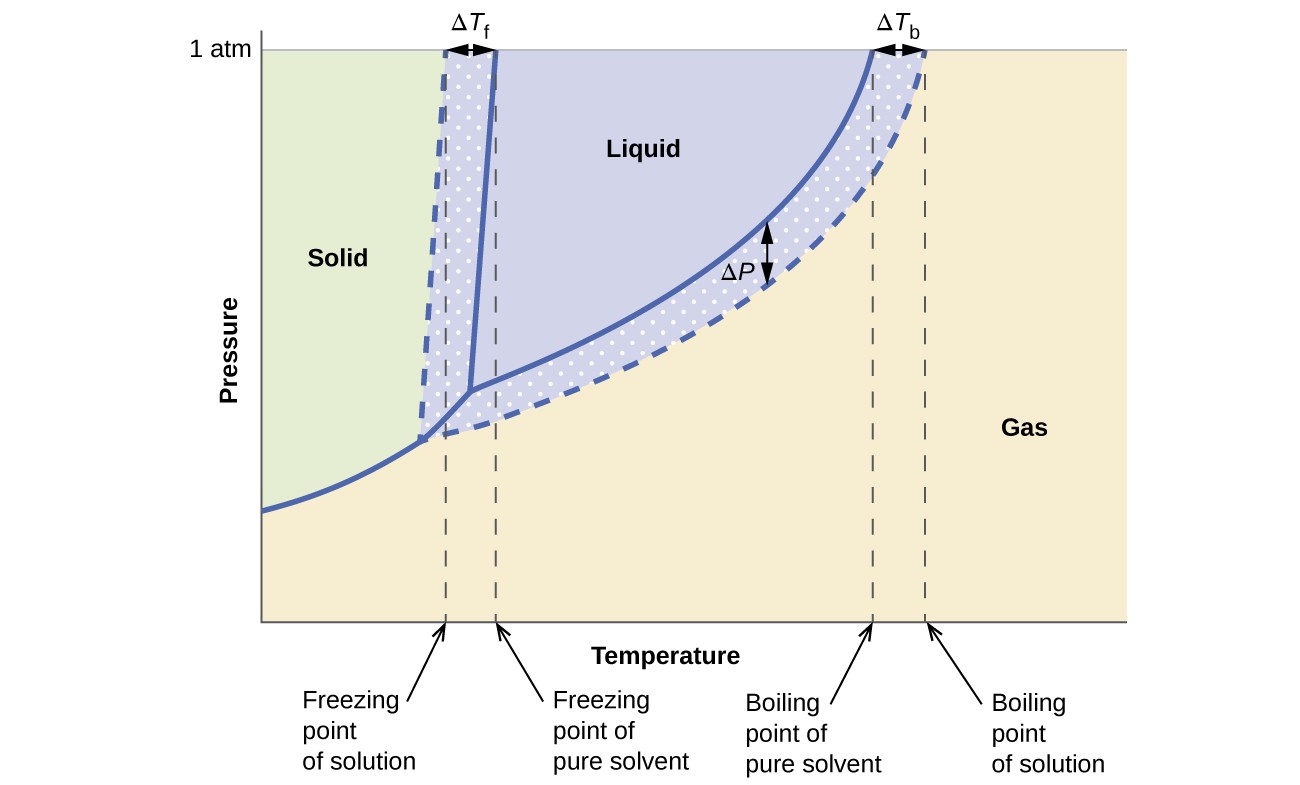
6. ábra. Ezek a fázisok a diagramok vizet (szilárd görbéket) és nemelektrolit vizes oldatát mutatnak (szaggatott görbék).
Az oldat folyadék-gőz görbéje az oldószer megfelelő görbéje alatt található, ábrázolja a gőzt. nyomáscsökkentés, ΔP, amely az illékony oldott anyag oldódásából származik. Következésképpen bármely adott nyomáson az oldat forráspontja magasabb hőmérsékleten figyelhető meg, mint a tiszta oldószeré, tükrözve a nem illékony oldott anyag jelenlétével járó forráspont-emelkedést (ΔTb). Az oldat szilárd-folyadék görbéjét a tiszta oldószerétől balra toljuk el, ami az oldatképződéssel járó fagyáspont-nyomást (ΔTb) jelenti. Végül vegye figyelembe, hogy az oldószer és az oldat szilárd gáz görbéi megegyeznek. Sok folyékony oldószert és nem illékony oldott anyagot tartalmazó oldat esetében ez a helyzet. A párologtatáshoz hasonlóan, amikor egy ilyen oldat fagyasztva van, valójában csak az oldószermolekulák mennek keresztül a folyadék-szilárd átmeneten, tiszta szilárd oldószert képezve, amely kizárja az oldott anyagokat. A szilárd és a gázfázisok tehát csak oldószerből állnak, így a fázisok közötti átmenet nem befolyásolja kolligatív hatásokat.
Az oldatok ozmózisa és ozmotikus nyomása
Számos természetes és a szintetikus anyagok szelektív permeabilitást mutatnak, vagyis csak bizonyos méretű, alakú, polaritású, töltésű stb. molekulák vagy ionok képesek áthaladni (áthatolni) az anyagot. A biológiai sejtmembránok elegáns példákat mutatnak be a természetben történő szelektív behatolásra, míg a metabolikus hulladékok vérből történő eltávolítására használt dialízis csövek egyszerűbb technológiai példa. Függetlenül attól, hogy miként lehet gyártani, ezeket az anyagokat általában féligáteresztő membránoknak nevezik.
Vizsgáljuk meg a 7. ábrán bemutatott berendezést, amelyben a tiszta oldószer és az oldat mintáit csak egy oldószeres membrán választja el. molekulák áthatolhatnak. Az oldószermolekulák mindkét irányban diffundálnak a membránon. Mivel az oldószer koncentrációja nagyobb a tiszta oldószerben, mint az oldat, ezek a molekulák nagyobb sebességgel diffundálnak a membrán oldószer felől az oldat oldalára, mint fordított irányban. Az eredmény az oldószermolekulák nettó átvitele a tiszta oldószerből az oldatba. Az oldószermolekulák diffúzióvezérelt átadása féligáteresztő membránon keresztül ozmózis néven ismert folyamat.
ábra 7. a) Az oldatot és a tiszta oldószert először ozmotikus membrán választja el egymástól. (b) Az oldószermolekulák nettó transzferje az oldatba addig megy végbe, amíg ozmotikus nyomása mindkét irányban azonos átviteli sebességet nem eredményez.
Ha az ozmózist a 7. ábrán bemutatotthoz hasonló berendezésben hajtják végre. , az oldat térfogata növekszik, amikor az oldószer felhalmozódásával hígul. Ez az oldat szintjének emelkedését okozza, megnöveli annak hidrosztatikus nyomását (a csőben lévő oldatoszlop oszlopának súlya miatt), és az oldószermolekulák gyorsabb visszajutását eredményezi a tiszta oldószer oldalára. Amikor a nyomás eléri azt az értéket, amely fordított oldószer-átviteli sebességet eredményez, amely megegyezik az ozmózis sebességével, az oldószer tömeges átadása megszűnik. Ezt a nyomást az oldat ozmotikus nyomásának (Π) nevezzük. A híg oldat ozmotikus nyomása összefügg az oldott anyag molaritásával, M és abszolút hőmérsékletével, T, az egyenlet szerint
\ Pi = MRT
ahol R az univerzális gázállandó.
Ha az oldatot olyan készülékbe helyezzük, mint amilyen a 8. ábrán látható, akkor az oldat ozmotikus nyomásánál nagyobb nyomás megfordítja az ozmózist, és az oldószer molekuláit az oldatból a tiszta oldószerbe taszítja. A fordított ozmózis ezen technikáját a tengervíz nagymértékű sótalanításához és kisebb léptékben nagy tisztaságú ivóvíz-csapvíz előállításához használják.
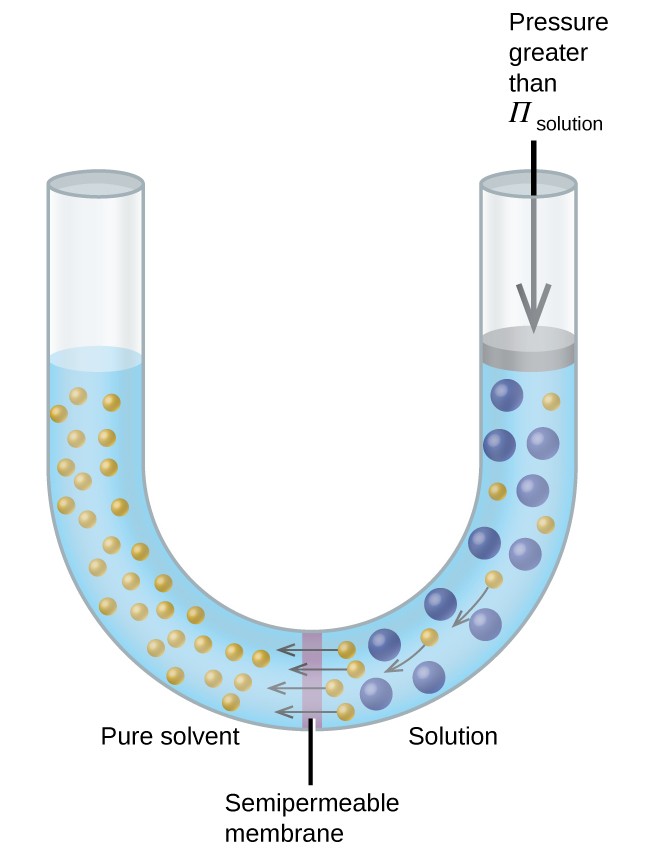
8. ábra: Az oldat ozmotikus nyomásánál nagyobb nyomás alkalmazása megfordítja az ozmózist. Az oldatból az oldószer molekulákat a tiszta oldószerbe tolják.
Fordított ozmózisos víztisztítás
Az ozmózis során a diffúzió a víz mozgatását szolgálja. féligáteresztő membrán kevésbé koncentrált oldattól koncentráltabb oldatig. Az ozmotikus nyomás az a nyomásmennyiség, amelyet a töményebb oldatra kell alkalmazni, hogy az ozmózis leálljon. Nagyobb nyomás alkalmazása esetén a víz a töményebb oldatból kevésbé koncentrált (tisztább) oldatba kerül. Ezt fordított ozmózisnak nevezzük. A reverz ozmózist (RO) a víz tisztítására használják számos alkalmazásban, a part menti városok sótalanító üzemeitől kezdve az élelmiszerboltokban található víztisztító gépekig (9. ábra) és a kisebb fordított ozmózisos háztartási egységekig. Kézi működtetésű szivattyúval kis RO egységek használhatók a harmadik világ országaiban, katasztrófaterületeken és mentőcsónakokban. Katonai erőink számos generátor által működtetett RO egységgel rendelkeznek, amelyeket járművekben távoli helyekre lehet szállítani.

9. ábra: Az ivóvíz tisztítására szolgáló reverz ozmózis rendszereket mutatjuk be itt (a) kicsi és (b) nagy skálán. (kredit a: Jerry Kirkhart munkájának módosítása; kredit b: Willard J. Lathrop munkájának módosítása)
Számos biológiai rendszerben nyilvánvalóak az ozmózis példái, mert a sejtek féligáteresztő membránok veszik körül. Azok a sárgarépák és zellerek, amelyek sántikussá váltak, mert elvesztették a vizet, ismét ropogóssá tehetők, ha vízbe teszik őket. A víz ozmózis útján mozog a sárgarépa vagy a zeller sejtjeibe. A tömény sóoldatba helyezett uborka az ozmózis révén elveszíti a vizet, és felszív egy kis sót, hogy savanyúvá váljon. Az ozmózis az állati sejteket is befolyásolhatja. Az oldott anyag koncentrációja különösen fontos, ha oldatokat injektálnak a testbe. A testsejt-folyadékokban és a vérszérumban oldott anyagok körülbelül 7,7 atm ozmotikus nyomást adnak ezeknek az oldatoknak. A testbe injektált oldatoknak ugyanolyan ozmotikus nyomással kell rendelkezniük, mint a vérszérumnak; vagyis izotóniásnak kell lenniük a vérszérummal. Ha egy kevésbé koncentrált oldatot, egy hipotonikus oldatot injektálnak elegendő mennyiségben a vérszérum hígításához, a hígított szérumból származó víz ozmózis révén jut át a vérsejtekbe, ami a sejtek tágulását és repedését okozza. Ezt a folyamatot hemolízisnek nevezzük. Ha koncentráltabb oldatot, hipertóniás oldatot injektálnak, a sejtek elveszítik a vizet a koncentráltabb oldathoz, összezsugorodnak és esetleg elpusztulnak egy krénezésnek nevezett folyamatban. Ezeket a hatásokat a 10. ábra szemlélteti.
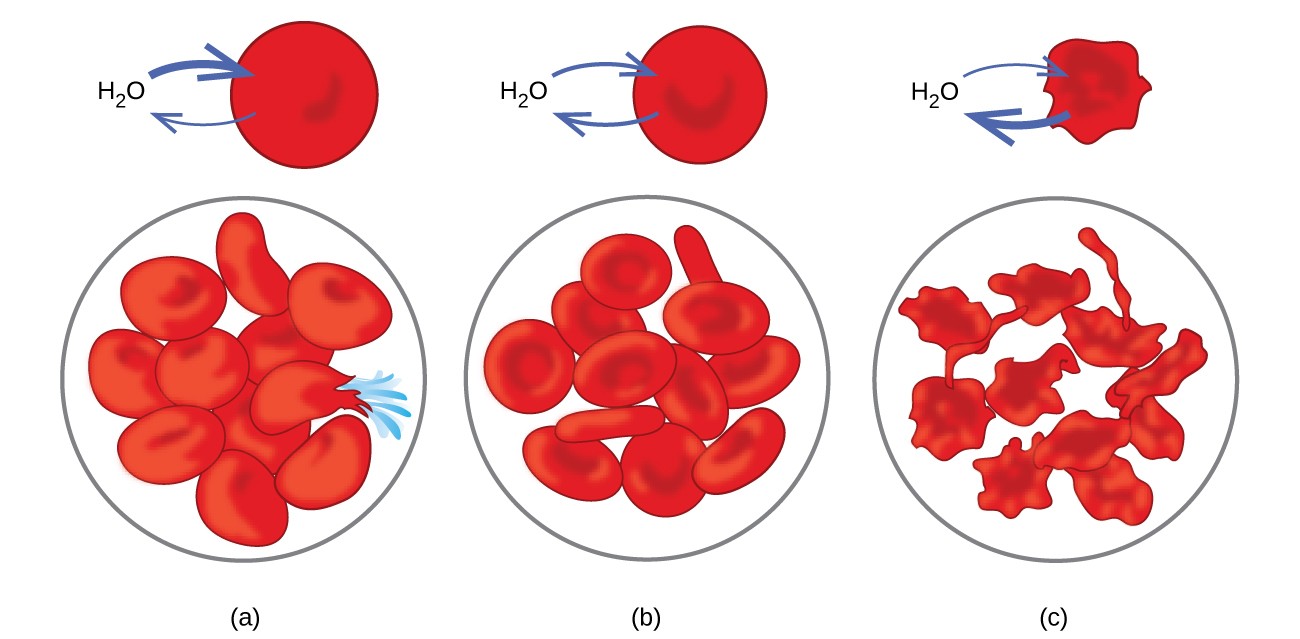
10. ábra: A vörösvértestek membránjai vízáteresztőek és a) megduzzad és esetleg felszakad egy hipotóniás oldatban; b) izotóniás oldatban normál térfogatot és alakot tartson fenn; és (c) zsugorodnak és esetleg meghalnak hipertóniás oldatban. (credit a / b / c: “LadyofHats” / Wikimedia commons munkájának módosításai)
A moláris tömeg meghatározása
Az ozmotikus nyomás és a fagyáspont változásai, forráspont pont és a gőznyomás egyenesen arányos az oldott anyag koncentrációjával. Következésképpen ezen tulajdonságok egyikének mérésével felhasználhatjuk az oldott anyag moláris tömegét a mérések alapján.
Elektrolitok kolligatív tulajdonságai
Amint azt ebben a modulban már korábban megjegyeztük, az oldat kolligatív tulajdonságai csak az oldott oldott fajok számától, nem azonosságától függenek. A különböző kolligatív tulajdonságok (fagyáspont-depresszió) (forráspont-emelkedés, ozmotikus nyomás) az oldatban jelen lévő összes oldott anyagra vonatkozik. Az ebben a fejezetben eddig vizsgált oldatok esetében az oldott anyagok nonelektrolitok voltak, amelyek fizikailag disszociáció vagy bármely más kísérő folyamat nélkül oldódnak. Az oldódás után egy oldott oldott molekula keletkezik. Az elektrotita feloldódása azonban nem ilyen egyszerű, amint azt az alábbi két általános példa szemlélteti:
Ezen példák közül az elsőt figyelembe véve, és teljes disszociációt feltételezve, egy 1,0 m-es vizes NaCl-oldat 2,0 mol ionokat (1,0 mol Na + és 1) tartalmaz.0 mol Cl−) minden kilogramm vízre, és fagyáspont-csökkenése várhatóan
Ha ezt az oldatot ténylegesen elkészítik és a fagyáspont-nyomását mérik, akkor 3,4 ° C értéket kapnak. Hasonló eltérések figyelhetők meg más ionos vegyületeknél is, és a mért és a várható kolligatív tulajdonságértékek közötti különbségek jellemzően szignifikánsabbá válnak az oldott anyag koncentrációjának növekedésével. Ezek a megfigyelések azt sugallják, hogy a nátrium-klorid (és más erős elektrolitok) ionjai nem teljesen disszociálnak az oldatban.
Ennek figyelembe vétele és a teljes disszociáció feltételezésével járó hibák elkerülése érdekében egy kísérletileg mért paraméter Jacobus Henricus van’t Hoff Nobel-díjas német vegyész tiszteletét használják. A van’t Hoff-faktort (i) az oldott oldott anyag részecskéinek és az oldott képletegységek számának aránya határozza meg:
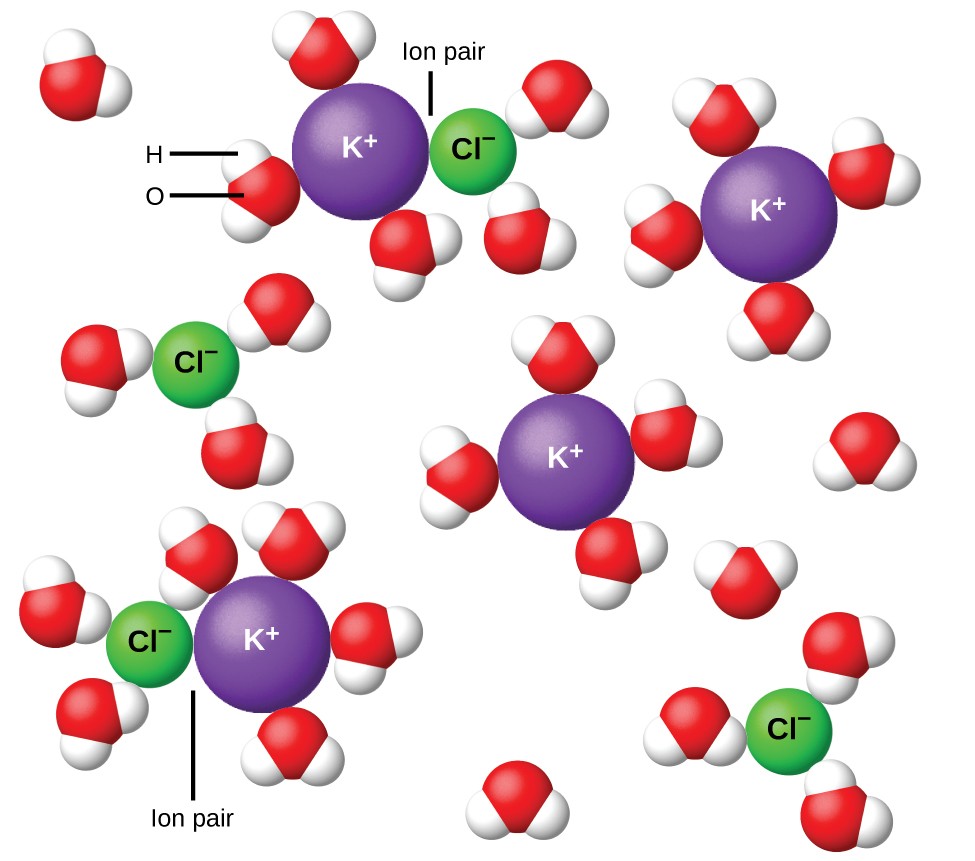
11. ábra: Az ionok egyre szélesebb körben válnak szét, annál hígabbak az oldatok, és a maradék interionos vonzerők egyre kevesebbek lesznek.
1923-ban Peter Debye és Erich Hückel kémikusok elméletet javasoltak az erős elektrolitok látszólagos hiányos ionizációjának magyarázatára. Javasolták, hogy bár az ionok szolvatációja és a poláros oldószer szigetelő hatása miatt a vizes oldatban az interionos vonzerő nagymértékben csökken, ez nem teljesen semmissé válik. A maradék vonzerők megakadályozzák, hogy az ionok teljesen független részecskékként viselkedjenek (11. ábra). Bizonyos esetekben egy pozitív és negatív ion valóban érintkezhet, így egy szolvatált egységet, úgynevezett ionpárt. Tehát bármely meghatározott ion aktivitása vagy effektív koncentrációja kisebb, mint amit a tényleges koncentráció jelez. Az ionok egyre szélesebb körben válnak el egymástól, minél jobban hígul az oldat, és a maradék interionos vonzerők egyre kevésbé. Tehát rendkívül híg oldatokban az ionok effektív koncentrációi (aktivitásaik) lényegében megegyeznek a tényleges koncentrációkkal. Ne feledje, hogy a 2. táblázat elektrolitjainak van’t Hoff-tényezői 0,05 m-es oldatokra vonatkoznak, amelyek koncentrációján az i értéke NaCl esetében 1,9, szemben az ideális 2 értékkel.
11. példa: Az elektrolit oldatának fagyáspontja
Az ionok koncentrációja a tengervízben megközelítőleg megegyezik a 4,2 g NaCl-ot tartalmazó oldat 125 g vízben oldott koncentrációjával. Tegyük fel, hogy a NaCl-oldatban található egyes ionok ugyanolyan hatással vannak a víz fagyáspontjára, mint egy nemelektrolit molekula, és határozzuk meg az oldat fagyáspontját (amely megközelítőleg megegyezik a tengervíz fagyás hőmérsékletével).
Ellenőrizze a tanulást
Tegyük fel, hogy a kalcium-kloridban, a CaCl2-ben lévő ionok mindegyike ugyanolyan hatással van a víz fagyáspontjára, mint egy nemelektrolit molekula. Számítsa ki a 0,724 g CaCl2 175 g vízben készült oldatának fagyáspontját.
Próbálja ki
- A hús frissnek (nem fagyasztottnak) minősíthető, annak ellenére, hogy −1-es helyen tárolja ° C. Miért ne fagyna le a hús ezen a hőmérsékleten?
- Egy szerves vegyület összetétele 93,46 tömeg% C és 6,54 tömeg% H. 0,090 g ennek a vegyületnek 1,10 g kámforral készített oldata 158,4 ° C-on olvad. A tiszta kámfor olvadáspontja 178,4 ° C. A kámfor Kf értéke 37,7 ° C / m. Mi az oldott anyag molekulaképlete? Mutassa meg számításait.
- A só alkálifém-fluorid. A fagyáspont gyors közelítő meghatározása azt jelzi, hogy 100 g vízben feloldva 4 g só körülbelül -1,4 ° C hőmérsékleten fagy. Mi a só képlete? Mutassa meg számításait.
Szójegyzék
aktivitás: az ionok hatékony koncentrációja az oldatban; alacsonyabb, mint a tényleges koncentráció, az ionos kölcsönhatások miatt.
Forráspont-emelkedés: egy folyadék forráspontjának emelkedése oldott anyag hozzáadásával.
Forráspont-emelkedési állandó: arányossági állandó az egyenletben, amely a forráspont emelkedését az oldott molalitáshoz kapcsolja; ebullioszkópos konstans néven is ismert
kolligatív tulajdonság: az oldat azon tulajdonsága, amely csak az oldott anyag koncentrációjától függ ozmózissal
fagyáspont-depresszió: folyadék fagyáspontjának csökkentése oldott anyag hozzáadásával
fagyáspont-depressziós állandó: (krioszkópos állandó is) arányossági állandó a következő egyenletben: fagyáspont-depresszió az oldott molalitáshoz : kisebb ozmotikus nyomás
ionpár: szolvatált anion / kation pár, amelyet mérsékelt elektrosztatikus vonzás tart össze
izotóniás: azonos ozmotikus nyomású
molalitás (m) : koncentrációs egység, amely az oldott anyag móljainak és az oldószer tömegének aránya kilogrammban kifejezve
mólfrakció (X): az oldatkomponens moláris mennyiségének és az összes oldatkomponens móljának teljes számához viszonyított aránya ): az oldószermolekulák féligáteresztő membránon történő tömeges átvitelének megakadályozásához szükséges ellentétes nyomás gőznyomás tiszta állapotban
féligáteresztő membrán: olyan membrán, amely szelektíven lehetővé teszi bizonyos ionok vagy molekulák áthaladását
van’t Hoff-faktor (i): a vakondok számának aránya részecskék egy oldatban az oldatban oldott képleti egységek mólszámáig
- Összehasonlításképpen bemutatott nemelektrolit. ↵

