US Pharm. 2018; 43 (7): 22-26.
Összegzés: A sztatinok a gyógyszerek olyan csoportja, amelyet széles körben alkalmaznak a szív- és érrendszeri események elsődleges és másodlagos megelőzésére. Mivel hat általánosan elérhető sztatin áll rendelkezésre, a megfelelő szer kiválasztását a gyógyszer-specifikus tényezők alapján lehet meghatározni, beleértve az adagolási szempontokat, a gyógyszer kölcsönhatásait és a nemkívánatos eseményeket. Egyedi betegellátási tervek kidolgozhatók a fontos klinikai vizsgálatok adatai, az irányelvek eltérései és a sztatinhasználattal kapcsolatos két fő mellékhatás jelenlegi kezelési ajánlásai alapján.
A dyslipidemia kezelésének sarokköve a 3-hidroxi-3-metil-glutaril-koenzim A reduktáz inhibitorok, közismertebb nevén sztatinok. A sztatinok a világon a legáltalánosabban felírt gyógyszerek közé tartoznak, mivel a piacon számos generikus opcióval és megalapozott bizonyítékokkal támasztják alá a gyógyszereket.1 Azonban ezeknek a szereknek a gyakori alkalmazása a biztonságuk folyamatos ellenőrzéséhez és a vita folytatásához vezetett. szerep a terápiában. Ez a cikk, amely a generikus sztatinokra összpontosít, kiemeli a sztatinok terápiában betöltött szerepéről szóló vitát, megvitatja a helyes alkalmazást és feltárja a két fő nemkívánatos esemény körüli bizonyítékokat.
A piacon található hét különböző sztatin közül hat Három elérhető márkájú készítmény a pitavastatin (Livalo), a szimvasztatin belsőleges szuszpenzió (FloLipid) és a lovastatin nyújtott hatóanyag-leadású (Altoprev). 8-10 A márkás szerek szerepe a terápiában korlátozott az általános lehetőségek széles körű elérhetősége.
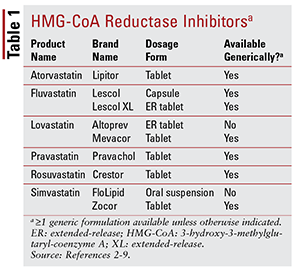
Az atorvasztatin és a szimvasztatin általában elérhető több kombinált termék. Ide tartoznak az atorvasztatin és az amlodipin kombinációja, a magas vérnyomás esetén javallott kalciumcsatorna-blokkoló (CCB), valamint a hiperkoleszterinémia szempontjából is javallott bél-koleszterin-abszorpciós inhibitor, a szimvasztatin és az ezetimib kombinációja. lovastatint és niacint / szimvasztatint) 2016-ban kivonták a piacról, mivel nincs bizonyíték arra, hogy a statinnal kezelt betegeknél a niacin hozzáadása tovább csökkentené a kardiovaszkuláris (CV) kimenetelt, meghaladva azt, amit csak a sztatinok esetében tapasztalunk. 13
KEZELÉSI AJÁNLÁSOK
A sztatinok többször bizonyítottan hatékonyak az LDL-koleszterin (LDL-C) és a triglicerid szint csökkentésében, miközben növelik a HDL-koleszterin (HDL-C) szintjét.14 betegorientált eredmények, mint például a fő CV események (CVE), mind az elsődleges, mind a másodlagos megelőzésben. 15-19
Számos erősen vitatott kezelési irányelv tárgyalja a sztatinok szerepét a hy perlipidémia. Ide tartoznak a 2013. évi American College of Cardiology / American Heart Association (ACC / AHA) iránymutatás és az American Academy of Clinical Endocrinology (AACE) 2017. évi irányelvei. 14,20 Mindkét irányelv azt sugallja, hogy az életmód-módosítások, beleértve a dohányzásról való leszokást is, betartása után testmozgás és a szív egészséges étrendet követve a sztatinok első vonalbeli terápiát jelentenek mind a CV betegség elsődleges, mind pedig a másodlagos megelőzésében. 14,20 Az irányelvek azonban abban különböznek egymástól, hogy miként lehet meghatározni, hogy melyik sztatin melyik számára megfelelő betegek.
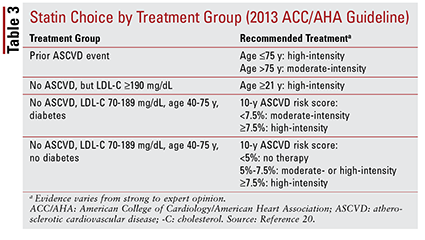
A 2013. évi ACC / AHA iránymutatás négy kezelési csoportot vezetett be, amelyek a statin terápiára irányultak:
1. Azoknál a betegeknél, akiknél korábban volt ateroszklerotikus CVD (ASCVD), beleértve azokat is, akiknél korábban előfordult esemény (pl. Akut koszorúér-szindrómák, kórtörténetében myocardialis infarctus, stabil vagy instabil angina, koszorúér- vagy egyéb artériás revaszkularizáció, stroke, átmeneti ischaemiás roham vagy feltételezett perifériás artériás betegség) ateroszklerotikus eredetű).
2. Azok a betegek, akiknek az anamnézisében nem volt ASCVD esemény, és akiknek az LDL-C szintje 190 mg / dl vagy magasabb. Az életkor nem képezi kizárás alapját e kritérium alól.
3. 40–75 éves betegek, akiknek cukorbetegségük van, de anamnézisükben nem volt ASCVD esemény, és az LDL-C szintje 70 és 189 mg / dl között volt.
4. 40 és 75 év közötti, cukorbetegség nélküli betegek, akiknek korábban nem volt ASCVD-eseményük, és az LDL-C szintje 70 és 189 mg / dl között volt. 20
Az ACC / AHA irányelv bemutatta a sztatinok csoportosításának gondolatát is intenzitás szerint (azaz várható LDL-C-csökkentő képességük szerint) (2. TÁBLÁZAT) .20 A kezelési csoport alapján (a fentiek szerint) az irányelv specifikus statinintenzitásokat ajánl bizonyos klinikai helyzetekhez (3. TÁBLÁZAT) .20 Több kezelési csoport megkövetelik az ASCVD kockázati pontszám kiszámítását az ASCVD kockázat becslő segítségével. Ez az online eszköz figyelembe veszi a beteg életkorát, nemét, faját, szisztolés vérnyomását, összkoleszterinszintjét, HDL-C-jét és a múltbeli kórtörténetét, amely jelentős a magas vérnyomás kezelésében, a cukorbetegségben vagy a dohányzásban. 21 Miután minden bevitelt megadtunk, a beteg 10 kiszámítják az ASCVD esemény bekövetkezésének évenkénti kockázatát.
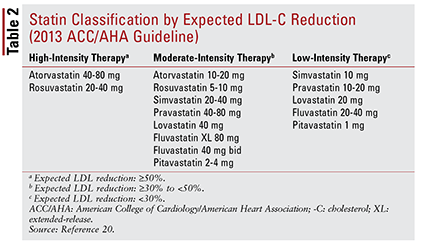
Ezek az ajánlások nem vonatkoznak automatikusan a betegek bizonyos alcsoportjaira. Például az idősebb felnőtteknél a sztatinok használatát óvatosan kell kezelni. Bár a sztatin szekunder prevencióhoz való alkalmazása idős betegeknél jelentős előnyökkel jár, az elsődleges megelőzésre való felhasználása nem egyértelmű. 22–24 Ezenkívül a szívelégtelenségben szenvedő betegeknél sem tapasztalták, hogy ugyanolyan előnyökkel járna a statin terápia, mint a szívelégtelenségben szenvedők esetében. Ezen megállapítások alapján a kezelési ajánlások magukban foglalják a nagy intenzitású sztatinok kezdetének korlátozását 75 évesnél fiatalabb betegek számára, és esetleg a sztatinok kerülését szívelégtelenségben szenvedő betegeknél. 20 Összességében a sztatinok e csoportokban történő alkalmazására vonatkozó döntés nem egyértelmű, és magában kell foglalnia a szolgáltató és a páciens közötti folyamatos beszélgetés a terápia lehetséges kockázatairól és előnyeiről.20
A 2013. évi ACC / AHA ajánlással ellentétben a kezelés csoportos osztályozás szerinti kezelésének megkezdésére a 2017. évi AACE iránymutatás azt ajánlja, hogy az egyes betegek laboratóriumi leletek alapján kezelik.14 Ezen irányelv szerint a beteg kockázatát különféle főbb, kiegészítő, a második nem hagyományos kockázati tényező. Az egyéneket ezután az öt kockázati csoport egyikébe sorolják, mindegyiknek meg van a megfelelő LDL-C és nem HDL-C cél (4. TÁBLÁZAT). A jelenlegi szintek és az egyedi célok alapján a sztatinokat önmagában vagy más szerekkel kombinálva a várható LDL-C- vagy nem HDL-C-csökkentő képesség alapján kell megkezdeni. 14

A kombinált kezelés, amely egy második szer hozzáadásával jár a folyamatban lévő sztatin-terápiával, továbbra is kissé ellentmondásos téma. Míg a korábbi vizsgálatok és irányelvek minimálisra csökkentették más szerek hozzáadását a háttér-sztatin-terápiához, a legújabb tanulmányok és konszenzusos nyilatkozatok – köztük az ACC / AHA-tól származó – támogatják az ezetimib, az evolokumab vagy az alirokumab alkalmazását, amelyek közül az utóbbi kettő a proprotein-konverzió-szubtilizin / 9-es típusú kexin-inhibitorok, mint kiegészítő terápia a másodlagos megelőzés érdekében. a többi specifikus szer meghatározó szerepe továbbra sem tisztázott.
STATIN-KIVÁLASZTÁS
A sztatin-terápia kiválasztása a klinikus által preferált kezelési megközelítéssel kezdődik, függetlenül attól, hogy ez a sztatin-kezelés ACC / AHA-módszere csoportok vagy az LDL-C vagy nem HDL-C célok AACE-módszere. Innentől kezdve az egyes statinok tulajdonságait figyelembe kell venni, hogy meghatározzuk a legjobb megoldást az egyes betegek számára. Nem minden sztatin egyenlő, és számos olyan kulcsfontosságú különbség létezik, amely befolyásolhatja a beteg kiválasztását, beleértve az adagolási szempontokat, a gyógyszerkölcsönhatásokat és a nemkívánatos eseményeket (AE).
Adagolás
Bár a legtöbb sztatin étkezésektől függetlenül kell bevenni, azonnali felszabadulású (IR) lovasztatint az esti étkezéskor kell bevenni a megnövekedett biohasznosulás miatt.4 Ugyanakkor az ellenkezője igaz a nyújtott felszabadulású lovasztatinra, amelyet a csökkent biohasznosulás miatt nem szabad étellel együtt bevenni. .8 Továbbá, bár minden sztatin adagolható naponta egyszer, az IR fluvasztatin és a lovastatin napi kétszeri adagolást igényelhet. 3,4 Végül, míg az atorvasztatin, a pravasztatin és a rozuvasztatin a nap bármely szakában beadható, a fluvasztatin, a lovastatin és a A szimvasztatint este kell bevenni. Különösen a szimvasztatin hatékonysága szignifikánsan eltérő volt, ha este szedték, és nem a reggel. 32
Gyógyszerkölcsönhatások
Minden sztatin más és más a gyógyszer-gyógyszer és a gyógyszer-élelmiszer kölcsönhatásokkal kapcsolatos aggályok az egyes metabolizálódási útvonalak miatt (5. TÁBLÁZAT). Túl sok gyógyszerkölcsönhatás létezik az egyes részletek részletes megvitatásához; ezért az alábbiakban csak néhányat írunk le.
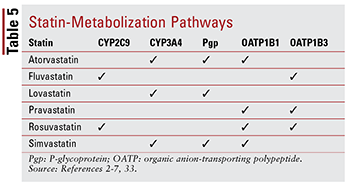
Fibrál: Bár a kombináció egy fibrát és egy sztatin nem bizonyítottan érdemben megváltoztatja a klinikai eredményeket, a betegek továbbra is felírhatnak gemfibrozilt, fenofibrátot vagy fenofibrinsavat egy sztatinral együtt a súlyosan kontrollálatlan hipertrigliceridémia megcélzásához. 14,20,26,33 izomfüggő toxicitással társulnak, a kombinált terápia szignifikánsan növeli ezt a kockázatot, önmagában bármelyik terápiához képest. 33 Ez az additív toxicitás gyakrabban jelentkezik a gemfibrozilnál, mint más fibrátoknál.33 Ezért a gemfibrozil alkalmazása ellenjavallt a szimvasztatinnal, és más gyógyszerekkel kerülni kell. sztatinok. 7,20 Ha egy sztatinot és egy fibrátot együtt használnak, akkor előnyös a fenofibrát vagy a fenofibrosav. 20,33 Ha azonban gemfibrozilt kell használni, fluvasztatint – vagy gondos monitorozás mellett atorvasztatint vagy rosuvasztatint (naponta legfeljebb 10 mg) ) – a választott ügynök.33
Amiodaron: Ez a kamrai fibrillációra jelzett antiaritmiás szer a P-glikoprotein (Pgp) és a CYP450 enzimrendszer, nevezetesen a CYP3A4 és kisebb mértékben a CYP2C9.33,34 inhibitora eredmény, a lovastatin (maximum 40 mg naponta) és a szimvasztatin (maximum 20 mg naponta) maximális ajánlott dózisa létezik amiodaronnal együtt alkalmazva. 4,7,33 Bár az atorvasztatin metabolizálódik a CYP3A4-en keresztül, az adag módosítása nem szükséges (hasonlóan a többi sztatinhoz) mert az adatok nem utalnak súlyos AE-re, ha atorvasztatint és amiodaront egyidejűleg alkalmaznak. . Az amiodaronhoz hasonlóan az amlodipin, a diltiazem és a verapamil gátolja a CYP3A4.33,35-37 amlodipint is gátló hatással van a Pgp-re. 33,35 Az irodalomban közölt AE-k alapján a lovasztatin maximális napi dózisa 20 mg, amikor amlodipinnel, diltiazemmel vagy verapamillal együtt alkalmazzák. 4,33 Azt is javasoljuk, hogy a szimvasztatin ne haladja meg a 20 mg-ot, ha amlodipinnel együtt alkalmazzák, de alacsonyabb, 10 mg-os dózist kell alkalmazni, ha diltiazemzel és verapamillal együtt alkalmazzák. 7,33 Nincs specifikus adagolás ajánlások léteznek az atorvasztatinnal kapcsolatban, bár óvatosan kell eljárni, ha a nondihidropiridin CCB-k bármelyikével együtt alkalmazzák.2,33
Kábítószer-mellékhatások
A statinok általában jól tolerálhatók; azonban a kezelések abbahagyási aránya továbbra is magas. 38 A statin-kezelés abbahagyása és a sztatin-kezelés folytatásának elmulasztása a mellékhatások bekövetkezése után a CVE-k megnövekedett arányával jár együtt.39 A betegek aggodalma a sztatin-biztonsággal kapcsolatban két fő statinnal összefüggő AE miatt – myotoxicitás és az újonnan kialakuló cukorbetegség – a sztatin abbahagyásához vezethet.
Myotoxicitás: A sztatinok régóta társulnak az izmokkal kapcsolatos toxicitással, beleértve a myalgiát (izomfájdalom emelkedett kreatin-kinázszint nélkül), myopathiát (az izom általános kifejezése) betegség) és myositis (izomgyulladás), amelyek közül az utóbbi kettő jelentős CK-emelkedést von maga után. 40,41 Valamennyi sztatin figyelmeztet a rabdomyolysis ritka, de súlyos mellékhatásaira. 2-7 A sztatinoknak tulajdonított myotoxicitás azonban gyakran a nocebo hatás miatt; vagyis egy személy úgy véli, hogy egy gyógyszer kárt okoz, majd a gyógyszer a várt kárt okozza. 42,43 Ezért a legjobb eredmény biztosítása érdekében a gyógyszerészeknek jól ismerniük kell ezt a gyakran jelentett mellékhatást és annak megfelelő kezelését.
Helytelen azt feltételezni, hogy az izomtünetek minden jelentése a nocebo-hatásnak köszönhető; A páciens múltbeli kórelőzményének (PMH) megfelelő ellenőrzése, a fájdalom leírása és a sztatin-terápiával való összefüggés elengedhetetlen. 44 Először is, a PMH vizsgálata CK-emelkedés és az izomfájdalom vagy gyengeség egyéb lehetséges okai miatt lehetővé teszi a klinikus számára, hogy alternatív kezeléseket végezzen. az alapvető patofiziológia vagy helyes tényezők, amelyek megváltoztathatják a statin metabolizmusát. Gyakori okok: öregség, gyógyszerkölcsönhatások, károsodott vese- vagy májfunkció, fokozott fizikai aktivitás és D-vitamin-hiány. 20,41
Ezután a klinikusnak összehasonlítania kell a beteg bemutatását a gyakran észlelt statin által kiváltott tünetekkel . A statin által kiváltott izomtoxicitás általában fájdalomként, gyengédségként, görcsökként és gyengeségként jelentkezik, általában a lábizmokban. 20,41 Ezek a tünetek a testmozgás után általában rosszabbak, és nem szűnnek meg a vétkes szer abbahagyása nélkül. 41
Az utolsó lépés annak meghatározása, hogy fennáll-e okozati összefüggés a tünetek és a sztatinhasználat között. Ha sztatin gyanúja merül fel az enyhe vagy közepesen súlyos tünetek okán, ideiglenes visszavonás javasolt. Ha a tünetek kb. 2 hét elteltével nem oldódnak meg, valószínűleg a sztatin nem az oka, ezért az eredeti dózissal kell újrakezdeni. Ha azonban a tünetek megszűnnek, meg kell ismételni ugyanazt a statint ugyanazon vagy alacsonyabb dózisban. Ha hasonló tünetek jelentkeznek, akkor a sztatin okát vélelmezni kell, és abba kell hagyni. A tünetek megszűnése után egy alternatív sztatin alacsony dózisát kell megkezdeni és a maximálisan tolerálható dózisra kell titrálni. 20,41 Fontos a betegek elfogadása és megértése ebben a folyamatban, mert a nocebo-hatás egyébként további észlelt reakciókhoz vezethet.
Számos más stratégia létezik ezen tünetek kezelésére és megelőzésére. Először is, a tünetek nagyobb valószínűsége miatt a klinikus úgy dönt, hogy elkerüli a leginkább lipofil sztatinokat (lovasztatin és szimvasztatin), a hidrofilebb sztatinok (fluvasztatin, pravastatin és rosuvastatin) mellett. 44 Simvastatin 80 mg-ot soha nem szabad újrakezdeni. a sztatinhoz társuló izomtünetek szokatlanul magas gyakorisága miatt bármelyik beteg terápiája.7,45 Az alternatív terápiák, például a Q10 koenzim, nem mutattak következetes hasznot, de megfontolhatók azoknál a betegeknél, akik pszichológiailag kiváltott tüneteket tapasztalnak.41,44,46 Végül fontolóra vehető a meghosszabbított intervallumú adagolás, amely magában foglalja a sztatin gyógyszerek napi többszöri, nem pedig napi egyszeri adagolását. Ez a megközelítés javítja a tapadást és a lipidprofilt azoknál a betegeknél, akiknek előzőleg sztatin-intoleranciája van.47-49
Újdonságú cukorbetegség: A sztatinhasználattal kapcsolatos fontos AE az újonnan kialakuló cukorbetegség. Kimutatták, hogy a sztatinok növelik a cukorbetegség kialakulásának kockázatát, bár számos fontos figyelmeztetés létezik.50 Először is, bár ez valami osztályhatásnak tekinthető, az egyes specifikus sztatinok valódi kockázata még mindig nem ismert.51,52 A legnagyobb metában -analízis eddigi elemzése szerint a pravasztatin kockázata a legalacsonyabb, a szimvasztatin és az atorvastatin mérsékelt, a rozuvasztatiné a legmagasabb az újonnan kialakuló cukorbetegség kialakulásának kockázata.53 Ezen eredmények közül azonban egyik sem volt statisztikailag szignifikáns. A kockázat növekszik, mivel a sztatin dózisának növekedése következetlen volt. 54
A statin által kiváltott cukorbetegség leginkább azoknál a személyeknél fordul elő, akiknél már fennáll a cukorbetegség kialakulásának nagy kockázata. szindróma.50,55 Az egyik következetes megállapítás az volt, hogy a statinok által okozott cukorbetegség minden egyes új esete esetén több CVE megelőzhető a magasabb kockázatú betegeknél. A CV-szövődmények mérsékelt vagy magas kockázattal járó súlyos sztatinhasználók, hogy a cukorbetegség kialakulásának kockázatát több mint ellensúlyozza a CV kockázatcsökkentő előnye. A kockázat-haszon arány azonban nem világos azoknál a betegeknél, akiknek a CVE-k kockázata nagyon alacsony. 50
KÖVETKEZTETÉS
Bár a sztatin-terápia nem kockázat nélküli, előnyei a CV-kimenetel csökkentésében a CVE megelőzésének alapkövévé tette. A rendelkezésre álló irányelvek nagyban különböznek egymástól, de az az állandó, hogy a sztatinoknak szinte minden betegnél elsődleges terápiának kell lenniük az elsődleges és a másodlagos megelőzésben. A sztatinok széles körű általános elérhetősége ezeket a szereket egyre hozzáférhetőbbé tette. Annak megértésével, hogy nem minden sztatin azonos, a gyógyszerész segíthet a lehető legjobb eredmény biztosításában minden beteg számára.
1. IMS Egészségügyi Informatikai Intézet. A gyógyszerek felhasználása és kiadásai az Egyesült Államokban: 2015 áttekintése és kilátások 2020-ig. https://morningconsult.com/wp-content/uploads/2016/04/IMS-Institute-US-Drug-Spending-2015.pdf. Hozzáférés: 2018. március 18.
2. Lipitor (atorvasztatin) csomagolás. New York, NY: Pfizer, Inc.; 2017. június.
3. Lescol / Lescol XL (fluvasztatin) csomagolás. Kelet-Hannover, NJ: Novartis Pharmaceuticals Corp; 2017. augusztus.
4. Mevacor (lovastatin) csomagolás. Whitehouse állomás, New Jersey: Merck & Co, Inc; 2014. február.
5. Pravachol (pravastatin) csomagolás. Princeton, NJ: Bristol-Myers Squibb Company; 2016. július.
6. Crestor (rosuvastatin) csomagolás. Wilmington, DE: AstraZeneca Pharmaceuticals LP; 2017. augusztus.
7. Zocor (szimvasztatin) csomagolás. Whitehouse állomás, New Jersey: Merck & Co, Inc; 2015. február.
8. Altoprev (lovasztatin) csomagolás. Zug, Svájc: Covis Pharma; 2017. április.
9. FloLipid (szimvasztatin) csomagolás. Brooksville, FL: Salerno Pharmaceuticals LP; 2017. július.
10. Livalo (pitavasztatin) csomagolás. Montgomery, AL: Kowa Pharmaceuticals America, Inc.; 2016. november.
11. Caduet (amlodipin / atorvastatin) csomagolás. New York, NY: Pfizer Inc.; 2017. október.
12. Vytorin (ezetimibe / szimvasztatin) csomagolás. Whitehouse állomás, New Jersey: Merck & Co, Inc; 2018. február.
13. AbbVie Inc.; az Advicor és a Simcor új gyógyszeres alkalmazásainak jóváhagyásának visszavonása. www.federalregister.gov/documents/2016/04/18/2016-08894/abbvie-inc-withdrawal-of-approval-of-new-drug-applications-for-advicor-and-simcor. Hozzáférés: 2018. március 18.
14. Jellinger PS, Handelsman Y, Rosenblit PD és mtsai. Amerikai Klinikai Endokrinológusok Szövetsége és az American Endocrinology College az iránymutatások a diszlipidémia kezeléséhez és a szív- és érrendszeri betegségek megelőzéséhez. Endocr Pract. 2017; 23 (2. kiegészítés): 1–87.
15. LaRosa JC, Grundy SM, Waters DD és mtsai. Stabil koszorúér-betegségben szenvedő betegeknél intenzív lipidcsökkentés atorvasztatinnal. N Engl J Med. 2005; 352: 1425-1435.
16. Ridker PM, Danielson E, Fonseca FA és mtsai. Rozuvasztatin az érrendszeri események megelőzésére magas C-reaktív fehérjével rendelkező férfiaknál és nőknél N Engl J Med. 2008; 359: 2195-2207.
17. Mihaylova B, Emberson J, Blackwell L és mtsai. Az LDL-koleszterinszint csökkentésének hatásai statin-terápiával azoknál az embereknél, akiknek alacsony az érrendszeri betegség kockázata: 27 randomizált vizsgálat egyedi adatainak metaanalízise. Gerely. 2012; 380: 581-590.
18. Baigent C, Landray MJ, Reith C és mtsai. Az LDL-koleszterinszint csökkentésének hatásai a szimvasztatinnal és ezetimibel krónikus vesebetegségben szenvedő betegeknél (Study of Heart and Renal Protection): randomizált, placebo-kontrollos vizsgálat. Gerely. 2011; 377: 2181-2192.
19. Cannon CP, Braunwald E, McCabe CH és mtsai.Intenzív versus mérsékelt lipidszint-csökkentés statinokkal akut koszorúér szindrómák után. N Engl J Med. 2004; 350: 1495-1504.
20. Stone NJ, Robinson JG, Lichtenstein AH és mtsai. 2013. évi ACC / AHA iránymutatás a vér koleszterin kezeléséről az érelmeszesedéses kardiovaszkuláris kockázat csökkentése érdekében felnőtteknél: az American College of Cardiology / American Heart Association Task Force gyakorlati iránymutatásokról szóló jelentése. Keringés. 2014; 129 (25, 2. kiegészítés): S1-S45.
21. Amerikai Kardiológiai Főiskola. ASCVD kockázatbecslő plusz. http://tools.acc.org/ASCVD-Risk-Estimator. Hozzáférés: 2018. március 18.
22. Wenger NK, Lewis SJ, Herrington DM és mtsai. A magas vagy alacsony dózisú atorvasztatin alkalmazásának eredményei 65 éves vagy annál idősebb, stabil szívkoszorúér betegségben szenvedő betegeknél. Ann Intern Med. 2007; 147: 1–9.
23. J. juhász, Blauw GJ, Murphy MB és mtsai. Pravasztatin az érrendszeri betegségek kockázatának kitett idős egyéneknél (PROSPER): randomizált, kontrollált vizsgálat. Gerely. 2002; 360: 1623-1630.
24. Teng M, Lin L, Zhao YJ és mtsai. Statinok a szív- és érrendszeri betegségek elsődleges megelőzésére idős betegeknél: szisztematikus áttekintés és metaanalízis Kábítószer öregedés. 2015; 32: 649-661.
25. Kjekshus J, Apetrei E, Barrios V és mtsai. Rozuvasztatin idősebb, szisztolés szívelégtelenségben szenvedő betegeknél. N Engl J Med. 2007; 357: 2248-2261.
26. Ginsberg HN, Elam MB, Lovato LC és mtsai. A kombinált lipidterápia hatásai 2-es típusú diabetes mellitusban. N Engl J Med. 2010; 362: 1563-1574.
27. Kastelein JJ, Akdim F, Stroes ES és mtsai. Szimvasztatin ezetimibel vagy anélkül familiáris hiperkoleszterinémiában. N Engl J Med. 2008; 358: 1431-1443.
28. Cannon CP, Blazing MA, Giugliano RP és mtsai. Az ezetimib akut koszorúér szindrómák után adta a sztatin terápiát. N Engl J Med. 2015; 372: 2387-2397.
29. Sabatine MS, Giugliano RP, Keech AC és mtsai. Evolocumab és klinikai eredmények szív- és érrendszeri betegségekben. N Engl J Med. 2017; 376: 1713-1722.
30. Lloyd-Jones DM, Morris PB, Ballantyne CM és mtsai. Az ACC szakértői konszenzusról szóló 2016. évi útvonalának 2017-es fókuszú frissítése az LDL-koleszterinszint-csökkentés nem sztatin-terápiáinak szerepéről az érelmeszesedéses kardiovaszkuláris betegségek kockázatának kezelésében: az American College of Cardiology Task Force jelentése a szakértői konszenzusos döntési utakról. J Am Coll Cardiol. 2017; 70: 1785-1822.
31. ODYSSEY-eredmények: Az eredmények arra utalnak, hogy a PCSK9 inhibitor csökkenti a CV eseményeket, az LDL-C-t ACS-ben szenvedő betegeknél. Amerikai Kardiológiai Főiskola. www.acc.org/latest-in-cardiology/articles/2018/03/05/15/53/sat-9am-odyssey-outcomes-cv-outcomes-with-alirocumab-after-acs-acc-2018. Hozzáférés: 2018. június 20.
32. Wallace A, Chinn D, Rubin G. Szimvasztatin bevétele reggel és este összehasonlítva: randomizált kontrollált vizsgálat. BMJ. 2003; 327: 788.
33. Wiggins BS, Saseen JJ, Page RL és mtsai. Ajánlások a klinikailag jelentős gyógyszer-gyógyszer kölcsönhatások kezelésére a sztatinokkal és a szív- és érrendszeri betegségekben szenvedő betegeknél alkalmazott szelektív szerekkel: az American Heart Association tudományos nyilatkozata. Keringés. 2016; 134: e468-e495.
34. Pacerone (amiodarone) csomagolás. Maple Grove, Minnesota: Upsher-Smith Laboratories LLC; 2017. július.
35. Norvasc (amlodipin) csomagolás. New York, NY: Pfizer Inc.; 2017. október.
36. Cardizem (diltiazem) csomagolás. Bridgewater, NJ: Valeant Pharmaceuticals; 2016. november.
37. Calan (verapamil) csomagolás. New York, NY: Pfizer Inc.; 2017. szeptember.
38. Riaz H, Khan AR, Khan MS és mtsai. A statin intolerancia prevalenciájáról végzett placebo-kontrollos randomizált, kontrollált vizsgálatok metaanalízise. Am J Cardiol. 2017; 120: 774-781.
39. Zhang H, Plutzky J, Shubina M, Turchin A. Folytatódó sztatin előírások a mellékhatások és a beteg kimenetele után: kohorsz vizsgálat. Ann Intern Med. 2017; 167: 221–227.
40. Tomaszewski M, Stepien KM, Tomaszewska J, Czuczwar SJ. Statin által kiváltott myopathiák. Pharmacol Rep. 2011; 63: 859-866.
41. Stroes ES, Thompson PD, Corsini A és mtsai. Statin-asszociált izomtünetek: hatás a statin-terápiára – European Atherosclerosis Society Consensus Panel nyilatkozata az értékelésről, az etiológiáról és a kezelésről. Eur Heart J. 2015; 36: 1012-1022.
42. Gupta A, Thompson D, Whitehouse A és mtsai. Nem vakított, de nem vakon sztatin-terápiával járó nemkívánatos események az anglo-skandináv kardiális eredmények vizsgálatában – lipidszint-csökkentő kar (ASCOT-LLA): randomizált kettős-vak, placebo-kontrollos vizsgálat és annak nem randomizált, nem vak kiterjesztése fázis. Gerely. 2017; 389: 2473-2481.
43. Pedro-Botet J, Rubiés-Prat J. Statinnal társított izomtünetek: óvakodjunk a nocebo-hatástól. Gerely. 2017; 389: 2445-2446.
44. Laufs U, Filipiak KJ, Gouni-Berthold I és mtsai. A statinnal összefüggő izomtünetek kezelésének gyakorlati szempontjai (SAMS). Atheroscler Suppl. 2017; 26: 45–55.
45. Az FDA gyógyszerbiztonsági közleménye: új korlátozások, ellenjavallatok és dóziskorlátozások a Zocor (szimvasztatin) számára az izomkárosodás kockázatának csökkentése érdekében. www.fda.gov/Drugs/DrugSafety/ucm256581.htm. Hozzáférés: 2018. március 18.
46.Banach M, Serban C, Sahebkar A és mtsai. A Q10 koenzim hatása a statin által kiváltott myopathiára: randomizált, kontrollált vizsgálatok metaanalízise. Mayo Clin Proc. 2015; 90: 24-34.
47. Goldberg AS, DeGorter MK, Ban MR és mtsai. Hatásosság és plazmakoncentráció a rozuvasztatin nem napi adagolása mellett. Lehet J Cardiol. 2013; 29: 915-919.
48. Matalka MS, Ravnan MC, Deedwania PC. Az atorvasztatin alternatív napi adagja hatékony a hiperlipidémiás betegek kezelésében? Az alternatív napi és az atorvasztatin napi adag összehasonlítása (ADDAS). Am Heart J. 2002; 144: 674-677.
49. Copher HR, Stewart RD. Napi adagolás, szemben a szimvasztatin alternatív napi adagolásával hiperkoleszterinémiában szenvedő betegeknél. Farmakoterápia. 2002; 22: 1110-1116.
50. Rochlani Y, Kattoor AJ, Pothineni NV és munkatársai. Az elsődleges megelőzés és a statin által kiváltott diabetes mellitus megelőzésének egyensúlya. Am J Cardiol. 2017; 120: 1122-1128.
51. Corrao G, Ibrahim B, Nicotra F és mtsai. A sztatinok és a cukorbetegség kockázata: bizonyíték egy nagy populációalapú kohorszos vizsgálatból. Cukorbetegség ellátása. 2014; 37: 2225-2232.
52. Lim S, Oh PC, Sakuma I, Koh KK. Hogyan lehet egyensúlyba hozni a sztatinok kardiorenometabolikus előnyeit és kockázatait. Atherosclerosis. 2014; 235: 644-648.
53. Navarese EP, Buffon A, Andreotti F és mtsai. A különböző típusú és dózisú sztatinok újdonsült diabetes mellitusra gyakorolt hatásának metaanalízise. Am J Cardiol. 2013; 111: 1123-1130.
54. Crandall JP, Mather K, Rajpathak SN és mtsai. A sztatinhasználat és a cukorbetegség kialakulásának kockázata: a Diabetes Megelőzési Program eredményei. BMJ Open Diabetes Res Care. 2017; 5: e000438.
55. Ganda OP. Statin által kiváltott cukorbetegség: előfordulása, mechanizmusai és következményei. F1000Res. 2016; 5.